Причины падения плотности электролита в аккумуляторе – Taxi Bolt
Владельцы автомобилей часто сталкиваются с проблемой отказа двигателя от запуска. Подобное случается из-за разрядки аккумулятора и ухудшения свойств электролита. Перед тем как поднять плотность в аккумуляторе, нужно выяснить причину ухудшения качества кислотного раствора.
После этого можно приступать к восстановлению батареи. Действия не представляют особых сложностей.
В процессе эксплуатации снижение плотности аккумулятора обычное явление, особенно при несвоевременной замены старого электролита.
Почему снижается плотность электролита
Снижению плотности способствуют такие факторы:
- Разряд. При потере заряда снижается и плотность наполнителя. Во процессе зарядки этот параметр постепенно увеличивается. Если батарея утрачивает большую часть емкости, речь идет о падении концентрации кислоты.
- Длительная эксплуатация или хранение в условиях низких температур.
- Выкипание электролита при перезаряде. Если зарядное устройство подает слишком высокое напряжение, жидкий электролит переходит в газообразное состояние и выводится наружу через имеющиеся на корпусе отверстия.
- Частое добавление воды. Водители добавляют жидкость для поддержания стабильного уровня электролита. Не все пользуются ареометром, измеряющим плотность. Вместе с водой выкипает и кислота, что приводит к снижению концентрации.
Пример сульфатации пластин автомобильного аккумулятора.
Опасности низкой и высокой концентрации кислоты
Повышенная концентрация электролита становится причиной преждевременного выхода батареи из строя. Кислота разрушает металлические пластины. К воздействию составов на основе серной кислоты чувствительна даже сталь. Низкая концентрация приводит к таким проблемам:
- Сульфатация. На пластинах появляется налет, состоящий из сульфата свинца. Аккумуляторная батарея становится неспособной принимать заряд.

- Повышение порога замерзания. Жидкость кристаллизуется уже при -5°С. Лед сдвигает и повреждает металлические детали. При деформации пластин и коротком замыкании емкостей батарею восстановить невозможно. При плотности 1,28 г/см³ электролит замерзнет только при -58°С.
- Проблемы при запуске двигателя. Наиболее выражен этот признак в зимний период.
Для проверки плотности электролита используют денсиметр (справа).
Проверка плотности электролита
Определить плотность электролита можно в домашних условиях. Процедуру рекомендуется проводить при комнатной температуре. Перед началом работы подготавливают такие инструменты:
- Защитные перчатки, костюм и очки. В состав наполнителя аккумулятора входит кислота. При попадании на кожу вещество вызывает химический ожог. Опасными являются и пары кислоты, поэтому работают только в хорошо проветриваемом помещении.
- Денсиметр. Прибор используется для измерения плотности. Имеет вид стеклянной трубки с грушей и встроенным ареометром.
Самостоятельно измерение плотности выполняют так:
Для проверки плотности электролита конец денсиметра погружают в ёмкость аккумулятора.
- Аккумулятор вынимают из посадочного гнезда. Защитный кожух демонтируют, вывинчивают пробки.
- Проверяют уровень электролита. В свинцово-кальциевых батареях раствор должен на 1,5 см закрывать пластины.
- Батарею полностью заряжают. Проверку плотности начинают через 5-6 часов после завершения зарядки. При нормальном уровне электролита трубку денсиметра погружают в банки, выкачивая небольшое количество жидкого наполнителя.
- Оценивают показатели прибора. Ареометр должен свободно плавать в растворе. Соприкосновение прибора со стенками емкости не допускается. Показания оценивают с учетом температуры окружающей среды.
- Проверяют плотность электролита в остальных банках. Показания записывают и сравнивают с нормальной плотностью.
Такой способ проверки подходит только для разборной батареи, когда имеется доступ к электролиту.
Как откорректировать плотность раствора
Нормальное показание лежит в диапазоне 1,25-1,29 г/см³. Если при температуре +25°С отмечается более низкое значение, его нужно повышать. Падение концентрации в одной из банок свидетельствует о коротком замыкании.
[attention type=yellow]Высокие значения выявляются после зарядки мощным током, сопровождающейся кипением электролита. Повысить плотность можно путем добавления кислоты, заправки готового состава или использования зарядного устройства.[/attention]
Плотность раствора в холодный период
В холодное время года плотность наполнителя заряженного аккумулятора должна составлять 1,27 г/см³. Дополнительная корректировка в регионах с суровым климатом при смене сезона не проводится.
Таблица зависимости плотности электролита в аккумуляторе от температуры.
Подготовка к восстановлению батареи
- Замеряется этот основной показатель автомобильной батареи при температуре около 22 градусов. Сделать этом можно при помощи специального прибора – ареометра. При этом работать можно только в перчатках и защитных очках, чтобы избежать возможных ожогов.
- При приготовлении нового электролита кислота добавляется в воду. Если же сделать наоборот, жидкость начнет кипеть, что может привести к кислотным ожогам.
- Переворачивать аккумулятор при работе с ним категорически запрещено, поскольку при этом могут посыпаться его пластины, что приведет к выходу прибора из строя.
- Наперед следует подготовить емкости, в которые будет сливаться старая жидкость и готовиться новая.
- Потребуются точные расчеты необходимого объема кислоты, поскольку в процессе зарядки плотность жидкости в АКБ возрастет.
Повышение плотности электролита
Если плотность составляет более 1,18, доливают готовый состав с нормальной концентрацией серной кислоты.
- Разрядка батареи. Долив электролита проводится только при полном разряде. Для этого АКБ подключают к мощной лампе или другому потребителю энергии.
- Подготовка корректирующего компонента. Уровень кислоты в таком средстве должен составлять не менее 1,4 г/см³.
- Добавление корректирующего состава. Предварительно откачивают часть имеющегося электролита. Густота раствора должна повыситься до 1,25. Действие выполняется для каждой банки. Объем доливаемой жидкости должен составлять не более 50% от откачанного. После добавления жидкости АКБ встряхивают, давая наполнителю перемешаться.
- Зарядка батареи. Аккумулятор оставляют на полчаса, что позволяет концентрации в банках выровняться. Элемент питания подключают к зарядному устройству на 30 минут. Сила тока должна быть минимальной. Через 2 часа после прекращения зарядки замеряют плотность и количество наполнителя. Если концентрация не поднимается, вышеуказанные действия повторяют.
Можно ли повысить минимальную плотность
Если уровень плотности раствора, что проводит ток в АКБ автомобиля упал намного ниже 1,18 г/см3, поднимать ее нет никакого смысла. В таком случае необходимо слить весь раствор, заменив его свежим.
Сначала с банок откачивается с помощью спринцовки как можно больше электролита. Далее батарея помещается в большую емкость, аккуратно переворачивается на бок, в дне каждой банки просверливается небольшое отверстие. Перевернув прибор, с него сливаются все излишки оставшейся жидкости.
Далее через крышки банок заливается дистиллированная вода с целью их промывания. После этого проделанные отверстия запаиваются пластмассой, стойкой к воздействию электролитической жидкости.
Сделав это, в АКБ заливается свежий раствор, после чего прибор будет готов к использованию. Недостатком подобного способа является то, что в конечном результате снижается срок службы устройства, но некоторое время оно все еще поработает до покупки нового.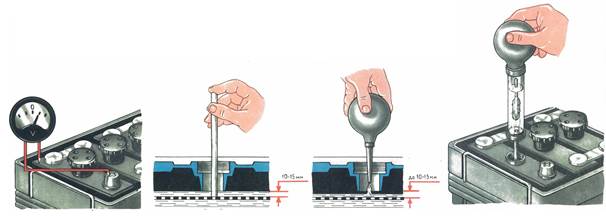
Почему снижается плотность электролита?
Чаще всего с целью поддерживать на требуемом уровне количество жидкости внутри автомобильной батареи владельцы машины доливают туда дистиллированную воду. При этом редко проверяется плотность получившегося раствора. Вместе с тем, когда количество дистиллированной воды будет достаточно большим, при подзарядке вместе с этой жидкостью будет выкипать и электролит, что и приводит к снижению его плотности.
Рано или поздно этот показатель упадет ниже критического уровня, и завести транспортное средство уже не получиться.
В таком случае возникает необходимость повысить этот параметр раствора в аккумуляторе, что вернет его работоспособность.
Плотность ниже минимального значения
Бывают такие случаи, когда уровень этого показателя опускается ниже отметки 1,18. В таком случае вышеописанный способ ничем не поможет.
Чтобы восстановить работоспособность аккумуляторной батареи, вместо электролитического раствора нужно использовать кислоту, плотность которой выше, чему у электролита. При этом все действия проводятся точно так же, как и в предыдущем случае до того времени, пока показатель не придет в норму.
Как повысить при помощи зарядного устройства
Если концентрация кислоты упала за зиму, ее можно восстановить путем подачи слабого тока. Зарядка занимает не менее 3 суток, она считается эффективной при невозможности восстановления АКБ другими методами. Содержимое набравшей полную мощность батареи при зарядке начинает кипеть. Признаком испарения воды является образование мелких пузырьков на поверхности.
Избыток жидкости испарится, концентрация кислоты увеличится. Общий уровень наполнителя станет маленьким, поэтому придется добавлять готовый аккумуляторный раствор. После завершения процедуры пользуются ареометром. Если показатели прибора слишком низкие, зарядку и добавление электролита повторяют.
Напряжение аккумулятора и плотность электролита
ПОДБОР АККУМУЛЯТОРА ПО ХАРАКТЕРИСТИКАМ
ПОДБОР АККУМУЛЯТОРА ПОД АВТОМОБИЛЬ
При эксплуатации аккумулятора рано или поздно приходится сталкиваться с его обслуживанием. Обслуживание аккумулятора всегда подразумевает знакомство с понятием напряжение аккумулятора и плотность электролита.
Напряжение аккумулятора
Напряжение автомобильного аккумулятора делится на 2 типа: номинальное, фактическое и под нагрузкой. Номинальное напряжение легкового автомобильного аккумулятора равняется 12 вольт. Фактическое напряжение у полностью заряженного аккумулятора колеблется в пределах от 12,4В до 12,8В. Напряжение под нагрузкой (200А) должно быть не менее 9,5В, но как правило оно составляет у новой АКБ 10,3-10,7В. Оно при нагрузке в течении 10 секунд не должно упасть ниже минимума. Напряжение под нагрузкой измеряется для получения информации способности АКБ «держать» напряжение при запуске двигателя, то есть при потреблении стартером. Допустимым для эксплуатации является напряжение 12,5 В, что является 82% зарядки аккумуляторной батареи. Более подробно о зависимости степени зарядки АКБ от процента заряженности приведено на рисунке.
Проверка напряжения АКБ.
Для проверки напряжения аккумулятора нам необходим инструмент для измерения – вольтметр, нагрузочная вилка или мультиметр. Чтобы измерить напряжение АКБ, необходимо заглушить автомобиль, подождать 30 минут пока уйдет поверхностное напряжение и вольтметром измерить напряжение на клеммах. Чтобы измерить напряжение под нагрузкой, необходимо использовать нагрузочную вилку. Напряжение АКБ на полюсных выводах зависит от температуры электролита (в идеале надо проверять при температура 25 градусов)– таблица зависимости приведена ниже.
Проверка плотности аккумулятора.
Для проверки плотности АКБ необходимы следующие инструмента: плоская отвертка (если на каждой банке стоит пробка – отвертка должна быть большой), ареометр. Если на аккумуляторы стоит общая крышка-планка, ее необходимо аккуратно отщелкнуть для доступа к электролиту. В ареометр набрать из первой банки электролит, снять показания с меток поплавка. Как правильно снимать данные с поплавка ареометра показано на рисунке. Плотность необходимо измерять в каждой банке – они не являются сообщающимися сосудами и бывает, что плотность может колебаться в банках в пределах до 0,02. Если в одной из банок плотность электролита резко отличается от других и стремится к единице, то скорее всего в этой банке скорее произошло короткое замыкание, что является заводским дефектом и подлежит замене продавцом (хотя это может быть следствием других деффектов). Кстати, индикатор заряда, установленных на некоторых моделях АКБ работает по принипу ареометра — шарик, как и поплавок всплывает при нормальной плотности электролита. Причем это шарик, а не лампочка, как многие думают.
Плотность необходимо измерять в каждой банке – они не являются сообщающимися сосудами и бывает, что плотность может колебаться в банках в пределах до 0,02. Если в одной из банок плотность электролита резко отличается от других и стремится к единице, то скорее всего в этой банке скорее произошло короткое замыкание, что является заводским дефектом и подлежит замене продавцом (хотя это может быть следствием других деффектов). Кстати, индикатор заряда, установленных на некоторых моделях АКБ работает по принипу ареометра — шарик, как и поплавок всплывает при нормальной плотности электролита. Причем это шарик, а не лампочка, как многие думают.
Плотность аккумулятора должна быть в пределах 1,26-1,28 при температуре 25 градусов Цельсия.
Повышение плотности аккумулятора.
Плотность электролита аккумулятора повышают одним единственным путем – путем зарядки аккумулятора. Доливать электролит для поднятия плотности ни в коем случае нельзя – это самый страшный бред, который могли придумать мастера-самоучки, не понимающие законов химии и физики, т.к. это приведет к ускоренному осыпанию активной массы и убьет аккумулятор. Электролит доливают только в случае, если произошло проливания электролита из АКБ, но эту процедуру лучше доверить профессионалом. Есть одно исключение – для северных регионов России (в районах с вечной мерзлотой) допускается поднятие плотности будет доливки электролита до плотности 1,30 – это делают для поднятия температуры замерзания электролита, не более. Такие аккумуляторы служат в среднем 1 год. Для теплого климата плотность электролита намерено уменьшают, чтобы продлить его срок службы.
Напряжение автомобильного аккумулятора и плотность взаимосвязаны. При повышении напряжения, плотность аккумулятора растет.
Аккумулятор это химический источник тока, для исправной работы которого должны протекать определенные химические процессы. В процессе разряда аккумулятора, серная кислота «прилипает» к отрицательному электроду, образуя нерастворимый сульфат свинца, оставл
В процессе разряда аккумулятора, серная кислота «прилипает» к отрицательному электроду, образуя нерастворимый сульфат свинца, оставл
Очень часто от продавцов в автомагазинах можно услышать рекомендации о гибридных аккумуляторах. Так что же такое гибридный аккумулятор? Гибридный аккумулятор для автомобиля внешне не отличим от других кислотных аккумуляторов, не считая обозначения на этик
В жигулевскую эпоху завести одну машину от другой было в порядке вещей. А сейчас?
%TEXTAREA_VALUE
Сохранить Отменить
Ваш комментарий успешно добавлен и будет опубликован после просмотра модератором.
Плотность электролита в аккумуляторе: какая должна быть, как проверить, как поднять
Бортовая сеть автотранспортного средства объединяет в себе источники и потребители электроэнергии. АКБ и генератор выступают энергоисточниками, тогда как вторая группа включает в себя целый комплекс устройств и агрегатов. Среди них первостепенное значение имеют система зажигания и запуска, контрольно-измерительные приборы, сигнализация, лампы в фарах и габаритных огнях.
В электросети автомобиля также присутствует множество дополнительных приспособлений, обеспечивающих комфорт и безопасность водителя и пассажиров. К ним относятся подогрев стёкол и сидений, акустическая система, прикуриватель, GPS-навигатор, видеорегистратор и т.д.
В случае аварийного выхода из строя генератора или реле контроля напряжения именно аккумулятор берёт на себя поддержание работоспособности всех электропотребителей, сохраняя возможность безопасного передвижения автотранспорта до ближайшей станции техобслуживания. Также он стабилизирует напряжение в системе, когда двигатель длительное время работает на низких оборотах или холостом ходу, как это часто бывает при передвижении в городской черте.
На современном рынке автотоваров наибольшим потребительским спросом пользуется свинцово-кислотный АКБ, который нашёл самое широкое применение в транспортных средствах из-за своей надёжности, функциональности и высокой удельной мощности. Главными конструктивными элементами такого устройства являются шесть секций или попросту «банок», внутри которых находится блок свинцовых пластин.
Главными конструктивными элементами такого устройства являются шесть секций или попросту «банок», внутри которых находится блок свинцовых пластин.
Активной массой положительного электрода является диоксид свинца, а отрицательного – чистый свинец. Между ними расположены сепараторы, основное назначение которых заключается в разделении полублоков разной полярности и препятствии возникновению самозамыканий. Все электрохимические реакции протекают в водном растворе серной кислоты – электролите. Когда батарея разряжается, его плотность снижается из-за активного расхода кислотного агента и выделения молекул воды. При заряде происходит обратный процесс.
Когда следует проверять плотность электролита в АКБ?
Эксплуатация стартерной батареи должна сопровождаться систематическим мониторингом её состояния даже при безотказном и уверенном функционировании. Это связано с тем, что снижение резервного уровня электролита из-за утечки раствора или испарения воды приводит к увеличению кислотной концентрации. Данный фактор негативно сказывается на работоспособности и продолжительности эксплуатации АКБ.
Опытные автомеханики рекомендуют проверять техническое состояние аккумулятора каждые 15-20 тыс. км пробега. Также диагностику целесообразно провести, если он постоянно недозаряжается, плохо держит заряд или туго крутит стартер. Для этого необходимо:
- визуально осмотреть корпус на наличие трещин и подтёков;
- оценить уровень электролитической жидкости в банках, который должен возвышаться над верхним краем пластин на 1.2-1.4 см;
- измерить её плотность с помощью контрольно-измерительного прибора.
Нередко сниженный заряд может быть следствием ослабления ремня привода генератора. Поэтому автомобилисту нужно периодически проверять его натяжение и при необходимости производить регулировку, следуя инструкции по эксплуатации ТС.
Оптимальные показатели электролитической среды
Физико-химическое состояние электролита находится в прямой зависимости от двух параметров – это температура окружающей среды и степень заряженности АКБ. При повышении температурного порога возрастает удельный вес кислоты, а при понижении — падает. Поэтому перед проведением контрольно-измерительных мероприятий аккумулятор рекомендуется выдержать в течение нескольких часов при температуре +20-25 ℃.
При повышении температурного порога возрастает удельный вес кислоты, а при понижении — падает. Поэтому перед проведением контрольно-измерительных мероприятий аккумулятор рекомендуется выдержать в течение нескольких часов при температуре +20-25 ℃.
Типовые климатические условия региона также оказывают непосредственное влияние на плотность электролитического раствора. Так, в районах с умеренным климатом ρ= 1.27-1.28 г/см3 соответствует 100% заряда, величина 1.21 г/см3 говорит о его снижении до 60%, а 1.18 г/см3 сигнализирует о необходимости подзарядки. Измерения производятся при нормальном уровне реагента над пластинами.
В северных регионах оптимальной считается плотность электролита, равная 1.29-1.30 г/см3, а в субтропическом поясе – 1.23-1.25 г/см3. Измерение данного параметра с целью определения необходимости корректировки производится только у полностью заряженного устройства, иначе полученные результаты будут некорректными.
Алгоритм проверки плотностного состояния электролита
Определение плотности электролита осуществляется при помощи такого приспособления, как ареометр. Перед началом измерительных процедур автовладельцу следует проверить уровень спецжидкости в каждой секции АКБ и при необходимости произвести его корректировку деминерализованной водой. После этого аккумулятор необходимо полностью зарядить и по прошествии 2-3 часов приступать к тесту. Алгоритм его проведения состоит из следующих шагов:
- установить устройство на ровную поверхность;
- вывернуть пробку заливного отверстия на его крышке;
- погрузить в раствор ареометр и втянуть жидкость резиновым наконечником на его противоположном конце;
- набрать количество реагента, достаточное для свободного перемещения поплавка;
- определить уровень плотности в соответствии с информацией на шкале;
- записать результат и повторить манипуляции с оставшимися банками;
- сопоставить полученные данные с нормированными значениями.

Значение плотности должно быть одинаковым во всех элементах, допускается отклонение на ±0.01. Если проведённый замер показал понижение плотности в одной из ячеек на 0.10-0.15, то это говорит о наличии дефекта или короткого замыкания между пластинами. Одинаково низкая плотность во всех блоках связана с глубоким разрядом аккумулятора, его сульфатацией или сильным износом, что влечёт за собой падение напряжения в сети и затруднённый пуск ДВС.
У необслуживаемых стартерных батарей есть особый встроенный индикатор. Если он показывает зелёный цвет, то это говорит о 100%-ном заряде АКБ, а чёрный – о необходимости его подзарядки. Бело-жёлтый или красный оттенок обычно соответствуют очень низкому уровню электролита.
Плотность электролита и зимние холода
Данная величина носит относительный характер, поэтому при смене времён года она не должна подвергаться каким-либо изменениям. Автомобилисту нужно лишь следить за тем, чтобы она не отклонялась от рекомендуемого значения, а также производить стабилизацию при обнаружении отклонений.
Производители стартерного оборудования считают недопустимым использование в зимний период устройств с 25%-ной потерей заряда, т.е. плотность электролитической среды которых составляет 1.24 г/см3. Данный факт обусловлен предотвращением возможности обледенения ячеек аккумулятора и снижением вредоносного воздействия глубокого разряда, вызванного саморазрушением активной массы пластин.
Продолжительная эксплуатация аккумулятора с пониженной плотностью в морозы приводит к снижению электродвижущей силы, затруднённому пуску двигателя, образованию льда и разрушению свинцовых пластин. Доливать деминерализованную воду с целью восстановления уровня реагента над блоками следует прямо перед выездом на улицу, либо при стационарной подзарядке батареи. Это исключает вероятность замерзания долитой воды до того, как она успеет перемешаться с холодным электролитом.
Как поднять плотность электролита?
Каждый водитель может своими силами повысить плотность электролита в АКБ автомобиля, не обращаясь к мастерам сервисного центра. Первым делом нужно подготовить необходимые расходные материалы, среди которых деминерализованная вода, аккумуляторная кислота или уже готовый электролитический раствор, а также средства индивидуальной защиты для глаз и кожного покрова. Кроме того, следует обзавестись следующим оборудованием для работы: ареометром, спринцовкой, стеклянной ёмкостью, мерным стаканом и воронкой.
Первым делом нужно подготовить необходимые расходные материалы, среди которых деминерализованная вода, аккумуляторная кислота или уже готовый электролитический раствор, а также средства индивидуальной защиты для глаз и кожного покрова. Кроме того, следует обзавестись следующим оборудованием для работы: ареометром, спринцовкой, стеклянной ёмкостью, мерным стаканом и воронкой.
Снятый с автомобиля аккумулятор помещается на устойчивую поверхность, а пробки его заливных отверстий аккуратно откручиваются. Далее максимальный объём реагента выкачивается из банок и сливается в заранее подготовленный резервуар. Набирать нужно как можно больше вещества, измеряя его объём мерным стаканом, чтобы затем долить идентичное количество нового.
Лучше использовать самостоятельно разведённый раствор с плотностью немного выше расчётной для текущего климатического режима. При его приготовлении кислота добавляется в воду, обратный порядок смешения может вызвать серьёзные термические повреждения.
Сперва свежий электролит заполняет только ½ объёма, что был откачан. Затем АКБ нужно слегка встряхнуть из стороны в сторону, чтобы оставшаяся жидкость и новая перемешались. Если после замера плотностное значение не отвечает норме, добавляем ещё половину от оставшегося в ячейке объёма. Действия повторяются до полной стабилизации плотности, остаток доливается деминерализованной водой по уровню.
Как можно заметить из приведённой выше информации, работать с электролитом не представляет особой сложности, если выполнять все манипуляции по инструкции и соблюдать установленные меры предосторожности.
Неисправности аккумуляторов | Эко Технологии
Неисправности аккумуляторных батарей
Из-за неправильного ухода и обслуживания, аккумуляторная батарея может выйти из строя. Неисправности и методы их устранения у тяговых и стартерных аккумуляторов аналогичны. Рассмотрим основные признаки поломок аккумуляторов и способы их устранения.
1. СульфатацияПризнаки:
Повышено напряжение на аккумуляторах в начале зарядки. Низкая плотность электролита к концу зарядки, не достаточная ёмкость. На пластинах образуется крупный кристаллический серно-кислый свинец, вследствие этого аккумулятор не принимает ток.
Низкая плотность электролита к концу зарядки, не достаточная ёмкость. На пластинах образуется крупный кристаллический серно-кислый свинец, вследствие этого аккумулятор не принимает ток.
Причины:
- Нерегулярная и недостаточная зарядка во время эксплуатации.
- Простой в разряженном состоянии.
- Эксплуатация при низком уровне электролита.
- Доливка электролита, вместо дистиллированной воды.
- Эксплуатация при высоких температурах.
Что делать?
Неглубокая сульфатация устраняется при помощи нескольких выравнивающих зарядов. При глубокой сульфатации проводятся более трудоёмкие работы, они описаны в каждом паспорте аккумулятора. Но процесс сульфатации необратим, поэтому в скором времени придется менять аккумулятор.
2. Короткое замыкание в аккумулятореПризнаки:
Плотность электролита не увеличивается во время зарядки. Высокая температура электролита и сильное отделение газов в неисправных аккумуляторах. Систематическое снижение плотности электролита в неисправном аккумуляторе при неполном коротком замыкании.
Причины:
В аккумуляторе может произойти короткое замыкание, связанное с осыпанием активной массы и разрушением свинцовой основы сепараторов.
Что делать?
В этом случае Вам лучше купить новый аккумулятор. Неустранимый дефект.
3. Повышенная саморазрядка аккумулятораПризнаки:
Аккумулятор быстро разряжается. Быстрое снижение напряжения и плотности электролита в неработающей батарее.
Причины:
Причиной быстрого саморазряда аккумулятора может быть либо загрязнение аккумуляторной батареи, либо загрязнение электролита.
Что делать?
В этом случае Вам надо протереть насухо контактные части аккумулятора, проверить чистоту электролита, по результату заменить электролит на новый.
Признаки:
Отсутствие напряжения на полюсных выводах или между отдельными аккумуляторами.
Причины:
Дефект сварки полюсного вывода или соединителя между аккумуляторами. Плохой контакт у болтовых соединений в результате плохой затяжки с неподходящим моментом вращения.
Что делать?
Новая сварка. Дополнительное затягивание болтовых соединений и проверка динамометрическим ключом.
5. Смена полярности аккумулятораПризнаки:
Пониженное общее напряжение аккумуляторной батареи. Глубокая разрядка батареи без интервалов для восстановления. Отделение газов из аккумуляторов.
Причины:
Неправильная связь с токовыпрямителем.
Что делать?
Трудноустранимый дефект. Рекомендуется замена аккумуляторной батареи.
6. Сильное окисление полюсных клемм аккумулятораПризнаки:
Напряжение на выводах батареи есть, а стартер не крутится. Клеммы греются. Это приводит к прекращению подачи тока или увеличению сопротивления в цепи, что может вывести из строя всю электрику.
Причины:
Не проводилась очистка полюсных клемм.
Что делать?
Необходимо снять клеммы и зачистить их, а также зачистить выводные штыри аккумулятора, потом поставить все на место, проверить надежность крепления клемм. Клемма должна крепко сидеть на штырях и не двигаться, затем сверху смазать клеммы техническим вазелином или его заменителем.
Эксплуатация авто аккумулятора зимой — AKBEXPERT
Какая плотность электролита должна быть зимой, и как подготовить аккумулятор к зиме?
Ответ:
Плотность электролита у полностью заряженной аккумуляторной батареи, предназначенной для эксплуатации в условиях умеренного климата в любое время года должна быть 1,27-1,30 г/см3 при температуре +25°С. При более высокой температуре электролита значение плотности должно быть ниже, а при более низкой температуре электролита, наоборот, — выше. В странах с тропическим климатом эксплуатируют батареи с более низкой плотностью электролита (1,22-1,24 г/см3). В условиях крайнего Севера, наоборот, требуется более высокая плотность электролита (1,30-1,32 г/см3).
Перед началом зимнего периода необходимо проверить, чтобы батарея находилась в заряженном состоянии. Это обеспечит предохранение от замерзания электролита и обеспечит надежный пуск двигателя при отрицательных температурах. Именно в зимний период существенное влияние на работу АКБ будут оказывать слабо натянутый ремень генератора и повышенная утечка электроэнергии.
При более высокой температуре электролита значение плотности должно быть ниже, а при более низкой температуре электролита, наоборот, — выше. В странах с тропическим климатом эксплуатируют батареи с более низкой плотностью электролита (1,22-1,24 г/см3). В условиях крайнего Севера, наоборот, требуется более высокая плотность электролита (1,30-1,32 г/см3).
Перед началом зимнего периода необходимо проверить, чтобы батарея находилась в заряженном состоянии. Это обеспечит предохранение от замерзания электролита и обеспечит надежный пуск двигателя при отрицательных температурах. Именно в зимний период существенное влияние на работу АКБ будут оказывать слабо натянутый ремень генератора и повышенная утечка электроэнергии.
Если при запуске двигателя в зимнее время аккумулятор разрядился в «ноль», какие действия нужно предпринять?
Ответ:
В данном случае необходимо зарядить аккумулятор от стационарного зарядного устройства током малой величины. Сделать это следует не позднее, чем через 2-3 дня после глубокого разряда батареи.
Почему замерзает электролит?
Ответ:
При разряде АКБ плотность электролита снижается, уменьшается удельное количество серной кислоты, содержащейся в растворе электролита и образуется вода. Чем глубже разряд батареи, тем выше отрицательная температура, при которой может замерзнуть электролит. Например, при плотности 1,11 г/см3 электролит замерзнет уже при -7 0С, а при плотности 1,27 г/см3 — только при -58 0С.
Если замерз электролит, можно ли восстановить работоспособность аккумулятора?
Ответ:
Зависит от степени замерзания: если батарея замерзла не на весь объем, а корпус не подвергся деформации, ее можно восстановить. Необходимо, чтобы лед полностью растаял при комнатной температуре, и только потом приступить к заряду АКБ. При этом не избежать повреждения электродов и снижения токовых характеристик батареи.
Если в мороз перед запуском двигателя включить на короткое время фары автомобиля, поможет ли это облегчить запуск?
Ответ:
Нет. При данной процедуре эффект разогрева электролита ничтожен и не влияет на увеличение мощности разряда. Напротив, батарея может потерять драгоценную емкость и после этого не сможет запустить двигатель.
При данной процедуре эффект разогрева электролита ничтожен и не влияет на увеличение мощности разряда. Напротив, батарея может потерять драгоценную емкость и после этого не сможет запустить двигатель.
Почему в зимнее время рекомендуют аккумуляторы с более высокими пусковыми токами?
Ответ:
Холодный пуск имеет следующие особенности:
- Стартеру требуется больше времени для прокрутки двигателя.
- Сопротивление холодного двигателя в зимнее время увеличивается в 2,5-3 раза
- От АКБ требуется отдача большей мощности и энергии.
- Чем ниже температура окружающего воздуха, тем выше вязкость электролита и внутреннее сопротивление батареи.
Пуск двигателя в зимнее время зависит только от АКБ?
Ответ:
Нет. Помимо технических характеристик и степени заряженности батареи, пуск двигателя зависит от следующих факторов:
- состояния электропроводки и электрооборудования автомобиля;
- состояния свечей;
- состояния топливной системы и качества топлива;
- качества масла;
- опыта водителя.
По какой причине замерз аккумулятор?
Ответ:
Если замерзла только одна ячейка, то это, скорее всего, внутренний дефект батареи, который привел к снижению плотности и замерзанию электролита.
Если замерзла не одна ячейка в батарее, то здесь ответ один — батарея была разряжена. Причины могут быть разные, самая распространенная — частые запуски двигателя и короткие дистанции движения по городу. В результате батарея в холодную погоду просто не успевает заряжаться от генератора. Плотность электролита 1,21 г/см3 соответствует примерно 45%-ной степени заряженности батареи. По справочным данным электролит с такой плотностью замерзает при температуре около -30 0С.
Часто бывает ситуация: утром с нескольких попыток не завелась машина, и человек едет на работу на общественном транспорте. А разряженная батарея с низкой плотностью электролита до вечера замерзает.
А разряженная батарея с низкой плотностью электролита до вечера замерзает.
Плотность электролита в аккумуляторе зимой: значения, как поднять?
Автомобилю, постоянно находящемуся в использовании, требуется надежный АКБ, который позволит быстро запустить двигатель вне зависимости от внешних факторов. Плотность электролита в аккумуляторе зимой необходимо держать в определенных рамках, чтобы жидкость не замерзла. Данный параметр является основным и оказывает существенное влияние на длительность службы источника питания.
При правильной и своевременной корректировке значений кислотности жидкости можно значительно увеличить срок службы АКБ. Ведь плотность электролита в аккумуляторе зимой и летом должна отличаться, чтобы компенсировать влияние температуры, влажности и других климатических условий на химические процессы.
Что такое плотность электролита и от чего она зависит?
Если говорить простым языком, то плотность — это кислотность жидкости в АКБ. В роли электролита сурьмянистые аккумуляторы используют смесь воды и серной кислоты. Количество последней по отношению к общему объему раствора и называют плотностью. Измеряют ее в граммах на сантиметр кубический (г/см3).
На степень закисленности основное влияние оказывают факторы, способные изменить количество воды в растворе: мороз, жара, влажность. Также на нее влияет степень заряда аккумуляторной батареи. Измерение показателей производятся специальным прибором — ареометром. Процедуру необходимо проводить с полностью заряженным аккумулятором. Особенно это важно делать перед зимой, чтобы выявить проблему заранее и уменьшить риск порчи АКБ, вследствие замерзания воды в ней. Если были выявлены низкие значение, то, скорее всего, проблема кроется в одной из следующих причин:
- дефект ячейки;
- обрыв внутренней цепи батарей;
- глубокий разряд АКБ или одной из его секций.
Все дело в плотности: чем она меньше (воды в растворе больше), тем быстрее замерзнет электролит при понижении температуры. Умеренный климат требует, чтобы этот параметр был в пределах 1,25-1,27 г/см3. Зимой и в северных регионах рекомендуемая плотность увеличивается на 0,01 г/см3.
Умеренный климат требует, чтобы этот параметр был в пределах 1,25-1,27 г/см3. Зимой и в северных регионах рекомендуемая плотность увеличивается на 0,01 г/см3.
Многих автолюбителей интересует: «При какой температуре замерзает электролит в аккумуляторе?». Получить ответ на этот вопрос поможет следующая таблица:
| Плотность электролита при 25°C, г/см³ | Температура замерзания, °С | Плотность электролита при 25°C, г/см³ | Температура замерзания, °С |
| 1,09 | -7 | 1,22 | -40 |
| 1,1 | -8 | 1,23 | -42 |
| 1,11 | -9 | 1,24 | -50 |
| 1,12 | -10 | 1,25 | -54 |
| 1,13 | -12 | 1,26 | -58 |
| 1,14 | -14 | 1,27 | -68 |
| 1,15 | -16 | 1,28 | -74 |
| 1,16 | -18 | 1,29 | -68 |
| 1,17 | -20 | 1,3 | -66 |
| 1,18 | -22 | 1,31 | -64 |
| 1,19 | -25 | 1,32 | -57 |
| 1,2 | -28 | 1,33 | -54 |
| 1,21 | -34 | 1,4 | -37 |
Таблица 1. Плотность электролита в аккумуляторе автомобиля зимой.
Как повысить плотность если она низкая?
Поднимать эту характеристику приходится после неоднократного корректирования уровня жидкости в АКБ дистиллированной водой или в случае нехватки параметра для эксплуатации батареи в зимой. Явным признаком недостаточной концентрации серной кислоты является оледенение ячеек. Что делать если замерз электролит в аккумуляторе? Потребуется отогреть АКБ при комнатной температуре, после чего поставить на зарядку.
Внимание! Замерять плотность нужно только в полностью заряженной аккумуляторной батарее.
Помимо правильно проведенной полной зарядки существует еще такие способы поднятия плотности, как добавление концентрированного (корректирующего) электролита или кислоты.
Для корректировки понадобится:
- ареометр;
- мерная емкость;
- посуда для приготовления смеси;
- спринцовка;
- серная кислота или корректирующий электролит;
- дистиллированная вода.
Процедура проводится следующим образом:
- Из ячеек батареи отбирается немного кислотного раствора и измеряются показатели кислотности.
- Если надо увеличить плотность — доливается столько же корректирующего электролита, если уменьшить —добавляется дистиллированная вода.
- После проведения процедуры со всеми ячейками АКБ ставится на зарядку стационарным устройством для смешивания жидкости.
- По окончании зарядки надо подождать не меньше часа, чтобы плотность во всех секциях батареи выровнялась.
- Проводится проверка показателей и в случае необходимости процедура повторяется с уменьшением шага разбавления вдвое.
Плотность между ячейками не должна отличаться сильнее, чем на 0,01 г/см3. Если добиться этого не вышло — необходимо провести выравнивающую зарядку малым током.
Что делать, когда плотность ниже 1,18 г/см
3Чтобы зимой не замерзла вода в аккумуляторе нужно не допускать снижения плотности электролита. Если это значение преодолело критический минимум в 1,18 г/см3, то требуется добавление кислоты. Сама процедура проводится в том же порядке, что был описан ранее, только количество отбираемой и добавляемой жидкости необходимо сократить, чтобы не превысить значение первым доливом.
Важно! При изготовлении электролита нужно вливать кислоту в воду, и ни в коем случае не наоборот.
Что делать если электролит в аккумуляторе замерз, а после отогрева приобрел багровый цвет? К сожалению, такая батарея уже не сможет нормально работать зимой при температуре ниже 5°C. Скорее всего у такого АКБ осыпалась активная масса, что уменьшило рабочую поверхность пластин. Восстановить нормальные показатели у такого АКБ невозможно.
Поддержание количества электролита и его плотности на должном уровне существенно продлевает срок службы батареи, а также ее способность сопротивляться морозу и безпроблемно запускать двигатель автомобиля.
1. НАЗНАЧЕНИЕ БАТАРЕИ 1.1. Батарея аккумуляторная свинцово-кислотная стартерная (далее АКБ) предназначена для пуска двигателей и питания электрооборудования автотракторной техники. 1.2. Залитые и заряженные АКБ готовы к эксплуатации. Плотность электролита в АКБ для умеренноконтинентального климата должна составлять 1.27г/см3 при 20-250C, что соответствует ГОСТу 53165-2008. МЕРЫ БЕЗОПАСНОСТИ ЗАПРЕЩАЕТСЯ стучать по полюсным выводами наконечникам кабелей при присоединении и отсоединении АКБ, т. к. это может привести к обрыву электрической цепи АКБ 2.4. Клеммы подводящих проводов должны быть плотно зажаты на полюсных выводах АКБ, а сами провода про¬слаб-лены. 3. ПОДГОТОВКА АКБ К ЭКСПЛУАТАЦИИ Внимание! Доливать электролит не допускается. Примечание: при эксплуатации новой АКБ РЕКОМЕНДУЕТСЯ первую проверку уровня электролита сделать после 100км пробега с начала эксплуатации АКБ т.к. не исключено что после заряда АКБ на заводе в конвертных сепараторах остались пузырьки газа. Под воздействием вибрации при движении газ выходит из сепараторов и улетучивается через вентиляционные отверстия. Вследствие чего уровень электролита может снизиться. Если при проверке окажется что уровень электролита ниже нормы, а плотность соответствует норме, в этом случае необходимо долить дистиллированную воду и произвести заряд АКБ согласно п. 4.8.
Вскрытие таких АКБ не допускается! | 3.2. Сухозаряженная АКБ подготавливается к эксплуатации следующим образом: необходимо выкрутить пробки залив-ных горловин проделать в них вентиляционные отверстия, залить АКБ кислотным аккумуляторным электролитом с плотностью 1.27г/см3. После выдержать батарею в течении 2 часов при комнатной температуре, и обязательно полностью дозарядить согласно п 4.8.4. ЭКСПЛУАТАЦИЯ И ТЕХНИЧЕСКОЕ ОБСЛУЖИВАНИЕ 4.3. Клеммы АКБ и подводящих проводов должны быть за-чищены и смазаны антикоррозионной смазкой, присутствие окислов не допускается. 4.4. Пуск двигателя производится при отключенной пере-даче или при выжатом сцеплении продолжительностью не более 10сек. с перерывами между попытками не менее минуты. Если после 5 попыток пуска двигатель не заработал, то АКБ следует зарядить, согласно п.4.8. а систему пуска двигателя проверить. Многократные длительные по¬пытки безуспешного пуска двигателя приводят к недо¬пустимо глубокому разряду АКБ. 4.5. НЕДОПУСКАЕТСЯ НЕДОЗАРЯД ИЛИ ПЕРЕЗАРЯД АКБ. Напряжение подзарядки от генератора, при всех включенных потребителях и частотой вращения коленчатого вала двигателя 1500-2000 об/мин. должно быть в пределах 13.8-14.3В. Максимально допустимая утечка тока 20 мА с учётом работы постоянных потребителей: часы, бортовой компьютер, сигнализация и прочих. 4.6. ВНИМАНИЕ! при эксплуатации АКБ уровень электролита должен находиться в диапазоне между минимальной и мак¬симальной отметкой как указано в пункте 3.1 4.7. АКБ следует поддерживать в заряженном состоянии не реже одного раза в месяц проверять плотность электролита, при снижении плотности на 0,03г/см3 и более от значений указанных в п. 1.2., АКБ следует зарядить, как указано в п. 4.8. ВНИМАНИЕ! Следует помнить, что снижение плотности в процессе эксплуатации или бездействия АКБ ниже 1.25г/см3 приводит к необратимой сульфатации пластин, а при низкой температуре к замерзанию электролита и разрушению АКБ. При эксплуатации АКБ на транспортном средстве с напряжением более 14.4В и высокой температуре подкапотного пространства, особенно в тёплое время года, происходит пере¬заряд АКБ: *Повышенный расход воды из за постоянного интенсивно протекающего процесса электролиза воды. *Разрыхление и осыпание активной массы по причине постоянного, интенсивного газовыделения. *Коррозия токоотводящих решёток, под воздействием активно выделяющегося кислорода и вследствие повышения плотности электролита выше допустимых значений. *При напряжении ниже 13.8В частых пусках двигателя и непродолжительных поездках (городской цикл), особенно в зимнее время, происходит систематический недозаряд АКБ, постепенное снижение степени заряженности АКБ, уменьшение плотности электролита ниже допустимых пределов, необратимой сульфатации пластин и выходу АКБ из строя. 4.8. ЗАРЯД АКБ 4.8.1. Заряд АКБ следует производить в хорошо проветриваемом помещении током в амперах численно равным 10% от ёмкости АКБ, т.е. 6А для АКБ емкостью 60 Ah. При достижении напряжения 14.4В зарядный ток следует уменьшить вдвое и проводить заряд до достижения постоянства плотности электролита и напряжения на клеммах АКБ. Время заряда АКБ зависит от степени её разряженности. 4.8.2. При проведении заряда не допускается нагрев электролита выше 45оС, в этом случае заряд следует прервать до снижения температуры электролита до 35oC. 4.8.3. После достижения полного заряда АКБ следует проверить уровень и плотность электролита и при необходимости откорректировать их в соответствии с п. 1.2., 3.1. | 4.8.3. После достижения полного заряда АКБ следует проверить уровень и плотность электролита и при необходимости откорректировать их в соответствии с п. 1.2., 3.1. 4.8.4. При зарядке необслуживаемых АКБ, без заливных горловин, АКБ считается полностью заряженной когда напряжение на клеммах остаётся постоянным в течении 2 и более часов. 4.8.5. При использовании автоматических зарядных устройств необходимо ориентироваться по индикации на устройстве согласно инструкции по его использованию. Примечание: необходимо помнить, что большинство со-временных зарядных устройств изготовленных по единым евро стандартам (менеджмент качества ISO9001), предназначены для зарядки АКБ, которые использовались без нарушений условий эксплуатации. В случаях если АКБ дли-тельное время эксплуатировалась в режиме недозаряда, или был допущен глубокий разряд, и т.д. то подобные зарядные устройства в некоторых случаях не способны полностью зарядить АКБ, т.е. полностью восстановить его ёмкость, т.к. предназначены только для зарядки, а не для восстановления повреждённых АКБ. В таких случаях следует обратиться за консультацией в авторизованный сервисный центр или в торговую точку, где был приобретён АКБ. 5. ГАРАНТИЙНЫЕ ОБЯЗАТЕЛЬСТВА 5.1. Батареи с производственными дефектами (обрыв цепи, короткое замыкание, отрыв отдельных пластин вследствие некачественной пайки деталей) подлежат замене. 5.2. При продаже батареи и последующем гарантийном обслуживании продавец обязан, в присутствии покупателя, бесплатно проверить: напряжение разомкнутой цепи АКБ, проверить работоспособность АКБ под нагрузкой, проверить плотность электролита, электрооборудование автомобиля. В отдельных случаях покупатель может быть направлен в сервисный центр для проверки АКБ и автомобиля. Примечание: при выявлении неисправностей автомобиля покупателю предоставляется семь календарных дней для устранения неисправности и предъявления автомобиля с исправным электрооборудованием. 5.3. Гарантийный срок эксплуатации составляет 12 месяцев, при условии пробега автомобиля не более 60 000 км. Примечание: при работе автомобиля в режиме такси (маршрутное такси), а так же для автомобилей на которых, по конструкции завода изготовителя, предусмотрена установка двух АКБ, а заменён был только один, срок гарантии составляет 6 месяцев или 60000 км. пробега в зависимости от того что наступит раньше. 5.4. Данный договор вступает в силу с момента его подписания обеими сторонами и только при условии соблюдения всех условий данного договора. 5.5. Данный договор прекращает своё действие в случаях: 5.5.1. Отсутствуют кассовый чек и гарантийный договор. 5.5.2. Нарушения условий эксплуатации указанных в настоящем руководстве. 5.5.3. АКБ механически повреждена, подвергалась вскрытию или ремонту. 5.5.4. Предъявления АКБ без автомобиля, на котором она эксплуатировалась. 5.5.5. Неисправность электрооборудования автомобиля п.4.5 5.5.6. АКБ эксплуатировалась не закреплённой на транс-портном средстве. 5.5.7. Уровень электролита не соответствует п. 3.1. 5.5.8. Плотность электролита, в заряженной АКБ, в двух или более аккумуляторах выше 1.30г/см3. 5.5.9. Батарея разряжена, то есть плотность электролита менее 1.22г/см3, в трёх и более аккумуляторах АКБ. 5.5.10. Наличие на вентиляционных пробках тёмнокоричневого налёта, а в электролите осадка тёмного цвета, свидетельствующего о систематическом перезаряде АКБ. 5.5.11. Покупателем неправильно выбрана АКБ для данного типа транспортного средства. 5.5.12. Использование нештатных (дополнительных) потребителей электроэнергии, что влечёт за собой постоянную разряжённость АКБ. 5.5.13. Оплавление или окисление полюсных выводов. 5.5.14. Присутствие льда в двух или более аккумуляторах АКБ. 5.5.15. Использования АКБ не по назначению | 1. НАЗНАЧЕНИЕ БАТАРЕИ 1.1. Батарея аккумуляторная свинцово-кислотная стартерная (далее АКБ) предназначена для пуска двигателей и питания электрооборудования автотракторной техники. 1.2. Залитые и заряженные АКБ готовы к эксплуатации. Плотность электролита в АКБ для умеренноконтинентального климата должна составлять 1.27г/см3 при 20-250C, что соответствует ГОСТу 53165-2008. ВНИМАНИЕ! Использование электролита с плотностью выше 1.30г/см3 приводит к ускоренной коррозии токоотводящих решеток, отслоению и разрушению активной массы пластин и выходу АКБ из строя. 2. МЕРЫ БЕЗОПАСНОСТИ 2.1. ВНИМАНИЕ! Смесь водорода с кислородом взрывоопасна. КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ вблизи АКБ курить, пользоваться открытым огнём, допускать искрообразования в т.ч. путем замыкания полюсных выводов АКБ 2.2. ЭЛЕКТРОЛИТ — АГРЕСИВНАЯ ЖИДКОСТЬ. При попадании его на незащищенные участки тела немедленно про-мойте их водой и 10% раствором питьевой соды. При необходимости обратитесь за медицинской помощью. 2.3. Присоединение и отсоединение батареи должно про-изводиться при заглушенном двигателе и отключенных потребителях тока (выключенном зарядном устройстве). При этом вначале присоединяется положительный полюс, а затем отрицательный. Отсоединение АКБ производится в обратной последовательности. ЗАПРЕЩАЕТСЯ стучать по полюсным выводами наконечникам кабелей при присоединении и отсоединении АКБ, т. к. это может привести к обрыву электрической цепи АКБ 2.4. Клеммы подводящих проводов должны быть плотно зажаты на полюсных выводах АКБ, а сами провода прослаблены. 3. ПОДГОТОВКА АКБ К ЭКСПЛУАТАЦИИ 3.1. Перед установкой АКБ на транспортное средство или на хранение следует измерить уровень и плотность электро-лита в АКБ. Если плотность электролита меньше чем указано в пункте 1.2. на 0.03 г/см3 и более или значение плотности в аккумуляторах АКБ различаются больше чем на 0.01г/см3, АКБ следует зарядить согласно п. 4.8. Уровень электролита должен быть на 20-25 мм выше верхней кромки пластин или на 5 мм выше полюсного мостика, если уровень электролита ниже его следует откорректировать доливкой дистиллированной воды, с последующей зарядкой АКБ согласно п. 4.8. Внимание! Доливать электролит не допускается. Примечание: при эксплуатации новой АКБ РЕКОМЕНДУЕТСЯ первую проверку уровня электролита сделать после 100км пробега с начала эксплуатации АКБ т.к. не исключено что после заряда АКБ на заводе в конвертных сепараторах остались пузырьки газа. Под воздействием вибрации при движении газ выходит из сепараторов и улетучивается через вентиляционные отверстия. Вследствие чего уровень электролита может снизиться. Если при проверке окажется что уровень электролита ниже нормы, а плотность соответствует норме, в этом случае необходимо долить дистиллированную воду и произвести заряд АКБ согласно п. 4.8. Для определения степени заряженности необслуживаемых АКБ, не имеющих заливных горловин, т. е. отсутствует возможность измерить плотность, необходимо ориентироваться по напряжению разомкнутой цепи (далее НРЦ). Необходимо помнить, что для получения правильных результатов, АКБ необходимо отключить от электрической сети транспортного средства (зарядного устройства) и выдержать в состоянии покоя не менее 8 часов и только после этого производить измерения НРЦ с помощью высокоомного цифрового или аналогово вольтметра. При НРЦ меньшем 12.6В АКБ необходимо зарядить согласно п 4.8. Для определения степени заряженности необслуживаемых АКБ, имеющих индикатор заряженности, оценивать состояние АКБ следует согласно его показаниям, либо, для получения более точных сведений о состоянии АКБ, путем измерения НРЦ как указано выше. Для необслуживаемых АКБ (без заливных горловин) контроль уровня электролита не требуется т.к. они обладают крайне малым расходом воды и при нормальных условиях эксплуатации количества электролита залитого на заводе вполне достаточно на весь срок использования АКБ. Вскрытие таких АКБ не допускается! | 3.2. Сухозаряженная АКБ подготавливается к эксплуатации следующим образом: необходимо выкрутить пробки заливных горловин проделать в них вентиляционные отверстия, залить АКБ кислотным аккумуляторным электролитом с плотностью 1.27г/см3. После выдержать батарею в течении 2 часов при комнатной температуре, и обязательно полностью дозарядить согласно п 4.8. 4.ЭКСПЛУАТАЦИЯ И ТЕХНИЧЕСКОЕ ОБСЛУЖИВАНИЕ 4.1. АКБ должна быть укомплектована и хорошо закреплена на транспортном средстве. Ненадежное крепление АКБ при-водит к её механическому повреждению, преждевременному разрушению электродов и коротким замыканиям, вследствие чрезмерной вибрации при движении транспортного средства. 4.5. НЕДОПУСКАЕТСЯ НЕДОЗАРЯД ИЛИ ПЕРЕЗАРЯД АКБ. Напряжение подзарядки от генератора, при всех включенных потребителях и частотой вращения коленчатого вала двигателя 2000-2500 об/мин. должно быть в пределах 13.8-14.3 В. Максимально допустимая утечка тока 20 мА с учётом работы постоянных потребителей: часы, бортовой компьютер, сигнализация и прочих. 4.6. ВНИМАНИЕ при эксплуатации АКБ уровень электролита должен находиться в диапазоне между минимальной и максимальной отметкой как указано в пункте 3.1 ВНИМАНИЕ! Следует помнить, что снижение плотности в процессе эксплуатации или бездействия АКБ ниже 1.25г/см3 приводит к необратимой сульфатации пластин, а при низкой температуре к замерзанию электролита и разрушению АКБ. При эксплуатации АКБ на транспортном средстве с напряжением более 14.4В и высокой температуре подкапотного пространства, особенно в тёплое время года, происходит пере¬заряд АКБ: *Повышенный расход воды из за постоянного интенсивно протекающего процесса электролиза воды. 4.8. ЗАРЯД АКБ 4.8.1. Заряд АКБ следует производить в хорошо проветриваемом помещении током в амперах численно равным 10% от ёмкости АКБ, т.е. 6А для АКБ емкостью 60 Ah. При достижении напряжения 14.4В зарядный ток следует уменьшить вдвое и проводить заряд до достижения постоянства плотности электролита и напряжения на клеммах АКБ. Время заряда АКБ зависит от степени её разряженности. 4.8.2. При проведении заряда не допускается нагрев электролита выше 45оС, в этом случае заряд следует прервать до снижения температуры электролита до 35oC. | 4.8.4. При зарядке необслуживаемых АКБ, без заливных горловин, АКБ считается полностью заряженной когда напряжение на клеммах остаётся постоянным в течении 2 и более часов. 5. ГАРАНТИЙНЫЕ ОБЯЗАТЕЛЬСТВА 5.1. Батареи с производственными дефектами (обрыв цепи, короткое замыкание, отрыв отдельных пластин вследствие некачественной пайки деталей) подлежат замене. Примечание: при работе автомобиля в режиме такси (маршрутное такси), а так же для автомобилей на которых, по конструкции завода изготовителя, предусмотрена установка двух АКБ, а заменён был только один, срок гарантии составляет 6 месяцев или 60000 км. пробега в зависимости от того что наступит раньше. 5.4. Данный договор вступает в силу с момента его подписания обеими сторонами и только при условии соблюдения всех условий данного договора. 5.5.5. Неисправность электрооборудования автомобиля п.4.5 5.5.6. АКБ эксплуатировалась не закреплённой на транс-портном средстве. |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Влияние температуры электролита и плотности тока на микротвердость слоя, создаваемую анодным окислением алюминия
В статье исследуется влияние химического состава и температуры электролита, времени окисления, напряжения и плотности тока на микротвердость по Виккерсу. слои оксида алюминия одновременно. Слои создавались в электролитах с разной концентрацией серной и щавелевой кислот и плотностями поверхностного тока 1 А · дм -2 , 3 А · дм -2 и 5 А · дм -2 .Температура электролита изменялась от -1,78 ° С до 45,78 ° С. Результаты показали, что при повышении температуры электролита при плотности тока 1 А · дм -2 увеличение значений микротвердости слоев составляет примерно 66%. При одновременном увеличении молярной концентрации H 2 SO 4 в электролите скорость роста значения микротвердости снижается. При плотности тока 3 А · дм -2 за счет повышения температуры электролита происходит снижение микротвердости сформированного слоя при времени анодного окисления менее 25 мин.Температура электролита не имеет значения при изменении значений микротвердости слоя при напряжениях менее 10,5 В.
1. Введение
Свойства поверхностных слоев, образованных анодным оксидом алюминия (AAO), такие как высокая поверхностная твердость слой, коррозионная стойкость [1, 2] и износостойкость предопределяют обработанные таким образом изделия из алюминия для широкого применения не только в традиционных областях машиностроения, транспорта и строительства, но и для потенциального использования в магнитных носителях записи [3 ], фотоэлектрические солнечные элементы [4], фильтры [5], химические сенсоры [6], фотоника [7] и металлические нанопроволоки [8, 9].
Большинство экспериментальных работ в области (микротвердости) проводится в «сложных» условиях анодирования. Сюда можно отнести низкие температуры электролита, а часто и особый химический состав электролитов. Их основная цель — достижение высоких значений микротвердости слоев. Согласно Скотту [10], который для анодного окисления в серной кислоте при постоянной плотности тока 4 А · дм -2 , менял температуру от -5 ° C до 15 ° C, микротвердость в этих условиях влияет в незначительной степени, что также связано с износостойкостью.Другое исследование, опубликованное Коидзуми и соавт. В [11] рассматривается анодное окисление алюминия в гальваностатическом режиме. Использовались плотности тока от 1 до 8 А · дм -2 ; электролит состоял из серной кислоты и щавелевой кислоты. Температура электролита составляла от –5 ° С до 20 ° С. Коидзуми и др. [11] утверждают, что микротвердость и износостойкость практически постоянны в интервале температур от –5 ° C до 5 ° C независимо от приложенной плотности тока. Кроме того, в этом исследовании утверждается, что повышение температуры электролита приводит к постепенному снижению значения микротвердости.Более значительное снижение микротвердости происходит при использовании меньших значений плотности тока. К этому утверждению, однако, следует относиться с осторожностью, поскольку время анодного окисления в этом эксперименте всегда было постоянным, то есть 45 минут, независимо от используемых плотностей тока. В результате были созданы и впоследствии оценены слои большей толщины. Толщина формируемого слоя напрямую влияет на результирующие значения микротвердости и износостойкости [12–14].
Слои АОА толщиной 25 мкм мкм и более, образованные в электролите, состоящем из серной кислоты, при температурах от 15 ° С до 30 ° С и при различных значениях приложенных плотностей тока (от 1 до 4 A · дм −2 ), по мнению некоторых авторов [15], имеют более мягкий внешний слой, что снижает прозрачность слоя, а также его микротвердость и износостойкость. На основании публикации [16] было замечено, что на размер пор влияют напряжение, температура электролита и время анодного окисления.Вертикальный рост пор (10–250 нм · мин –1 ) экспоненциально зависит от напряжения и линейно зависит от изменения температуры электролита. С другой стороны, диаметр пор (50-130 нм) линейно изменяется вместе с приложенным напряжением. Размер и количество пор сильно влияют на микротвердость слоя. В работе [17], посвященной реанодированию с целью экспериментального получения кинетики на основе рассчитанных зависимостей, делается вывод, что имеющиеся значения констант, зависящие от напряженности электрического поля и температуры, неприменимы к анодному окисление при высоких плотностях тока.В качестве возможного объяснения дается повышение температуры внутри сформированного слоя.
Целью авторов является экспериментальный анализ зависимости микротвердости слоя от изменения температуры электролита и плотности тока. Процессы обработки поверхности представляют собой сложные многофакторные системы со значительным эффектом взаимодействия. Эти взаимодействия обычно оказываются более значительными, чем влияние отдельных факторов. Таким образом, микротвердость анализируется также с учетом влияния других рабочих факторов.Таким образом, можно делать более точные выводы и рекомендации.
2. Опытный образец
В качестве экспериментального анодного материала использовался алюминиевый лист EN AW-1050 A-h34 толщиной 0,5 мм. Химический состав экспериментального материала представлен в таблице 1.
| |||||||||||||||||||||||||||||||||||
Образцы размером 100 × 70 × 0,5 мм подвергали химическому обезжириванию в растворе, содержащем бикарбонат натрия <20%, пентагидрат метасиликата натрия <5%, фосфаты <30%, бораты <40% и поверхностно-активные вещества <5% при температуре ° C в течение 15 минут. Затем образцы тщательно промывали в деионизованной воде и погружали в 45% раствор гидроксида натрия при температуре ° C на 1 мин.Анодирование было выполнено на основе методологии Плана экспериментов, соответствующей вращающейся центральной композитной конструкции с 44 испытательными запусками. Отдельные прогоны проводились в соответствии с планом эксперимента как комбинация уровней факторов, соответствующих таблице 2.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
После анодирования образцы сразу промывали в охлажденной (примерно 10 ° C) демиводе в течение 1 минуты с последующей промывкой проточной водопроводной водой еще 2 минуты, чтобы вымыть электролит, застрявший в дефектах. После этого образцы сушили сжатым воздухом и сушили в печи (при температуре 50 ° C в течение 20 минут).
В области обработки поверхности ячейка Халла в основном используется для проверки функциональности электролита и химического состава электролита. Ячейка Халла в форме прямоугольной трапеции с размерами, соответствующими рисунку 1, использовалась для обоих проведенных экспериментов. На рисунке 1 также показано подключение экспериментальной установки, которая включает в себя регулируемый источник постоянного тока (постоянный контроль напряжения от 0 до 20 В), амперметр для контроля измерения постоянного тока, протекающего через электрическую цепь (регулировка тока от 0 до 5 А) и вольтметр для измерения полного напряжения.
3. Результаты и обсуждение
Первоначальный эксперимент проводился для определения основных физических эффектов, таких как напряжение, температура электролита и общий ток. Графическое представление временной зависимости приведено на рисунке 2.
График (рисунок 2 (a)) показывает, что изменение полного тока во времени сильно зависит от температуры электролита. Кинетику роста анодного слоя можно увидеть на рисунке 2 (б), который представляет временную зависимость протекающего тока.Первые 30 секунд — важный временной интервал, когда образуется непористый барьерный слой. Первый этап характеризуется резким увеличением значения полного тока за очень короткое время и его последующим снижением. Здесь происходит рост анодного потенциала. На этом этапе образуются зародыши оксидных клеток и поверхностный барьерный оксидный слой. Первые ячейки образуются в местах узлов границ между кристаллами поверхности алюминия [18]. Вдоль этих границ образуются другие оксидные ячейки.Образование оксидных ячеек в этих местах связано с более высоким химическим потенциалом этих областей и высокой концентрацией кристаллографических дефектов. В конце этого этапа происходит повторный рост общего тока и уменьшение анодного потенциала. В этой фазе количество оксидных ячеек уменьшается. При этом происходит увеличение их размеров по механизму «конкуренции» (увеличение размеров ячеек за счет других, бесперспективно). В то же время происходит утолщение распределения клеток и, следовательно, уменьшение неклеточных площадей барьерного оксидного слоя.На этом этапе больше нет резкого падения потенциала анода. Размеры оксидных ячеек увеличиваются, но скорость этого процесса существенно снижается. На третьем этапе, который характеризуется постоянным значением тока, а также значением потенциала анода, анодно окисленный слой увеличивается с учетом его толщины, и слой имеет пористую структуру (рис. 3).
Анализ значений микротвердости слоев, создаваемых анодным окислением алюминия, в зависимости от температуры представлен на рисунках 4–12.В рамках экспериментального анализа оценивается влияние других эксплуатационных факторов на изменение значения микротвердости. На рисунке 4 при плотности тока 1 А · дм -2 можно наблюдать сильно нелинейную зависимость микротвердости слоя от температуры электролита.
В диапазоне температур электролита от -1,5 до 8.5 ° С происходит снижение микротвердости слоя. Это снижение можно объяснить низким напряжением, а также низким значением молярной концентрации H 2 SO 4 . Повышение температуры электролита более 8,5 ° С приводит к резкому увеличению значения микротвердости слоя. В интервале температуры электролита от 11,5 ° С до 45,5 ° С произойдет увеличение микротвердости слоя на 78%. При плотностях тока 3 А · дм -2 и 5 А · дм -2 температура электролита не оказывает существенного влияния на значение микротвердости слоя.При 3 А · дм -2 повышение температуры электролита вызывает даже снижение микротвердости слоя на 7%. При плотности тока 5 А · дм -2 наблюдается небольшое увеличение микротвердости слоя около 4%.
Зависимость микротвердости от температуры электролита при увеличении молярной концентрации серной кислоты до 1,43 моль · л −1 представлена на рисунке 5. Здесь также можно наблюдать область минимальных значений микротвердости слоя при текущем токе. плотность 1 А · дм −2 .Абсолютное значение микротвердости слоя в области минимума (1,5-8,5 ° С) в среднем составляет около 30%. Увеличение молярной концентрации H 2 SO 4 от 0,09 моль · л −1 до 1,43 моль · л −1 в областях низких температур приводит к увеличению микротвердости слоя почти на 54% при плотность тока 1 А · дм −2 . При плотности тока 3 А · дм -2 наблюдается уменьшение микротвердости слоя с повышением температуры электролита.Это снижение значения микротвердости составляет 23%. Снижение микротвердости по сравнению с электролитом с c (H 2 SO 4 ) = 0,09 моль · л −1 составляет почти 16%. Развитие микротвердости слоя при плотности тока 5 А · дм -2 можно считать постоянным. Температура электролита не оказывает существенного влияния на микротвердость слоя при плотности тока 5 А · дм -2 .
Дальнейшее увеличение молярной концентрации серной кислоты до 2.76 моль · л −1 (рис. 6) при плотности тока 1 А · дм −2 приводит к расширению областей минимальных значений и увеличению среднего значения микротвердости. Область минимума увеличена с 1,5 до 11,5 ° C. Среднее значение микротвердости по сравнению с электролитом с c (H 2 SO 4 ) = 1,43 моль · л −1 увеличивается на 36%. При плотности тока 3 А · дм -2 наблюдается значительное снижение микротвердости слоя в зависимости от температуры электролита.Это снижение составляет 35%. Увеличение абсолютного среднего значения микротвердости слоя по сравнению с электролитом с c (H 2 SO 4 ) = 1,43 моль · л −1 , при плотности тока 3 А · дм — 2 , составляет в среднем 12%. При температуре электролита -1,5 ° С разница значений микротвердости составляет 20%. С повышением температуры электролита разница уменьшается до значения 12% при температуре 45,5 ° C. При плотности тока 5 А · дм -2 наблюдается лишь незначительное увеличение микротвердости слоя в зависимости от температуры электролита.Величина прибавки составляет 2,5%.
На основании анализа температура электролита является значимым фактором при плотности тока 1 А · дм −2 . Это также важнейший фактор, влияющий на микротвердость слоя. Доля температуры в общей изменчивости значений микротвердости составляет 14%. Сильная зависимость микротвердости слоя от температуры электролита также отражается на взаимодействии с молярной концентрацией серной кислоты в электролите.При одновременном повышении температуры электролита и молярной концентрации серной кислоты среднее значение микротвердости увеличивается. Это связано с природой анодного окисления. При проявлении пористых оксидных слоев в одной системе существуют две параллельные реакции: одна для электрохимического анодного образования оксида металла (), а другая — для химического растворения того же оксида в том же электролите [19]. : Уравнение (1) представляет электрохимическую анодную реакцию.Изменение его свободной энергии регулируется уравнением Нернста и является функцией потенциала электрода, который определяет способность металла преобразовываться в электролите в ионную форму: где — число перенесенных электронов, — постоянная Фаррадея, и — потенциал электрода, на который влияет приложенное напряжение. Уравнение (2) выражает химическую реакцию с изменением свободной энергии на постоянное значение независимо от приложенного напряжения. Из-за повышения температуры электролита происходит преобладание химического растворения.Увеличение плотности тока обычно приводит к увеличению толщины слоя и, как следствие, к увеличению тепла на границе оксид-электролит [14].
Эти эффекты могут создавать большие градиенты температуры электролита и состава вдоль более глубоких стенок пор с возможным благоприятным влиянием на растворение оксидов и адсорбцию сульфат-анионов на стенках пор [20]. Кроме того, более высокая движущая сила ускоряет реакции на границе раздела подложка-оксид и, как следствие, появление дефектов.Ожидается, что эти локальные эффекты уменьшат микротвердость анодных оксидных слоев [14].
Для плотностей тока 3 А · дм -2 и 5 А · дм -2 температура электролита имеет значение только во взаимодействии с молярной концентрацией серной кислоты, напряжением и временем анодирования. Можно предположить, что уменьшение микротвердости слоя вызвано, помимо повышения температуры, еще и продолжительным периодом анодирования. При длительных периодах анодного окисления создаются условия для растворения образовавшегося слоя.Это растворение травит слой и значительно ухудшает механические и эксплуатационные свойства созданного слоя.
Зависимость микротвердости слоя от изменения температуры электролита при времени анодирования 1,22 мин представлена на рисунке 7. При плотности тока 1 А · дм −2 наблюдаются две области изменения микротвердости. развития наблюдаются. В интервале от -1,5 ° С до 11,5 ° С происходит снижение микротвердости. Этот эффект можно объяснить сочетанием низкой температуры электролита, низкого напряжения и короткого времени анодирования.Из-за повышения температуры электролита выше 11,5 ° С происходит резкое увеличение микротвердости слоя. Повышение температуры на 1 ° C соответствует увеличению микротвердости на 2,2%. При плотности тока 3 А · дм −2 наблюдается рост значений микротвердости слоя с ростом температуры электролита. Среднее увеличение значения микротвердости в диапазоне температур электролита от -1,5 ° С до 45,5 ° С составляет 62%. Увеличение плотности тока до 5 А · дм -2 не оказывает существенного влияния на изменение значения микротвердости слоя в зависимости от температуры электролита.
Влияние температуры электролита на микротвердость слоя при времени анодирования 25 мин показано на рисунке 8. При плотности тока 1 А · дм −2 наблюдается увеличение значения микротвердости во всем диапазон температуры электролита. Изменение температуры с -1,5 ° C до 45,5 ° C повысит микротвердость почти на 65%. При плотности тока 3 А · дм −2 наблюдается значительное снижение значения микротвердости при повышении температуры электролита.Можно предположить, что увеличение времени анодирования до 25 мин за счет повышения температуры электролита создает условия для растворения образовавшегося слоя. Снижение микротвердости слоя на 1,5% по результатам эксперимента соответствует повышению температуры электролита на 1 ° С. Дальнейшее увеличение плотности тока до 5 А · дм -2 не приводит к изменению значения микротвердости слоя из-за изменения температуры электролита.Микротвердость во всем диапазоне температур электролита (от -1,5 ° С до 45,5 ° С) изменится всего на 2,8%.
При времени анодирования 48,78 мин зависимость микротвердости слоя от изменения температуры электролита можно увидеть на рис. 9.
При плотности тока 1 А · дм −2 зависимость микротвердость слоя от температуры электролита можно разделить на две области: область увеличения микротвердости слоя и область уменьшения значения микротвердости.Эти области можно разделить по значению критической температуры. Экспериментально выявленная зависимость изменения микротвердости от температуры электролита при плотности тока 1 А · дм −2 , для конкретных условий анодного окисления ( c (H 2 SO 4 ) = 1,43 моль · л −1 , c (C 2 H 2 O 4 ) = 0,06 моль · л −1 , U = 10 В, т = 48,78 мин) , можно выразить в виде: Локальные экстремумы функции вычисляются, если первая производная (4) равна нулю: Решая (5), мы получим стационарные точки, а именно, и.Поскольку диапазон температур (Таблица 2) составляет от -1,78 ° C до 48,78 ° C, это значение будет считаться допустимым решением. Подставляя значение из интервала в (5), первая производная больше нуля; то есть функция (4) на интервале возрастает. Подставляя значение из интервала в (5), первая производная меньше нуля; то есть функция (4) на интервале убывает. Таким образом, значение является локальным максимумом функции (4), и при этой температуре микротвердость слоя достигает максимального значения; то есть, .В области ниже критической температуры скорость роста микротвердости слоя в зависимости от температуры составляет в среднем 55%. В области выше критической температуры скорость снижения микротвердости слоя составляет 12,8%. При плотности тока 3 А · дм -2 из-за повышения температуры электролита происходит снижение микротвердости слоя. Средняя скорость уменьшения значения микротвердости слоя в диапазоне экспериментальных температур электролита составляет 691%.При плотности тока 5 А · дм -2 наблюдается лишь минимальное влияние температуры электролита на значение микротвердости слоя. Скорость роста микротвердости слоя 1,8%.
Еще одним важным фактором, влияющим на формирование анодного слоя, является напряжение. Напряжение существенно влияет на механические свойства слоя, а также на микротвердость слоев. На рисунках 10–12 представлена зависимость микротвердости слоя от температуры электролита при изменении напряжения для плотностей тока 1 А · дм −2 , 3 А · дм −2 и 5 А · дм . −2 .Зависимость микротвердости слоя от температуры электролита при напряжении 8,5 В представлена на рисунке 10.
При плотности тока 1 А · дм −2 наблюдается незначительное уменьшение значения микротвердости слоя в диапазоне — Наблюдается от 1,78 ° C до 11,5 ° C. Это снижение микротвердости слоя составляет около 2,3%. В этих условиях анодирования проводимость электролита слишком низкая. Приложенное напряжение относится к ситуации, когда всегда ниже, чем. В этом случае оксид образуется на основе (1), но он нестабилен и сразу растворяется из-за реакции (2).Этот случай называется электрохимическим травлением. Повышение температуры электролита выше температуры 11,5 ° C приводит к увеличению значения микротвердости слоя. Этот рост составляет в среднем 42,8%. Повышение температуры электролита приводит к значительному изменению проводимости электролита и даже при низком напряжении образуется стабильный слой. При плотности тока 3 А · дм -2 из-за повышения температуры электролита происходит снижение микротвердости слоя.Дальнейшее увеличение плотности тока до 5 А · дм -2 приводит к увеличению микротвердости слоя за счет повышения температуры. Этот рост во всем интервале экспериментально применяемых температур составляет около 17%. Напряжение 8,5 В на практике не используется. В статье он использовался только для сравнения возникающих изменений микротвердости слоев.
Увеличение напряжения до 10,5 В при анализе изменения микротвердости слоя из-за влияния температуры электролита показано на рисунке 11.При плотности тока 1 А · дм -2 во всем диапазоне применяемых температур электролита наблюдается увеличение значения микротвердости. Этот рост составляет около 73%. По сравнению с ходом зависимости микротвердости слоя от влияния температуры электролита при напряжении 8,5 В и температуре -1,78 ° С уменьшение значения микротвердости составляет 35%. При повышении температуры электролита до 48,78 ° С, при напряжении 10.5 В происходит увеличение значения микротвердости на 34% по сравнению с микротвердостью слоя при напряжении 8,5 В. При плотности тока 3 А · дм -2 наблюдается небольшое уменьшение значения микротвердость слоя за счет повышения температуры электролита на 8,4%. За счет увеличения напряжения на 2 В значение микротвердости слоя при температуре электролита -1,78 ° C увеличится на 10%, а при температуре электролита 48,78 ° C — почти на 94%.Увеличение плотности тока до 5 А · дм -2 приводит к увеличению значения микротвердости слоя в зависимости от температуры примерно на 15%.
Зависимость микротвердости слоя от температуры электролита при напряжении 13,5 В можно увидеть на рисунке 12. При всех плотностях тока можно наблюдать увеличение микротвердости слоя вместе с повышением температуры электролита. Таким образом, величина напряжения достаточна для образования стабильного оксида независимо от плотности тока.На основании (1) и (2) курсы и пересекаются в некоторой точке. В этом случае, в зависимости от напряжения, прогрессию и можно разделить на три области с двумя критическими значениями. — приложенное напряжение, когда и — напряжение, при котором. При выполнении условия при анодном окислении в электролите присутствует стабильный оксидный слой, который анодным напряжением защищается от растворения в соответствии с химической реакцией (2). При плотности тока 1 А · дм -2 скорость роста значения микротвердости слоя по изменению температуры электролита во всем интервале составляет в среднем 83%.При увеличении плотности тока до 3 А · дм -2 скорость роста значения микротвердости слоя в зависимости от температуры падает примерно до 56%. В интервале температур более 36 ° С значение микротвердости слоя при 1 А · дм −2 выше, чем при плотности тока 3 А · дм −2 на 8%. При плотности тока 5 А · дм -2 микротвердость слоя достигает наивысших значений при повышении температуры электролита.Рост значений микротвердости 47%. Мы наблюдаем, что температура электролита оказывает существенное влияние на значения микротвердости при напряжении до 13,5 В.
4. Выводы
В работе показано влияние температуры электролита на изменение значений микротвердости слоя, образованного оценено анодное окисление алюминия. Электролит состоял из H 2 SO 4 и C 2 H 2 O 4 .Показано, что повышение температуры электролита приводит к росту значения микротвердости слоя при плотности тока 1 А · дм −2 . Однако время анодирования 48,78 мин позволяет определить критическую температуру, при которой изменение температуры электролита влияет на значения микротвердости слоя. Средний рост значений микротвердости слоя в зависимости от температуры при плотности тока 1 А · дм -2 составляет 66%.Однако с увеличением количества серной кислоты в электролите рост микротвердости слоя уменьшается примерно на 24%. Наряду с одновременным влиянием времени анодирования в интервале от 1,22 мин до 25 мин наблюдается рост значения микротвердости слоя в зависимости от температуры электролита на 5%. При увеличении времени анодного окисления до более чем 25 минут происходит снижение значения микротвердости слоя примерно на 4%. Повышение напряжения приводит к росту микротвердости слоя в зависимости от температуры электролита почти на 39%.При плотности тока 3 А · дм -2 микротвердость слоя снижается из-за температуры вместе с увеличением молярной концентрации серной кислоты. Рост значения микротвердости слоя наблюдался при времени анодирования 25 мин. Выше и ниже этого времени происходит снижение значения микротвердости слоя из-за температуры электролита. При плотности тока 5 А · дм -2 влияние температуры электролита на изменение значения микротвердости слоя незначительно.Рост значения микротвердости слоя происходит только при напряжении выше 10,5 В.
Процесс анодного окисления алюминия сложный. На изменение значения микротвердости слоя одновременно действует множество факторов. Поэтому необходимо учитывать влияние этих рабочих факторов при изучении изменений параметров пластов. Как показано, при различных условиях анодирования микротвердость слоя в зависимости от температуры и плотности тока изменялась по-разному.Исследуя эти зависимости, можно сгенерировать слои с необходимыми параметрами качества.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Исследование было поддержано Проектом структурных фондов ЕС «Исследование и разработка интеллектуальных нетрадиционных приводов на основе искусственных мышц», код ITMS: 26220220103, а также грантом VEGA. 1/0738/14 «Исследование коррозионной стойкости стальных листов с покрытием для использования в автомобильной промышленности» Агентства научных грантов Министерства образования Словацкой Республики и Словацкой академии наук.
Последние достижения в области высоковольтных и высокоэнергетических водных аккумуляторных батарей
Водные литиевые аккумуляторные батареи (ARLB)
Водные аккумуляторные литиевые батареи (ARLB) разрабатываются с 1994 года [4]. Они имеют среднее напряжение разряда около 1,5 В и работают обратимо. Они могут обеспечить плотность энергии 75 Вт · ч кг −1 (исходя из общей массы активных материалов), что сопоставимо с характеристиками свинцово-кислотных и никель-кадмиевых аккумуляторов.Как указано в этой новаторской исследовательской работе, окислительно-восстановительные потенциалы выделения водорода (HER) и кислорода (OER) являются важными контрольными факторами при выборе материалов для двух электродов для ARLB. Иными словами, рабочий потенциал материала электрода должен находиться между OER и HER, чтобы избежать реакции электролиза воды. В последнее время появилось много подробных обзоров электродных материалов ARLB [3, 5, 6, 7, 8, 9]. Поэтому мы не будем здесь подробно останавливаться на этом. В этой части мы только резюмируем текущую работу по ARLB высокого напряжения и плотности энергии.
Для создания ARLB высокого напряжения и высокой плотности энергии существует несколько стратегий: (1) улучшение электролита, например использование сверхконцентрированных электролитов, и (2) использование материалов отрицательных электродов (таких как сера, литий, цинк и др.). графит) с высокой удельной емкостью и / или низким окислительно-восстановительным потенциалом [10].
Сверхконцентрированные электролиты
Электролиты «вода в соли» / «вода в бисоле»
Электролит «вода в соли» (WiS) впервые был использован в ARLB в 2015 году Ван и его коллегами, что расширило окно электрохимической стабильности до прибл.3,0 В (1,9–4,9 В по сравнению с Li + / Li) и открыли новые возможности в водной электрохимии [11]. Бис (трифторметансульфонил) имид лития (LiTFSI) был выбран в качестве соли из-за его высокой растворимости в воде (> 20 м; в этой статье единица m относится к моль кг -1 ), а также из-за его высокой концентрации с гидратированная вода, обладающая высокой гидролитической стабильностью. Определение WiS применяется, когда вес и объем соли превышают вес и объем растворителя в бинарной системе. Когда концентрация LiTFSI достигает 21 м, окно его электрохимической стабильности увеличивается до 3 В (рис.2а). В этом отчете LiMn 2 O 4 и Mo 6 S 8 были использованы в качестве материалов отрицательного электрода для сборки ARLB, что подтвердило возможность использования электролита WiS длиной 21 м. Стоит отметить, что окислительно-восстановительные потенциалы этих электродных материалов переходят в положительный потенциал с увеличением концентрации соли. Согласно уравнению Нернста, это в основном связано с изменением в нем активности Li + . Эти ARLB могут выдавать до 2,3 В и иметь среднее напряжение разряда 1.83 В, что значительно выше, чем у традиционных ARLB или ARLB 1-го поколения, использующих обычные водные растворы электролитов. Существует две причины, по которым электролит WiS имеет такой широкий диапазон напряжений (см. Рис. 2b). С одной стороны, свободных молекул воды достаточно, чтобы полностью гидратировать ионы лития в разбавленном водном растворе. С увеличением концентрации соли становится доступным меньше некоординированных молекул воды, и сольватация или гидратированный слой иона лития резко изменяется.Когда концентрация увеличивается до 21 мкм, отношение воды к иону лития составляет всего 2,6, что означает, что Li + частично дегидратирован, и электростатическое поле, создаваемое формальным зарядом на ионе лития, больше не может нейтрализоваться координацией с водой. В результате ионы TFSI — попадают в сольватационный слой Li + . Поскольку восстановительный потенциал TFSI — ниже, чем у воды, TFSI — разлагается на поверхности материала отрицательного электрода с образованием плотного защитного слоя SEI (в основном LiF) перед разложением воды.С другой стороны, активность воды снижается из-за небольшого количества свободных молекул воды после высокой концентрации, что помогает повысить электрохимическую стабильность положительных и отрицательных электродов. Следовательно, можно видеть, что взаимодействие этих двух факторов значительно расширяет диапазон напряжений электролита. Однако материалы положительного и отрицательного электрода, выбранные для батареи, не полностью используют окно напряжения электролита LiTFSI WiS. Аккумулятор Mo 6 S 8 / LiFePO 4 [12] и аккумулятор TiS 2 / LiMn 2 O 4 [13] ведут себя аналогичным образом.Следовательно, необходима дальнейшая оптимизация материалов положительного и отрицательного электродов для дальнейшего повышения напряжения и плотности энергии ARLB. Для материалов положительного электрода могут быть выбраны материалы с более высоким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, LiCoO 2 и LiNi 0,5 Mn 1,5 O 4 . Для отрицательных электродов также могут быть выбраны материалы с более низким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, TiO 2 и сера.
Рис. 2a Окно электрохимической стабильности электролитов LiTFSI-H 2 O с различной концентрацией. b Схематическая диаграмма эволюции оболочки первичной сольватации Li + в разбавленном растворе и водно-солевом электролите. Воспроизведено с разрешения Ref. [11]. Авторские права 2015, AAAS. c Профили напряжения заряда и разряда полных элементов LiVPO 4 F при различных скоростях. d Длительная цикличность полных ячеек LiVPO 4 F при 20 C.Воспроизведено с разрешения Ref. [14]. Copyright 2017, John Wiley and Sons
LiVPO типа таворита 4 F можно использовать в качестве материалов как положительных, так и отрицательных электродов для ARLB [14]. Кривая заряда-разряда при постоянном токе (рис. 2c) показывает, что LiVPO 4 F имеет два набора плато заряда и разряда, которые, соответственно, соответствуют интеркаляции и деинтеркаляции ионов лития. Группа с высоким потенциалом соответствует редокс-паре V 4+ / V 3+ (около 4.26 В относительно Li + / Li), а группа с низким потенциалом соответствует редокс-паре V 3+ / V 2+ (около 1,8 В относительно Li + / Li). Используя этот материал в качестве положительного и отрицательного электродов, соответственно, и гелевого электролита LiTFSI «вода-в-соли», была собрана гибкая симметричная батарея с выходным напряжением 2,46 В (среднее напряжение разряда до 2,4 В), продемонстрировав отличные характеристики. .
Характеристики симметричной ячейки с 21-метровым электролитом LiTFSI WiS неудовлетворительны, а кулоновский КПД составляет 96% всего после 50 циклов.Гелевый электролит LiTFSI WiS толщиной 25 мкм был приготовлен путем добавления ПВС, и окно стабильности напряжения было расширено. Собранная таким образом симметричная батарея циклически перерабатывалась с низкой скоростью 0,2 ° С. Всего через десять циклов кулоновский КПД достиг 100%. При температуре 20 ° C емкость батареи все еще составляла 87% после 4000 циклов, а кулоновский КПД был близок к 100% в течение всего цикла (рис. 2d). Также было впервые обнаружено, что пленка SEI на поверхности материала положительного электрода в электролите LiTFSI WiS представляет собой смесь 49% Li 2 CO 3 и 51% LiF.Это открытие раскрыло секрет того, как Li + может транспортироваться в SEI, поскольку LiF является изолятором как для ионной, так и для электронной проводимости. Если SEI состоит в основном из LiF, очевидно, что он не будет способствовать передаче Li + . Поскольку Li 2 CO 3 имеет лучшую проводимость, чем LiF, область носителей сверхвысокой концентрации генерируется пространственным зарядом на границе раздела между Li 2 CO 3 и LiF, который является каналом быстрого Li + ионный транспорт.Следовательно, даже в плотной пленке SEI ионы Li + все еще могут быстро транспортироваться вдоль границы зерен LiF / Li 2 CO 3 , что объясняет хорошие характеристики LiVPO 4 F. Результаты импеданса переменного тока испытания показывают, что сопротивление интерфейса отрицательного электрода увеличивается только на 50% после 20 циклов, что показывает, что LiF – Li 2 CO 3 –SEI по-прежнему обеспечивает высокую проводимость для ионов Li + .
Многослойных LiCoO 2 электродов обеспечивают удельную емкость 140 мАч g −1 при зарядке до 4.2 В (по сравнению с Li + / Li), что соответствует 50% экстракции Li до Li 0,5 CoO 2 , который считается относительно стабильным материалом положительного электрода в ARLB [15,16,17,18 ]. В органических электролитах при зарядке до 4,5 В (по сравнению с Li + / Li) достигается более высокая удельная емкость 180 мАч g -1 (соответствует экстракции 70% Li). Однако электрод страдает от серьезного снижения емкости во время циклирования в водных электролитах из-за растворения Co и побочной реакции между Li 0.3 CoO 2 и электролит. Трис (триметилсилил) борат (TMSB) вводился в электролит WiS в качестве добавки и непрерывно окислялся и разлагался с образованием стабильной межфазной пленки катодного электролита (CEI) на поверхности положительного электрода LiCoO 2 во время процесса зарядки. . Wang et al. обнаружили, что после окисления TMSB образует защитную межфазную поверхность на положительном электроде LiCoO 2 [19]. При высоком напряжении отсечки LiCoO 2 с межфазной защитой выдавал высокую емкость 170 мАч g −1 с замечательной стабильностью при циклических нагрузках.ARLB, соединяющий положительный электрод LiCoO 2 с отрицательным электродом из Mo 6 S 8 , показал напряжение холостого хода 2,50 В и напряжение средней точки 1,95 В, достигая плотности энергии до 120 Втч кг -1 и низкой скорость снижения емкости 0,013% за цикл, поскольку защитная межфазная поверхность эффективно подавляет OER и растворение кобальта с положительного электрода в растворе электролита.
Техническая шпинель LiNi 0,5 Mn 1.5 O 4 имеет две кристаллические структуры, P4332 и fd-3 m. Среди них P4332 LiNi 0,5 Mn 1,5 O 4 имеет более высокое плато потенциала окислительно-восстановительного литирования / делитирования, а из-за высокой концентрации соли в электролите WiS, платформу окислительно-восстановительного потенциала интеркаляции / делитирования. LiNi 0,5 Mn 1,5 O 4 имеет положительный сдвиг примерно от 0,2 В до 4,8–5,0 В (по сравнению с Li / Li + ), что находится за пределами окна стабильности электролита WiS.Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 ниже, чем у P4332 LiNi 0,5 Mn 1,5 O 4 . Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 отличается от P4332 LiNi 0,5 Mn 1,5 O 4 из-за небольшого количества Mn 3+ в fd-3 м LiNi 0,5 Mn 1,5 O 4 , а ионный радиус Mn 3+ больше, чем у Mn 4+ , что приводит к расширению решетки и диффузии Li + прибавка.В электролите WIS две платформы напряжения fd-3 m LiNi 0,5 Mn 1,5 O 4 перемещаются до 4,8–5,0 В. Хотя они превышают окно стабильности напряжения электролитов, они могут полностью использовать свои емкость путем регулирования значения pH электролитов, чтобы ингибировать реакцию выделения кислорода. Хорошо известно, что с понижением pH потенциал HER и OER в водных электролитах будет повышаться. Когда 0,1% (в объемных долях) 1 м бис (трифторметилсульфонил) имида (HN (SO 2 CF 3 ) 2 , HTFSI) было добавлено в электролит WiS, значение pH электролита WiS снизилось до 5 и окно сдвинулось на 0.1 В. Однако самый низкий окислительно-восстановительный потенциал (2,1 В) Mo 6 S 8 все еще выше, чем у HER (1,9 В) электролитов WiS (pH доведен до 5). Положительный материал fd-3 м LiNi 0,5 Mn 1,5 O 4 можно заряжать до 5,05 В (по сравнению с Li + / Li), и он может работать стабильно. Таким образом, можно собрать полные элементы Mo 6 S 8 // LiNi 0,5 Mn 1,5 O 4 , которые имеют среднее напряжение разряда до 2.35 В и плотность энергии 126 Втч кг −1 [20].
Когда 7 м LiOTf (трифторметансульфонат лития) непрерывно добавлялся к 21 м электролитам LiTFSI WiS (обратите внимание, что первоначальный термин «растворять» не подходит, поскольку невозможно получить такой настоящий водный раствор), чтобы получить «вода в бисальте». (WibS) электролиты, в которых концентрация ионов Li + достигала 28 мкм, соответствующее отношение молекул воды к ионам соли составляло около 2 [21]. Из-за более высокой концентрации соли плотность слоя SEI увеличивалась, а активность воды снижалась еще больше, так что он имел более широкое окно электрохимической стабильности около 3.1 В (рис. 3а). На основе этого электролита WibS был приготовлен ARLB с TiO 2 в качестве отрицательного электрода и LiMn 2 O 4 в качестве положительного электрода, с напряжением холостого хода 2,5 В, плато напряжения 2,07 В и энергией плотность 100 Вт · ч кг −1 (рассчитана на основе общей массы электродов) (рис. 3б). Электролит WibS на основе ацетата был сконструирован путем смешивания неорганических солей LiOAc и KOAc, которые имели отношение воды к катионам всего лишь 1.3 [22]. Результаты показывают, что обычные материалы отрицательного электрода, такие как Li 4 Ti 5 O 12 и TiO 2 , могут обратимо интеркалировать / деинтеркалировать Li + в этом электролите WibS, а собранный TiO 2 / Mn 2 O 4 ARLB имеет плоское разрядное плато 2,10 В (рис. 3c). Электролит недорогой, экологически чистый, легко регулируется, легко адаптируется и универсален.
Фиг.3a Электрохимические окна электролитов WibS и WiS при скорости сканирования 10 мВ с −1 и первые следы CV активных электродов (C-TiO 2 и LiMn 2 O 4 ) при скорости сканирования 0,1 мВ с −1 в электролитах WibS. b Профили заряда-разряда аккумуляторов C-TiO 2 / LiMn 2 O 4 в 5-м и 100-м циклах. Воспроизведено с разрешения Ref. [21].Авторское право 2016, Wiley – VCH. c Профиль заряда-разряда c-TiO 2 / LiMn 2 O 4 аккумуляторов при 0,5 C в электролитах WibS на основе ацетата. Воспроизведено с разрешения Ref. [22]. Авторское право 2018, Королевское химическое общество
Электролиты гидрат-расплав
Определение плавления гидрата аналогично определению WibS. Фактически, конструкция электролита WibS была вдохновлена электролитом гидрат-расплав [23]. Электролит гидрат-расплав на самом деле является продолжением сверхконцентрированного электролита в системе, в которой вода является растворителем.Сверхконцентрированные электролиты использовались в литий-ионных батареях. Было обнаружено, что они могут не только улучшить стабильность батарей, но и увеличить рабочее напряжение (4 В). Эта концепция была впервые применена Yamada et al. к водным системам хранения энергии и известен как «гидрат-расплав». Исследовали эвтектический состав солей лития Li (SO 2 CF 3 ) 2 (LiTFSI) и солей лития Li (SO 2 C 2 F 5 ) 2 (LiBETI), оба имеют органический имидный анион.Результаты показывают, что, когда состав представляет собой Li (TFSI) 0,7 (BETI) 0,3 , растворимость смеси с водой является максимальной, может быть получен стабильный прозрачный раствор, а концентрация молекулы воды составляет всего 10,1 м ( Рис. 4а). Большое количество анионов TFSI / BETI изолируют свободные молекулы воды друг от друга, и все молекулы воды могут участвовать в гидратной оболочке ионов лития, тем самым снижая активность молекул воды и расширяя окно электрохимической стабильности электролитов.В этом растворе все молекулы воды координированы с ионами лития, а внутримолекулярные водородные связи практически не заметны (рис. 4б). Кроме того, было обнаружено, что равновесный потенциал реакции внедрения / отслаивания иона лития составлял 0,25 В в электролите гидрат-расплав, что было больше, чем значение в 22-метровом LiTFSI (рис. 4с). Термодинамический механизм (который снижает уровни ВЗМО) и кинетический механизм (пассивация, вызванная анионами) еще больше увеличивают разность потенциалов между анодом и катодом, тем самым расширяя окно напряжения до 3.8 В (рис. 4г). На основе электролита гидрат-расплав: Li 4 Ti 5 O 12 // LiCoO 2 и Li 4 Ti 5 O 12 // LiNi 0,5 Mn 1,5 O Было установлено 4 полных ARLB, которые демонстрировали высокие плато напряжения разрядной ячейки при 2,26 В и 3,10 В, соответственно. На данный момент существует немного других исследований по применению электролитов расплава гидрата в водных батареях. Недавно Wu et al. применили электролиты к батареям Li-O 2 , которые, как было показано, эффективно предотвращают разложение растворителя и образование побочных продуктов, тем самым увеличивая срок службы Li-O 2 батарей [24].Для дальнейшей оценки и улучшения применимости электролита необходимы все более и более глубокие исследования.
Рис. 4a Линия ликвидуса смесей LiTFSI + LiBETI в воде. b Первопринципный DFTMD моделирует снимок равновесной траектории Li (TFSI) 0,7 (BETI) 0,3 · 2H 2 O гидратный расплав и разбавленный LiTFSI / H 2 O. c Взаимосвязь между изменение равновесного потенциала интеркаляции лития и концентрации электролитов Li + . d Окна напряжений обычных электролитов LiTFSI / H 2 O и гидратированных электролитов расплава, а также окислительно-восстановительный потенциал Li 4 Ti 5 O 12 , LiCoO 2 , LiNi 0,5 Mn 1.5 O 4 в гидратированных электролитах-расплавах. Воспроизведено с разрешения Ref. [23]. Copyright 2016, Nature Publishing Group
Гибридный водный / неводный электролит (HANE)
Путем введения неводного растворителя, диметилкарбоната (DMC), в электролит WiS, гибридный водно-неводный электролит (HANE) с расширенным электрохимическим окном 4.1 В. Это нейтральный растворитель, который менее чувствителен к отталкиванию отрицательного электрода и, следовательно, легче участвует в межпространственной химии, чем анионы [25]. На основе этого гибридного электролита был создан ARLB, состоящий из положительного электрода LiNi 0,5 Mn 1,5 O 4 и отрицательного электрода Li 4 Ti 5 O 12 . Этот ARLB с плоским плато разряда при 3,2 В (рис. 5a) имел плотность энергии до 165 Вт · ч · кг −1 и циклическую стабильность более 1000 циклов (рис.5б). В аналогичном подходе также сообщалось о гибридной системе «ацетонитрил (AN) / вода-в-соли» электролита (AN-WiS), обеспечивающей повышенную ионную проводимость, пониженную вязкость и расширенный диапазон температур [26]. Увеличение концентрации соли LiTFSI в AN – WiS до уровня сверхконцентрации (15,3 м) расширяет окно электрохимической стабильности до 4,5 В [27]. Этот AN – WiSE активировал ARLB, например Li 4 Ti 5 O 12 / LiMn 2 O 4 и Li 4 Ti 5 O 12 / LiNi 0.8 Co 0,15 Al 0,05 O 2 полных батарей, с высоким напряжением, высокой плотностью энергии и отличными характеристиками при езде на велосипеде.
Рис. 5a Кривые разряда ячейки LTO-LNMO при различных скоростях. b Циклические характеристики полных ячеек LTO-LNMO при 6 C. Воспроизведено с разрешения Ref. [25]. Copyright 2018, Elsevier B.V. c Сравнение напряжения завершения зарядки различных солей для ARLB. d Кривые заряда-разряда элемента TiO 2 / LiMn 2 O 4 при 5 C; вставленный график — это циклическая производительность батареи [28].Воспроизведено с разрешения Ref. [28]. Copyright 2018, Nature Publishing Group
Электролит вода в иономере
Новый тип электролитов типа «вода в иономере» был представлен He et al. [28]. Электролит «вода в иономере», содержащий 50 мас.% Иономера, имеет окно электрохимической стабильности 2,7 В (рис. 5c). Полный элемент LiTi 2 (PO 4 ) 3 / LiMn 2 O 4 на основе этого электролита показал отличные циклические характеристики и обеспечил среднее напряжение разряда> 1.5 В и удельной энергией 77 Втч кг −1 . Кроме того, с использованием алюминиевого токосъемника была получена полная батарея TiO 2 / LiMn 2 O 4 со средним выходным напряжением 2,1 В и начальной удельной энергией 124,2 Вт · ч · кг −1 (рис. 5d). .
Роль SEI
Разложение добавок к электролиту
Добавление добавок к электролиту также может формировать защитную, подобную SEI межфазную фазу на месте. Добавки должны соответствовать следующим требованиям: (1) иметь химическую стабильность, то есть стабильность в данном растворе электролита, и (2) иметь электрохимическую стабильность, чтобы электрохимический процесс мог происходить во время разложения с образованием межфазных компонентов.
Гель LiTFSI-HFE (высокофторированный эфир) был нанесен на поверхности отрицательных электродов в качестве межфазного покрытия-предшественника, которое было использовано для получения твердой межфазной поверхности, состоящей как из органических фторированных углеводородов, так и неорганических фторидов, что позволило получить высокую емкость / низкую производительность. потенциальные материалы отрицательного электрода (такие как кремний, графит и металлический Li) для обратимого цикла в гелевых полимерных электролитах (GPE) 21 м LiTFSI + 7 м LiOTf WibS (рис. 6a) [29]. Соединение отрицательных электродов с покрытием с различными материалами положительных электродов, серия из 4 штук.Были получены ARLB 0 В с высокой эффективностью и обратимостью, сопоставимые с коммерческими литий-ионными батареями (рис. 6b – d). Кроме того, ARLB со сверхвысокой плотностью энергии 460 Вт · ч кг -1 был разработан путем соединения отрицательного электрода из гелевого графита HFE и положительного электрода конверсионного интеркаляционного типа (LiBr 0,5 Cl 0,5 ) — графита (LBC –G) (рис. 6д, е) [30].
Рис. 6a Зарядно-разрядные кривые графитовых электродов, предварительно покрытых гелем LiTFSI-HFE.Профили напряжения b Li / LiVPO 4 F аккумуляторов, c графитовых / LiVPO 4 F аккумуляторов и d Li / LiMn 2 O 4 аккумуляторов при 0,3 C. e Типичные кривые заряда-разряда (третьи циклы) аккумуляторов графит // LiBr / LiCl (синий) или графитовые // аккумуляторы с моногидратами LiBr / LiCl (красный). f Устойчивость этих полностью заряженных аккумуляторов во время езды на велосипеде. Воспроизведено с разрешения Ref. [29]. Авторские права 2017, Elsevier B.V. g Схематическое изображение металлического лития LISICON с пленочным покрытием. ч Кривая постоянного тока заряда-разряда Li / LiMn 2 O 4 аккумуляторов в первом цикле. Воспроизведено с разрешения Ref. [31]. Авторское право 2013, Исследования природы. i Кривые постоянного тока заряда-разряда во втором и десятом циклах Li / LiCoO 2 аккумулятора. Воспроизведено с разрешения Ref. [32]. Copyright 2013, Королевское химическое общество
Искусственный SEI
Для реализации функционального металлического литиевого электрода в водной электролитной системе на его поверхность можно нанести тонкий и компактный защитный слой раздела или искусственный SEI.Этот искусственный SEI должен не только иметь высокую ионную проводимость, чтобы можно было проводить электрохимический процесс, но и предотвращать проникновение воды, чтобы молекулы воды не могли проходить сквозь него, чтобы избежать реакции между молекулами воды и металлическим литием.
Наша группа представила пленку литиевого суперионного проводника (LISICON) на отрицательном электроде из металлического лития (рис. 6g) [31]. В этом исследовании LISICON служил комбинированным сепаратором и твердым электролитом с ионной проводимостью при комнатной температуре около 0.1 мСм см −1 . С LiMn 2 O 4 в качестве положительного электрода и 0,5 M Li 2 SO 4 (единица M — традиционная молярная концентрация, которая составляет моль л -1 ) в качестве электролитов, ионы лития переносятся через водный электролит со стороны положительного электрода, проходят через слой покрытия LISICON и достигают отрицательного электрода из металлического лития. Благодаря низкому потенциалу зачистки / металлизации металлического лития рабочее напряжение полученных ARLB увеличилось до более 4 В с плато на уровне 4.06 В и 3,85 В (рис. 6h). Подобные высоковольтные ARLB с высокой плотностью энергии были также разработаны на основе гелевой полимерной мембраны с литиево-графитовым отрицательным электродом с покрытием LISICON и положительным электродом LiCoO 2 / LiFePO 4 [32, 33]. Однако неудовлетворительная ионная проводимость LISICON может стать проблемой для достижения хороших скоростных характеристик. Ионная проводимость электрода со структурой перовскита, Al-замещенного литий-лантана-титанита (A-LLTO), разработанного Ле и соавторами, была увеличена до 0.317 мСм см −2 , что намного больше, чем 0,1 мСм см −2 , полученное с помощью LISICON [34]. Когда A-LLTO применялся в качестве искусственного SEI к отрицательному электроду из металлического лития, и он был объединен с положительным электродом LiCoO 2 , полученный ARLB имел напряжение холостого хода почти 4,2 В и высокую удельную емкость 164 мА · ч. −1 при 0,1 C (рис. 6i). Тем не менее, его скоростные характеристики все еще не были сопоставимы с характеристиками обычных ARLB, и проблема низкой ионной проводимости искусственного SEI все еще требует решения.Более того, для создания искусственного SEI на поверхности металлического лития обычно требуется дополнительный слой для предотвращения прямого контакта между металлическим литием и проводящим разделительным слоем (LISICON, A-LLTO, LATP и т. Д.), Поскольку последний в противном случае был бы восстановлены металлическим литием из-за их химической нестабильности. Дополнительный слой обычно представляет собой гелевый полимерный электролит, состоящий из такого тонкого полимерного слоя (PVDF / PMMA / PVDF и PEO и т. Д.), Насыщенного органическими электролитами (1 M LiClO 4 в EC / DMC).
Система перезаряжаемых Ni – Li батарей была изготовлена с использованием 1 M LiClO 4 в этиленкарбонате / диметилкарбонате (EC / DMC) в качестве органических электролитов для металлического литиевого отрицательного электрода и 1 M LiOH + 1 M KOH в качестве водных электролитов. для положительного электрода Ni (OH) 2 [35]. Органический и водный электролиты были разделены тонкой пленкой LISICON. Батарея имела напряжение плато 3,47 В и удельную емкость 268 мАч g -1 , что приводило к очень высокой плотности энергии 935 Втч кг -1 на основе общей массы активных материалов.В этой батарее использовались положительный электрод NiO / CNT конверсионного типа и отрицательный металлический литиевый электрод с гибридным водно-органическим электролитом, разделенные литий-ионной проводящей пленкой LATP (Li 1+ x + y Al x Ti 2− x Si y P 3− y O 12 ) [36]. У него было стабильное плато разряда при 3,38 В, но необходимы дальнейшие разработки, чтобы повысить его устойчивость к циклическим нагрузкам.
Использование отрицательных материалов с высокой удельной емкостью или низким окислительно-восстановительным потенциалом
Водная перезаряжаемая гибридная батарея (ARHB) с положительным электродом LiMn 2 O 4 и отрицательным электродом из металла Zn была впервые предложена в 2012 году и работает примерно при 2 В, демонстрируя приемлемую плотность энергии (50–80 Вт · ч, кг –1 ) и хорошие характеристики при циклическом режиме (сохранение емкости 95% после 4000 циклов) [37]. Однако его электрохимические свойства, такие как кулоновский КПД, нуждаются в дальнейшем улучшении.К настоящему времени предприняты следующие меры: (1) модификация поверхности и защита материалов положительных электродов; (2) улучшение электролитов; и (3) обработка цинкового отрицательного электрода.
Из-за низкой проводимости LiMn 2 O 4 и структурных изменений, вызванных искажением Яна – Теллера, гибридная батарея Zn / LiMn 2 O 4 имеет низкие энергетические характеристики и подвергается серьезной деградации емкости. Поскольку углерод в целом может использоваться для изготовления композитов, было обнаружено, что использование графеновых пленок в качестве искусственных SEI на поверхности LiMn 2 O 4 эффективно подавляет структурные искажения LiMn 2 O 4 . и значительно увеличивает ионную проводимость LiMn 2 O 4 , тем самым улучшая цикличность и быстродействие гибридной батареи [38, 39].
Из-за ограничения окна электрохимической стабильности, образования дендритов цинка и коррозии отрицательного цинкового электрода модификация электролита является еще одним эффективным способом улучшения электрохимических характеристик водного Zn / LiMn 2 O 4 гибридных аккумулятора . Многие добавки, включая тиомочевину (TU) [40], SiO 2 [41], циклодекстрин (CD) [42] и коллоидальный диоксид кремния (FS) [43], были введены в электролит для улучшения электрохимических характеристик гибридных батареи.Хотя есть некоторые улучшения, эффекты все еще неудовлетворительны, и требуется дальнейшее улучшение.
Недавно Ван и его коллеги сообщили об электролите WiS, состоящем из 1 мкм Zn (TFSI) 2 + 20 мкм LiTFSI, в котором цинковый отрицательный электрод является очень обратимым. Гибридная батарея Zn / LiMn 2 O 4 достигла наивысшей плотности энергии, когда массовое отношение Zn / LiMn 2 O 4 было уменьшено до 0,25: 1. Кроме того, кривые заряда / разряда для разных циклов гибридной батареи сильно совпадают, что показывает ее хорошую электрохимическую обратимость.При температуре 4 ° C сохранение емкости после 4000 циклов составило 85%, при этом CE достигает 99,9%, что лучше, чем все ранее описанные работы с Zn-Li-батареями [44]. Однако высокая стоимость использования больших количеств органической соли может препятствовать применению смешанных ионно-цинковых аккумуляторов в крупномасштабных системах хранения энергии.
Сообщается о новом электролите «глубокой эвтектики воды (WiDES)», который может ингибировать реакцию отрицательного цинкового электрода, уменьшать коррозию и пассивацию цинкового отрицательного электрода, увеличивать коэффициент использования цинка, и улучшить жизненный цикл [45].Следовательно, гибридная батарея Zn / LiMn 2 O 4 , в которой используется этот электролит WiDES, демонстрирует отличные характеристики при циклических нагрузках.
В дополнение к LiMn 2 O 4 , другие коммерческие материалы положительных электродов для литий-ионных батарей, такие как LiFePO 4 , LiNi 1/3 Co 1/3 Mn 1/3 O 2 , Li 3 V 2 (PO 4 ) 3 (LVP) и LiMn 0,8 Fe 0,2 PO 4 , также были изучены в качестве материалов потенциальных положительных электродов для водных аккумуляторов. Zn – Li гибридные батареи.Поскольку в нескольких статьях рассматривалась соответствующая работа в этой области, мы не будем здесь подробно останавливаться. Эти работы сведены в Таблицу 1 и Рис. 7а.
Таблица 1 Электрохимические свойства различных ARLB с высоким напряжением и плотностью энергии Рис.7Плотность энергии и средняя разрядная емкость различных a ARLB, b ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергии
Водные Na-ионные батареи
Развитие водных натрий-ионных батарей (ASIB) в основном связано с тем, что ресурсы натрия в земной коре намного больше, чем ресурсы лития.Кроме того, для ASIB доступно множество материалов для положительных и отрицательных электродов, которые показывают очень хорошие электрохимические характеристики [49,50,51,52]. О ходе исследований электродных материалов существует множество обзоров, причем они также являются исчерпывающими [3, 6, 9]. Однако нет никаких систематических исследований того, как построить ASIB с высокой плотностью энергии. В таблице 2 и на рис. 7b представлены подробные сведения о характеристиках ASIB, о которых сообщалось на сегодняшний день.
Таблица 2 Электрохимические свойства различных ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергииКак упоминалось выше, есть два способа улучшить энергетическую плотность химического состава водных аккумуляторов.Один заключается в расширении окна напряжения, а другой — в выборе подходящих материалов для отрицательного и положительного электродов с большой разностью потенциалов и высокой удельной емкостью.
Сверхконцентрированные электролиты
Разработка соответствующих натриевых электролитов WiS остается серьезной проблемой для разработки натриево-ионных батарей в водных растворах, поскольку существующие натриевые электролиты еще не отвечают требованиям высокой растворимости солей, содержащих химические источники (фтор). -содержащие соли), высокая химическая и электрохимическая стабильность в воде.Подобно ARLB, электролиты WiS также можно наносить на ASIB для расширения электрохимического окна. Установлено, что сила между Na + и TFSI — намного сильнее, чем сила между Li + и TFSI —, поэтому, хотя водный раствор соли NaTFSI может достигать только 9,26 м, он может образовывать SEI проводимости Na + , а окно электрохимической стабильности может достигать 2,5 В [53]. На основе этого электролита NaTi 2 (PO 4 ) 3 // Na 0.66 [Mn 0,66 Ti 0,34 ] O 2 была собрана полная батарея со стабильной циклической производительностью и удельной энергией 31 Втч кг -1 . При комнатной температуре концентрации растворов трифторида натрия (NaOTf) и бис (трифторметансульфонил) имида (NaTFSI) низкие (9–10 м), и нельзя полностью использовать преимущество суперконцентрированных электролитов. Следовательно, для дальнейшего развития высоковольтных ASIB необходимы соответствующие натриевые соли для производства высококонцентрированных электролитов WiS.Установлено, что NaFSI обладает высокой растворимостью (до 37 моль) в водном растворе и стабильным электрохимическим окном 2,6 В при концентрации до 35 моль. Дальнейшие исследования показывают, что катоды NaTi 2 (PO 4 ) 3 и катоды Na 3 (VOPO 4 ) 2 F могут использоваться в ASIB с напряжением более 2 В [54] . Смешанные катионные смеси динатрия можно использовать для приготовления электролитов с более высокими концентрациями, например, 9 м NaOTf + 8 м KOTf и 22 м KOTf + 4 м NaOTf.Однако присутствие нескольких катионов может привести к встраиванию смешанных катионов в материал электрода, влияя на характеристики элемента. Чтобы решить эту проблему, исследователи разработали новый класс электролитов WiS с поддержкой взаимодействия, содержащих соли трифторида тетраэтиламмония (TEAOTf), которые из-за большого ионного радиуса TEA + трудно внедрить в большинство электродных материалов [включая прусский Синий аналог (PBA)], что позволяет избежать совместной интеркаляции мультикатионов в циклическом процессе [55].Этот активированный взаимодействием электролит WiS имеет концентрацию до 31 м (9 м NaOTf – 22 м TEAOTf) и окно электрохимической стабилизации до 3,3 В (рис. 8a). A Na 1,88 Mn [Fe (CN) 6 ] 0,97 · 1,35H 2 O // IC-WiS на основе Na // NaTiOPO 4 Полная батарея с высоким напряжением отсечки (2,5 В) и была установлена высокая плотность энергии 71 Вт · ч кг -1 , которая показала выдающуюся стабильность при циклировании как на низких, так и на высоких скоростях (рис. 8b – e).
Фиг.8a Окно электрохимической стабильности 9 моль кг −1 Электролиты NaOTf и электролиты Na IC-WiS (9 м NaOTf + 22 м TEAOTf) при скорости сканирования 10 мВ с −1 , в которой Ti и Al используются как положительный и отрицательный коллекторы соответственно. b Кривые заряда-разряда первого цикла для положительных электродов NaMnHCF (1 C) и отрицательных электродов NaTiOPO 4 (0,2 C) в электролитах 9 m NaOTf и 9 m NaOTf + 22 mTEAOTf, соответственно. c CV-кривые отрицательных электродов NaTiOPO 4 и положительных электродов NaMnHCF при 1 мВ с -1 в 22 м TEAOTf и 9 м NaOTf + 22 м TEAOTf, соответственно. d Зарядно-разрядные кривые NaMnHCF // NaTiOPO 4 аккумуляторов в первом, четвертом и десятом циклах. e Циклические характеристики батареи NaMnHCF // NaTiOPO 4 при 1 ° C [55]. Воспроизведено с разрешения Ref. [55]. Copyright 2019, Wiley – VCH
Теоретические расчеты показали, что нанесение пленки Al 2 O 3 на Al или пленки TiO 2 на Ti может увеличить энергетический барьер расщепления воды (рис.9а) [56]. При толщине около 3 нм и 5 нм соответственно для пленок Al 2 O 3 и TiO 2 окно электрохимической стабильности расширяется до 3,5 В, когда металлы, покрытые этими оксидными пленками, используются в качестве коллекторы и 15 м водный раствор NaClO 4 используется в качестве электролита (рис. 13б). Кроме того, в концентрированных электролитах (15 м NaClO 4 ) на поверхностях TiS 2 образуется плотная межфазная фаза электрод – электролит.Таким образом, TiS 2 , обладающий низким реакционным потенциалом, был впервые продемонстрирован в качестве материала отрицательного электрода в водной батарее (рис. 9c). Полученный в результате ASIB с использованием TiS 2 в качестве отрицательного электрода и MFCN (гексацианоферрат натрия-марганца) в качестве положительного электрода обеспечивает плотность энергии 100 Вт · ч кг -1 с напряжением холостого хода (OCV) до 2,6 В и составляет работал с почти 100% кулоновской эффективностью до 1000 циклов (рис. 9d).
Фиг.9a Окно электрохимической стабильности 15 м NaClO 4 водный раствор, когда используются Pt, Ti, Al, покрытые Al 2 O 3 с разной толщиной и Ti с покрытием TiO 2 с разной толщиной как токоприемники. b Энергия адсорбции O * и HO * на поверхности Ti или TiO 2 и H 2 O * и H * на поверхности Al или Al 2 O 3 соответственно. c CV-кривая TiS 2 отрицательных электродов при использовании алюминиевой фольги с регулируемым временем термообработки в качестве токоприемников. d Циклические характеристики батарей TiS 2 / MFCN при 5 ° C [56]. Воспроизведено с разрешения Ref. [56]. Copyright 2019, Elsevier BV
Zn – Na Hybrid Batteries
Поскольку натриевые соли дешевле солей лития, водные Zn – Na гибридные ионные аккумуляторы представляют собой очень многообещающую перспективу для замены водных Zn – Li гибридных аккумуляторов и стали привлекательными устойчивое устройство хранения энергии. Первый водный гибридный ионный аккумулятор Zn – Na был зарегистрирован нашей группой и состоял из стержнеобразного Na 0.95 MnO 2 материал положительного электрода и металлический отрицательный электрод из цинка, которые показали среднее напряжение разряда 1,4 В и плотность энергии до 78 Втч кг -1 (рис. 10a, b) [57].
Рис.10a CV-кривые Zn и Na 0,95 MnO 2 в 0,5 M Zn (CH 3 COO) 2 + 0,5 M CH 3 Водный раствор COONa (0,5 мВ с −1 ). b Циклические характеристики Zn // Na 0.95 MnO 2 ASIB при скорости 4 ° C [56]. Воспроизведено с разрешения Ref. [57]. Авторское право 2014 г., Королевское химическое общество. c CV-кривая Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (5 мВ с −1 ). d Кривые заряда / разряда Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (0,5 C) [59]. Воспроизведено с разрешения Ref. [59]. Copyright 2017, Королевское химическое общество
Na + -ионный суперионный проводник (NASICON) -структурированный Na 3 V 2 (PO 4 ) 3 (NVP) с высокой теоретической емкостью 118 мАч g -1 стал новым потенциальным кандидатом в качестве положительного электрода для водных Na-Zn-гибридных батарей.Гибридная батарея Zn-NVP может обеспечить удельную энергию 67 Вт · ч · кг -1 . Однако емкость Na 3 В 2 (PO 4 ) 3 в Zn-Na гибридных водных перезаряжаемых батареях остается серьезной проблемой. Помимо материалов положительного электрода NVP / C, другие полианионные соединения [такие как покрытый углеродом Na 3 V 2 (PO 4 ) 2 F 3 ] были рассмотрены в качестве положительных электродов для дальнейшего улучшения напряжение водных гибридных аккумуляторов Na – Zn [58].Гибридный Zn – Na 3 V 2 O 2 x (PO 4 ) 2 F 3−2 x аккумулятор обладает высоким выходным напряжением 1,7 В и высокой энергией. плотность 84 Втч кг −1 .
берлинская лазурь и ее аналоги являются наиболее привлекательными материалами для гибридных батарей на водной основе из-за их большого канала и структуры открытого каркаса, которая способствует быстрой диффузии ионов. Рабочее напряжение гибридных аккумуляторов Na-Zn на водной основе высокое, и на срок службы аккумулятора в значительной степени влияет побочная реакция выделения водорода или выделения кислорода.Было обнаружено, что окно электрохимической стабильности электролита может быть увеличено с 1,8 до 2,55 В путем добавления поверхностно-активных веществ в смешанный электролит (рис. 10а, б) [59]. С помощью моделирования теории функционала плотности было обнаружено, что энергетический барьер молекул воды, проходящих через адсорбционный слой SDS, выше, чем барьер ионов натрия, проходящих через адсорбционный слой SDS. Ионы натрия легче проходят через гидрофобный слой, чем молекулы воды, тем самым подавляя разложение воды, тем самым улучшая окно электрохимической стабильности электролита.На основе этого электролита была успешно собрана водная перезаряжаемая ионно-цинково-ионная батарея на водной основе с нанокубами Na 2 MnFe (CN) 6 в качестве катодов и листами цинка в качестве отрицательных электродов. Аккумулятор имеет рабочее напряжение до 2 В и высокую удельную энергию 170 Втч кг -1 (рис. 10c, d). Стратегия проектирования улучшения окна электрохимической стабильности электролитов путем добавления добавок обеспечивает эффективность, близкую к эффективности электролитов WiS, и низкую стоимость.Он обеспечивает новое понимание для дальнейшего развития недорогих и высоковольтных аккумуляторных батарей на водной основе.
Водные K-ионные батареи (AKIB)
Высокий потенциал ионизации и большой ионный радиус (0,138 нм) K являются основными причинами ограниченного развития высокоэффективных электродных материалов AKIB. На сегодняшний день наиболее перспективными материалами положительных электродов для AKIB являются аналоги берлинской голубой (PBA).
Среди различных материалов положительных электродов PBA имеет широкую перспективу применения благодаря своей стабильности в воде, простоте приготовления и отличным электрохимическим характеристикам.Сообщалось о множестве положительных электродов из ПБА в AKIB, но лишь немногие материалы обладают полностью удовлетворительными свойствами. Из-за отсутствия материалов-кандидатов с подходящими окислительно-восстановительными потенциалами, несколько многообещающих материалов были описаны в качестве материала отрицательного электрода AKIB. Ранее сообщалось, что электролит WiS на основе ацетата калия имеет широкий диапазон электрохимической стабильности, но pH электролита является слабощелочным (pH = 9), что не подходит для материалов положительных электродов.Поэтому очень важно изучить новый тип электродов с лучшей совместимостью с электролитом WiS на основе K + . В целом, из-за ограничений электродов и электролитов сообщений о разнообразии AKIB немного. Недавно был изготовлен полный AKIB, который состоял из Fe-замещенного Mn-богатого PBA {K x Fe y Mn 1− y [Fe (CN) 6 ] w · z H 2 O} положительный электрод, отрицательный электрод из органического 3,4,9,10-перилентетракарбоновой диимида (PTCDI) и 22 м KCF 3 SO 3 WiS электролит [60].22-метровый электролит KCF 3 SO 3 WiS имеет широкий диапазон напряжений 3 В, который не только препятствует растворению как положительных, так и отрицательных электродов во время цикла, обеспечивая хорошую циклическую стабильность всей батареи, но также позволяет полная батарея должна работать при напряжении выше 2 В при низком токе 0,1 C (рис. 11a). Кроме того, как положительный, так и отрицательный электроды обладают высокой емкостью, высокими скоростными характеристиками и хорошей стабильностью при переключении. Таким образом, полная батарея обеспечивает высокую плотность энергии 80 Вт · ч · кг -1 и отличную стабильность при циклической работе с сохранением емкости 73% за 2000 циклов при 4 ° C (рис.11б). Несмотря на то, что эта аккумуляторная система имеет много преимуществ, есть еще много областей, требующих дальнейшего улучшения для содействия ее практическому применению. Прежде всего, для электродных материалов, хотя Fe является лучшим выбором для замены положительного электрода PBA, богатого Mn, материалы отрицательного электрода должны быть оптимизированы с высокой емкостью и низким окислительно-восстановительным потенциалом для дальнейшего увеличения плотности энергии AKIB. Кроме того, чтобы снизить стоимость всей батареи и в то же время для обеспечения ее превосходных мощных характеристик и высокого рабочего напряжения, следует изучить менее дорогие соли с высокой растворимостью, такие как снижение концентрации электролита путем изменения интерфейса и использования смешанные вода / неводные растворители.
Рис. 11a Окно электрохимической стабильности 1 м и 22 м KCF 3 SO 3 электролитов при скорости сканирования 10 мВ с -1 при использовании Ti-сетки в качестве токосъемника. b Циклические характеристики PTCDI / K x Fe y Mn 1− y [Fe (CN) 6 ] w · z H 2 O полные ячейки при 4 ° C. Воспроизведено с разрешения Ref.{+} \) ионный аккумулятор был описан Ву и его коллегами в 2017 году с (NH 4 ) 1,47 Ni [Fe (CN) 6 ] 0,88 в качестве положительного электрода и PTCDI (3,4 , 9,10-перилентетракарбоновый диимид) в качестве отрицательного электрода (рис. 12) [61]. Эта батарея имела среднее рабочее напряжение всего 1,0 В и низкую плотность энергии 43 Вт · ч · кг -1 . Водно-аммониевый двухионный аккумулятор с максимальным рабочим напряжением 1,9 В и высокой плотностью энергии 51,3 Вт · ч. Кг -1 был построен с использованием электродов из органического полимера [62].{+} \) положительные электроды имеют более высокий окислительно-восстановительный потенциал.
Рис. 12a Принципиальная схема работы водных NH 4 + ионных батарей на основе положительных электродов Prussian White и отрицательных электродов PTCDI. b Зарядно-разрядные кривые водного NH 4 + -ионный аккумулятор в первом, втором, пятом и десятом циклах (60 мА g −1 ). c Циклические характеристики при скорости 3 C [61].Воспроизведено с разрешения Ref. [61]. Авторское право 2017, Wiley – VCH. d Окно электрохимической стабильности 1 M и 25 m AmAc электролитов (1 мВ с -1 ). e Циклические характеристики TiO 1,85 (OH) 0,30 · 0,28H 2 O-электрод в 25 м AmAc (1 А г −1 ) [63]. Воспроизведено с разрешения Ref. [63]. Авторское право 2017, Wiley – VCH. (е) ЦВА электродов из Zn и Na-FeHCF в водном растворе 1 M (NH 4 ) 2 SO 4 + 20 мМ ZnSO 4 при скорости сканирования 3 мВ с −1 . г Кривые заряда-разряда гибридных аккумуляторов Zn / Na-FeHCF. Воспроизведено с разрешения Ref. [64]. Авторское право 2019, John Wiley and Sons. ч Кривые заряда-разряда при различных плотностях тока и циклические характеристики i гибридных аккумуляторов Zn / CuHCF при плотности тока 1800 мА г −1 . Воспроизведено с разрешения Ref. [65]. Авторское право 2019 г., Американское химическое общество
Как и в случае с ARLB, электролиты WiS могут использоваться для расширения диапазона напряжений.Недавно новый электролит WiS (25 м CH 3 COONH 4 ) был использован в AAIB, который имеет окно потенциала 2,95 В (рис. 12d) [63]. Аморфная титановая кислота [TiO 1,85 (OH) 0,30 · 0,28H 2 O] применялась в качестве отрицательных электродов с относительно отрицательным окислительно-восстановительным потенциалом и обратимой емкостью 70 мАч г -1 . {+} \) также является эффективным способом увеличения плотности энергии AAIB [64, 65].Наша группа первой сообщила о водной перезаряжаемой гибридной аммонийно-цинковой батарее (ARAHB), содержащей высокопрочный гексацианоферрат натрия и железа NaFe III Fe II (CN) 6 (Na-FeHCF) положительный электрод нанокуба и низко- недорогой цинковый отрицательный электрод, с рабочим напряжением 1,3 В и высокой плотностью энергии 81,7 Вт · ч. кг −1 (в расчете на общую массу активных материалов) (рис. 12f, g). Затем мы дополнительно увеличили плотность энергии ARAHB до 114 Вт · ч · кг -1 , используя наночастицы CuHCF в качестве материала положительного электрода (рис.12h, i).
Водные Zn-ионные батареи (AZIB)
Цинк является наиболее идеальным материалом для отрицательных электродов для водных аккумуляторов из-за его низкого окислительно-восстановительного потенциала (- 0,76 В по сравнению с SHE), высокой удельной емкости (820 мАч изб. −1 ) , богатые запасы и нетоксичные свойства. Он широко используется в качестве отрицательных электродов в щелочных батареях на основе цинка (таких как щелочные цинк-MnO 2 батареи [66], цинк-никелевые батареи [67, 68] и Zn // Co 3 O 4 батареи [69, 70], воздушно-цинковые батареи [71, 72], ионно-цинковые батареи и гибридные цинковые батареи.В последнее время было много обзоров по этим аспектам, поэтому мы не будем подробно останавливаться на них с точки зрения электродных материалов [73,74,75,76,77,78,79,80,81,82,83,84,85 , 86]. Здесь мы подводим итоги последних достижений в области цинковых батарей с высоким напряжением и высокой плотностью энергии. В Таблице 3 и на Рисунке 13 представлены подробные данные о показателях работы АЗИБ на сегодняшний день.
Таблица 3 Электрохимические свойства различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии Рис.13Плотность энергии и средняя разрядная емкость различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии
Zn – MnO 2 Батареи на основе водных электролитов на основе слабой соли цинка в настоящее время являются важной темой исследований [87, 88,89]. Несмотря на значительный прогресс, механизм реакции хранения Zn 2+ в материалах на основе Mn остается спорным. Предыдущий обзор суммировал три механизма накопления заряда [73]: (а) обратимое введение / извлечение ионов Zn в объемных материалах; (б) обратимые протонные реакции, сопровождающиеся отложением сульфата гидроксида цинка; и (c) H + и Zn 2+ , последовательно внедряемые / удаляемые на разных стадиях заряда-разряда.Основываясь на этих механизмах (рис. 14a), батарея Zn – MnO 2 использует только емкость и напряжение, обеспечиваемые окислительно-восстановительной реакцией пары Mn 4+ / Mn 3+ , ограничивая емкость батареи и выходную мощность. Напряжение. Это выдвигает новые требования к электрохимии цинка и марганца. Поскольку ион Mn поливалентен (+2, +3 и +4), двухэлектронная реакция Mn 4+ / Mn 2+ емкостью 616 мА г −1 и платформа более высокого напряжения можно постулировать.Недавно был предложен новый механизм, который включает обратимое осаждение / растворение Mn 2+ / MnO 2 , химическое превращение (между MnO 2 и MnOOH) и введение Zn 2+ [90]. На основе уникальной двухэлектронной окислительно-восстановительной реакции Mn 4+ / Mn 2+ была собрана высоковольтная электролитическая цинково-марганцевая батарея с высоким разрядным плато 1,95 В и высокой плотностью энергии 409 Вт · ч · кг. −1 , а также отличные характеристики при циклировании (сохранение емкости 92% после 1800 циклов) (рис.14б, в).
Рис. 14a Схема трехступенчатых процессов гальваностатического разряда. b Кривые гальваностатического разряда. c Циклические характеристики при 30 мА см −2 . Электролитические ячейки Zn – MnO 2 заряжаются при постоянном напряжении 2,2 В (по сравнению с Zn / Zn 2+ ) [91]. Воспроизведено с разрешения Ref. [91]. Авторское право 2017 г., Американское химическое общество)
Чтобы еще больше увеличить напряжение и удельную энергию Zn-MnO 2 батареи, мы можем использовать гибридный электролит с разными значениями pH, например щелочно-нейтральные электролиты и щелочно-кислотные электролиты.Недавно наша группа сообщила о батарее Zn // MnO 2 с щелочным (1 M NaOH и 0,01 M Zn (Ac) 2 ) -нейтральным (2 M ZnSO 4 + 0,1 M MnSO 4 ) гибридом. электролит и мембрана Na + –Nafion от DKJ Co. Ltd. Принцип ее работы показан на рис. 15а. Использование Zn / Zn (OH) 2− 4 Отрицательный электрод в щелочном растворе, который имеет относительно низкий окислительно-восстановительный потенциал, напряжение аккумулятора сильно увеличивается.Аккумулятор в сборе имеет среднее плато разрядного напряжения 1,7 В и удельную энергию 487 Вт · ч · кг −1 [92]. Кроме того, за счет объединения двух окислительно-восстановительных реакций электрода растворения / осаждения MnO 2 / Mn 2+ и Zn / Zn (OH) 2− 4 с использованием двойных кислотно-щелочных электролитов и ионоселективной мембраны была сконструирована высокоэнергетическая батарея Zn-MnO 2 [93]. Рабочий механизм показан на рис. 15б.При зарядке Zn (OH) 2− 4 восстанавливается до Zn, а Mn 2+ окисляется до MnO 2 . В то же время катионы (K + ) и анионы (SO 4 2-), хранящиеся в BPM, возвращаются к положительному и отрицательному электродам соответственно, достигая баланса заряда. В процессе разряда эти два процесса развиваются в противоположном направлении. Батарея Zn – Mn 2+ имела высокое рабочее напряжение 2.44 В, высокий кулоновский КПД 98,4% и сохранение разрядной емкости 97,5% после 1500 циклов. В частности, его удельная энергия чрезвычайно высока (≈ 1503 Вт · ч · кг -1 , рассчитана на основе материала положительного электрода), что является самым высоким показателем среди всех водных аккумуляторов на основе цинка, о которых сообщалось до сих пор, и даже сопоставимо с таковыми из Zn- воздушные батареи.
Рис. 15a Принципиальная схема разработанной водной цинково-марганцевой батареи [92]. Воспроизведено с разрешения [92].Авторское право 2020, Американское химическое общество. b Принципиальная схема и механизм Zn – MnO 2 аккумулятора, использующего двойной кислотно-щелочной электролит в условиях заряда и разряда. [93] Воспроизведено с разрешения Ref. [93]. Copyright 2020, Wiley – VCH
PBAимеют трехмерный открытый каркас и большую щелевую структуру и считаются обратимыми материалами-хозяевами интеркаляции / деинтеркаляции Zn 2+ с быстрой зарядкой и разрядкой, высоким рабочим потенциалом и идеальным электрохимические свойства.В материалах электродов PBA обычно только один ион переходного металла (в большинстве случаев железа) считается электрохимически активным в системе водного электролита, что приводит к его ограниченной удельной емкости в водном растворе Zn 2+ (≈ 60 мАч г −1 ), тогда как в большинстве случаев напряжение низкое (~ 1,2 В Zn / Zn 2+ ) и, следовательно, удельная энергия батареи мала. Недавно был разработан новый вид кубиков Co / Fe PBA (гексацианоферрат кобальта, CoFe (CN) 6 ), в которых ожидается, что ионы Co и Fe будут эффективно участвовать в процессе двухэлектронного накопления энергии, что приведет к усилению удельной емкости [94].Как проиллюстрировано на фиг. 16a, вакансии, образовавшиеся в результате извлечения ионов K из каркаса CoFe (CN) 6 , имеют тенденцию отдавать предпочтение интеркаляции Zn 2+ . Интеркаляция / деинтеркаляция Zn 2+ требует двух стадий из-за разной энергии активации активных пар Co (III) / Co (II) и Fe (III) / Fe (II), что подтверждается кривыми CV (рис. . 16b). Собранная батарея Zn / CoFe (CN) 6 не только имела отличную скорость и циклические характеристики, но также работала на плато 1.75 В (рис. 16c) и показала плотность энергии 250 Вт · ч · кг -1 .
Рис. 16a Принципиальная схема обратимой интеркаляции / деинтеркаляции Zn 2+ в каркасе CoFe (CN) 6 во время процессов зарядки и разрядки. b Первые три цикла кривых CV (1 мВ с -1 ). c Кривые постоянного тока заряда-разряда при различных плотностях тока [94]. Воспроизведено с разрешения Ref. [94]. Авторское право 2019, Wiley – VCH. d Принципиальная диаграмма взаимосвязи между энергией и плотностью состояний (DOS) в Co 0,247 V 2 O 5 · 0,944H 2 O и V 2 O 5 · n H 2 O положительные электроды. Воспроизведено с разрешения Ref. [102]. Copyright 2019, Wiley – VCH
Оксиды на основе ванадия, которые обладают несколькими степенями окисления и высокой емкостью (> 300 мАч g −1 ), широко используются в качестве материалов положительных электродов для водных цинк-ионных аккумуляторов.Существуют различные оксиды на основе ванадия, которые обеспечивают значительную емкость и отличную циклическую стабильность, которые интенсивно изучаются, такие как V 2 O 5 · n H 2 O [95], NaV 3 O 8 · 1,5H 2 O [96], Ca 0,24 V 2 O 5 · 0,83H 2 O [97], H 2 V 3 O 8 [98, 99], K 2 V 6 O 16 · 2,7H 2 O [100] и ванадат алюминия [101].Однако неприятным аспектом является то, что 80% их емкости находится ниже 1,0 В, что приводит к низкой плотности энергии (<250 Вт · ч кг -1 ), что резко контрастирует с их большой емкостью. Чжи и его коллеги сообщили о цинково-ионной батарее на основе положительного электрода с нанолентой Co 0,247 V 2 O 5 · 0,944H 2 O, обеспечивающего 52,5% общей емкости свыше 1,0 В и, следовательно, была получена высокая плотность энергии 432 Вт · ч кг −1 [102].Результаты показывают, что большая емкость Co 0,247 V 2 O 5 · 0,944H 2 O обусловлена его более высокой адсорбционной способностью для Zn 2+ , а высокое напряжение аккумулятора в основном из-за взаимодействия между орбиталями Co 3d и V 3d , которое перемещает относительный окислительно-восстановительный потенциал пары V 5+ / V 4+ на более высокий уровень (рис. 16d).
Материалы типа NASICON имеют большие каналы и способность к быстрой диффузии ионов и очень привлекательны в качестве узлов хранения Zn 2+ -ion.Na 3 В 2 (PO 4 ) 3 был зарегистрирован как положительный электрод водной Zn-ионной батареи, с напряжением 1,1 В, емкостью 97,5 мАч g −1 , но неадекватной цикличностью (сохранение емкости 74%) после 100 циклов) [103]. Недавно сообщалось о другом материале типа NASICON, Na 3 V 2 (PO 4 ) 2 F 3 , в качестве высоковольтного положительного электрода (более 1,6 В) для ионно-цинкового сплава. аккумулятор, с окислительно-восстановительным потенциалом 0.На 5 В выше, чем у Na 3 В 2 (PO 4 ) 3 [104]. Цинк-ионная батарея в сборе имеет высокий потенциал 1,62 В и высокую плотность энергии 97,5 Вт · ч кг -1 (рис. 17a). Что еще более важно, при плотности тока 1 А · г −1 цинк-ионная батарея показала очень стабильную циклическую работу, сохраняя 95% емкости в течение 4000 циклов (рис. 17b).
Рис.17a Кривые заряда-разряда первых трех циклов CFF-Zn // Na 3 V 2 (PO 4 ) 2 F 3 @C батареи ( 0.08 A г −1 ). b Циклические характеристики CFF-Zn (углеродная пленка, функционализирующая Zn) // Na 3 V 2 (PO 4 ) 2 F 3 батареи @C (1 A g −1 ) [104]. Воспроизведено с разрешения Ref. [104]. Copyright 2018, Elsevier BV Сравнение производительности Zn / Co (III) rich-Co 3 O 4 батарей в 1 M KOH и 2 M ZnSO 4 с 0,2 M CoSO 4 : a заряд-разряд кривые, b производительность первых 500 циклов (1 A g −1 ) [105].Воспроизведено с разрешения Ref. [105]. Авторское право 2018, Королевское химическое общество
Как правило, в цинково-кобальтовых батареях используется щелочной электролит, который демонстрирует плохую устойчивость к циклическим нагрузкам и вызывает загрязнение окружающей среды. Окислительно-восстановительная реакция между CoO и Co 3 O 4 была обнаружена в батарее Zn / Co 3 O 4 с мягким водным электролитом [105]. Слой CoO, сформированный в процессе разряда, показывает процесс преобразования вставки ионов H + в Co 3 O 4 .Батарея с высоким содержанием Zn / Co (III) Co 3 O 4 , использующая мягкий водный электролит, показала окно напряжения около 2,2 В (рис. 17c, d), что намного шире, чем у батареи с щелочными электролитами ( около 1,9 В).
Водные магниево-ионные батареи (AMIB)
Магниево-ионные батареи постепенно становятся еще одной популярной областью исследований, поскольку ресурсы Земли богаты магнием, который является недорогим и пригодным для разработки устройств хранения энергии.Ион магния похож на ион лития. Однако основные проблемы, связанные с неводными перезаряжаемыми Mg-ионными батареями, препятствуют их развитию: (а) их электролит чувствителен к воде и имеет сложные химические свойства; (б) отсутствие высокоэффективных электродных материалов также ограничивает практическую применимость Mg-батарей из-за медленной диффузии Mg 2+ в твердых телах. Напротив, водные магниево-ионные батареи (AMIB) имеют много преимуществ, таких как низкая стоимость, отсутствие коррозии, хорошая безопасность и хорошая проводимость.Однако из-за отсутствия подходящих материалов для отрицательного и положительного электрода, большинство заявленных электродных материалов для AMIB оценивались только на полуэлементной установке. Ограниченные окном стабильности напряжения традиционных водных электролитов (1,23 В), напряжение и плотность энергии AMIB также очень ограничены [106]. Общеизвестно, что Mg трудно обратимо осаждать и отделять в водном растворе, поскольку Mg является активным металлом и имеет низкий окислительно-восстановительный потенциал (-2,37 В противОНА). Недавние исследования показали, что обратимое осаждение / удаление металлического магния в электролите, содержащем H 2 O, возможно путем введения искусственной твердой поверхности раздела. Наша группа сообщила о гибридной батарее Mg / LiFePO 4 , в которой реактив Гриньяра на основе магния применялся в качестве отрицательного электрода для неводного электролита, а LISICON служил в качестве комбинированного сепаратора / твердого электролита. Эта гибридная батарея продемонстрировала среднее напряжение разряда 2,1 В, стабильное плато разряда и хорошие циклические характеристики (рис.18а – в) [107].
Рис. 18a Схематическое изображение водной батареи Mg / LiFePO 4 . b Кривая заряда – разряда первого цикла (50 мАч g –1 , 1,7–3,4 В). c Циклические характеристики (50 мАч g −1 , 1,7–3,4 В) [107]. Воспроизведено с разрешения Ref. [107]. Авторские права 2015, Издательская группа Nature. d Сравнение циклических характеристик Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 дюйм 0.5 M Mg (TFSI) 2 / PC электролиты без / с водой. e Кривые заряда-разряда для Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 в 0,5 M Mg (TFSI) 2 / PC + 3 MH 2 электролита O (0,5–2,5 В, 29,4 мА г –1 ). Воспроизведено с разрешения Ref. [108]. Copyright 2018, Nature Publishing Group
Недавно путем термоциклирования полиакрилонитрила и Mg (OTf) 2 была синтезирована искусственная проводящая межфазная фаза Mg 2+ на поверхности отрицательного электрода из Mg.Искусственная межфазная фаза позволила осуществить обратимое циклирование полной ячейки Mg / V 2 O 5 в водосодержащем электролите на основе карбоната (рис. 18d, e) [108]. В таблице 3 и на рис. 18 приведены подробные сведения о показателях AMIB, о которых сообщалось на сегодняшний день.
Водные Ca-ионные батареи (ACIB)
Химические свойства Ca 2+ очень похожи на свойства Mg 2+ . Хотя радиус катиона Ca 2+ (0,100 нм) больше, чем у Li + (0.076 нм) и катионов Mg 2+ (0,072 нм), его окислительно-восстановительный потенциал низкий (–2,87 В по сравнению с SHE), богат запасами и низкая плотность ионного заряда, что делает его альтернативным анодным материалом для пост-Li- ионные батареи. ACIB также является потенциальной электрохимической системой. Известно немного материалов электродов с интеркаляцией кальция, в основном из-за медленной диффузии Ca 2+ . В настоящее время немногочисленные материалы положительных электродов для ACIB, о которых сообщается, в основном представляют собой PBA [включая NiHCF [109], K 2 BaFe (CN) 6 [110] и CuHCF [111]]), а упомянутые отрицательные материалы в основном являются органическими. электродные материалы, такие как PNDIE {поли- [N, N ‘- (этан-1,2-диил) -1,4,5,8-нафталинтетракарбоксиимид]} [112].
До сих пор сообщалось только об одном ACIB, состоящем из отрицательного электрода PNDIE и PBA, гексацианоферрата меди {CuHCF, K 0,02 Cu [Fe (Cu) 6 ] 0,66 · 3,7H 2 O }, в качестве положительного электрода и водный раствор Ca (NO 3 ) 2 в качестве электролита (рис. 19) [112]. Полная батарея продемонстрировала удельную емкость 40 мАч g −1 при 1 ° C (1 C = 40 мАч g −1 ) со средним рабочим напряжением 1,24 В, что соответствует плотности энергии 54 Втч кг — 1 , и сохранение емкости 88% с почти 100% кулоновским КПД после 1000 циклов при 10 ° C.
Рис. 19a Принципиальная схема зарядки и разрядки водной перезаряжаемой ионно-кальциевой батареи (PNDIE // Ca 0,3 CuHCF). b CV-кривые электродов и электрохимическая стабильность электролита [2,5 M Ca (NO 3 ) 2 , 1 мВ с -1 ]. c Напряжение-время для аккумуляторов PNDIE // Ca 0.3 CuHCF (450 мАч g −1 ). d Циклические характеристики PNDIE // Ca 0.3 батареи CuHCF (400 мАч g −1 ). Воспроизведено с разрешения Ref. [112]. Copyright 2017, Wiley – VCH
Водные алюминиево-ионные батареи (AAIB)
Алюминий обладает высокой удельной объемной емкостью (8046 мАч см −3 ) и высокой гравиметрической емкостью (2980 мАч g −1 ), что составляет сравним с металлическим литием, имеет высокое содержание (около 8 мас.% земной коры) и является самым дешевым в производстве, за исключением железа. Кроме того, металлический алюминий имеет лучшую стабильность на воздухе, чем литий, что снижает потенциальные риски для безопасности, а также является экологически чистым.Введение ионных жидкостей при комнатной температуре (RTIL) с широким электрохимическим окном стабильности улучшило обратимость процесса удаления / нанесения покрытия из Al — прорыв, открывший жизнеспособный путь для перезаряжаемых алюминиево-ионных батарей (AIB) [113, 114, 115]. В последние годы успешное приготовление новых электролитов и лучшее понимание природы SEI привело к разработке AAIB [116, 117]. Многие исследователи исследовали новые электродные материалы для AAIB, такие как TiO 2 [118,119,120,121], MoO 3 [122, 123], WO 3 [124], FeVO 4 [125] и PBA [126,127,128]). , и некоторые обзоры всесторонне резюмировали эту работу [129,130,131,132].Поэтому мы обсудим этот аспект только кратко и сосредоточимся на недавнем прогрессе в исследованиях высокоэнергетических перезаряжаемых AAIB на основе металлического алюминия. В таблице 3 представлены подробные сведения о производительности AAIB, о которых сообщалось на сегодняшний день.
Использование алюминия в качестве отрицательного электрода AAIB — захватывающий прорыв. 5 м водный раствор трифторметансульфоната алюминия [Al (OTf) 3 ] описан как электролит с потенциальным окном от — 0,3 до 3,3 В (по сравнению с Al 3+ / Al) и способностью получать обратимое осаждение / удаление алюминий (рис.20) [116]. На основе этого электролита был собран AAIB с металлическим отрицательным электродом из Al и положительным электродом из Al x MnO 2 · n H 2 O, который имел средний потенциал (1,1 В) и выдающаяся плотность энергии 481 Втч кг −1 [117].
Рис.20a Окно электрохимической стабильности 5 м водного раствора Al (OTF) 3 (стеклоуглерод, 10 мВ с −1 ). b Кривая постоянного тока для заряда-разряда симметричного элемента Al – Al (5 м Al (OTF) 3 ). c Кривая заряда-разряда первых пяти циклов батареи Al-MnO 2 . d Циклические характеристики батареи Al – MnO 2 . Воспроизведено с разрешения Ref. [117], Copyright 2019 Nature Publishing Group
Хорошо известно, что пассивирующий слой Al 2 O 3 быстро и необратимо образуется на поверхности металлического Al в воздухе, что препятствует усилиям по превращению воды в воду с высокой степенью обратимости. электрохимические ячейки на основе алюминия.Недавно сообщалось, что обогащенная ионной жидкостью (ИЖ) граница раздела на поверхности Al может быть получена путем погружения Al в кислый электролит ИЖ, состоящий из AlCl 3 — [EMIm] Cl, на более чем 1 день, что привело к коррозии пассивирующая пленка Al 2 O 3 и предотвратила ее последующее образование [117]. Кроме того, этот вид интерфейса является постоянным и способствует миграции Al 3+ . Используя этот искусственный SEI, была создана водная батарея T – Al (обработанный IL Al анод) // MnO 2 с использованием водного Al (CF 3 SO 3 ) 3 электролитов, которые могли быть переработан и не показал значительного выделения водорода.Этот AAIB показал среднее напряжение 1,37 В и напряжение плато 1,40 В, обеспечивая удельную энергию около 500 Вт · ч · кг -1 (рис. 21). Производительность была дополнительно улучшена за счет предварительного добавления 0,5 м MnSO 4 в водный электролит Al (OTf) 3 , который аналогичен батарее Zn / MnO 2 , где соль Mn 2+ улучшает оба емкость и циклические характеристики электрода из оксида марганца [133]. Эта батарея T-Al / 0,5Mn / Bir-MnO 2 продемонстрировала замечательную плотность энергии (620 Вт · ч · кг -1 на основе массы MnO 2 бирнесситового типа) и высокую сохраняющуюся емкость.
Рис. 21СЭМ-изображение Al фольги (слева) и фольги T – Al (справа). b Кривая постоянного тока для заряда-разряда симметричных ячеек Al – Al и T – Al / T – Al [2 м Al (CF 3 SO 3 ) 3 ]. Воспроизведено с разрешения Ref. [116]. Авторское право 2018, AAAS. c Кривые гальваностатического разряда / заряда водных алюминиевых батарей [2 м Al (CF 3 SO 3 ) 3 , 100 мА г -1 ]. d Вторые кривые разряд-заряд при постоянном токе для Al / Bir-MnO 2 , T – Al / Bir-MnO 2 и T – Al / 0.Аккумуляторы 5Mn / Bir-MnO 2 (100 мАч г −1 ). e Циклические характеристики батарей T – Al / Bir-MnO 2 и T – Al / 0,5Mn / Bir-MnO 2 . Воспроизведено с разрешения Ref. [133]. Copyright 2019, Wiley – VCH
WiS водный AlCl 3 в качестве электролитов был применен для создания AAIB на основе металлического Al, состав которого смог снизить начальный потенциал реакции выделения водорода до прибл. –2,3 В (по сравнению с Ag / AgCl), что позволило Al 3+ осесть на алюминиевый отрицательный электрод и расширить окно электрохимической стабильности AAIB примерно до 4 В [134].На основе этого электролита была успешно собрана алюминиевая / графитовая батарея с высокой удельной емкостью до 165 мАч g −1 , превосходной стабильностью с сохранением емкости почти 99% и удельной энергией 220 Втч кг −1 . (Рис.22).
Рис. 22a Принципиальная схема алюминиево-графитовой батареи во время разряда. b Кривые постоянного тока заряда-разряда алюминиевых графитовых ячеек при различных плотностях тока. c Циклические характеристики алюминиевых графитовых батарей (500 мА г -1 ).Воспроизведено с разрешения Ref. [134]. Авторское право 2019, Королевское химическое общество
Из-за ограниченной растворимости Al (OTf) 3 в воде очень трудно получить аналогичный электролит WiS для AAIB. Однако другие хорошо растворимые соли, такие как LiTFSI, могут быть введены для образования электролитов WiS. Например, смешанный электролит, содержащий 1 м Al (OTf) 3 + 17 м LiTFSI + 0,02 м HCl, был использован для создания перезаряжаемой водной Al – S батареи [135]. В этом смешанном электролите сверхконцентрированный LiTFSI не только ингибировал гидролиз полисульфида на положительном электроде, но также уменьшал побочную реакцию выделения водорода на отрицательном электроде, в то время как добавка HCl предотвращала образование пассивирующего слоя на поверхности отрицательного электрода.Собранная батарея Al – S имела начальную емкость 1410 мАч г −1 (в расчете на массу серы) и сохраняла обратимую емкость 420 мАч г −1 после 30 циклов с приемлемой кулоновской эффективностью 97% ( Рис.23).
Рис. 23a Гальваностатические кривые заряда – разряда первых двух циклов Al ofAl (OTf) 3 + LiTFSI + HCl‖S / C (200 мА г −1 ). b Циклические характеристики батарей Al‖Al (OTf) 3 + LiTFSI + HCl‖S / C (200 мА г −1 ).Воспроизведено с разрешения Ref. [135]. Авторские права 2020, Королевское химическое общество
Пленки с высокоэффективными твердотельными электролитами для печати
ВВЕДЕНИЕ
Потребность в более безопасных перезаряжаемых батареях, в которых не используется легковоспламеняющийся жидкий органический электролит, побудила к разработке твердотельных электролитов (SSEs). ) ( 1 — 3 ), такие как оксинитрид фосфора лития (LiPON) ( 4 , 5 ) и керамические соединения на основе граната ( 5 — 7 ).Пленки SSE (<10 мкм) с высокой ионной проводимостью> 10 -4 См / см обычно необходимы для достижения высоких плотностей энергии и мощности. Однако современные методы производства таких SSE-пленок имеют серьезные проблемы. Например, процесс радиочастотного (RF) распыления в вакууме, используемый для нанесения LiPON на батареи, является непомерно дорогостоящим ( 8 — 10 ), что ограничивает его широкое применение. Аналогичным образом, другие методы на основе вакуума, используемые для изготовления различных керамических пленок SSE, такие как осаждение атомного слоя (ALD) ( 11 — 13 ), импульсное послойное осаждение (PLD) ( 14 , 15 ) и химическое осаждение из паровой фазы (CVD) ( 16 , 17 ) более трудоемко и менее масштабируемо по сравнению с процессом с рулона на рулон.Кроме того, керамические SSE, полученные этими методами, обычно демонстрируют низкую ионную проводимость от ~ 10 -8 до 10 -4 См / см ( 17 — 19 ) из-за осажденной аморфной структуры или высокой потери летучих ионов. (например, Ли и На).
Для устранения этих ограничений были разработаны более экономичные и масштабируемые методы на основе решений для синтеза керамических пленок SSE (например, граната), но с ограниченным успехом из-за огромных проблем при спекании пленок электролита ( 11 , 20 , 21 ).В этих процессах SSE необходимо спекать при высоких температурах (от 600 до 1100 ° C) в течение нескольких часов, чтобы получить кристаллическую структуру, необходимую для высокой ионной проводимости. Однако длительное спекание также вызывает серьезные потери Li и Na и соответствующую низкую ионную проводимость из-за летучести этих легких элементов при высокой температуре ( 22 — 25 ). В результате керамические пленки SSE обычно демонстрируют либо плохую кристалличность, либо заметные потери лития с максимальной зарегистрированной ионной проводимостью ~ 10 -6 См / см ( 26 , 27 ).Снижение температуры обработки для предотвращения серьезных потерь Li ( 2 ) или добавление избыточного Li для компенсации ( 11 ) было обычной стратегией в традиционных методах осаждения керамической пленки. Однако это приводит к плохому контролю состава и потенциально пористой структуре. Кроме того, эти низкотемпературные спеченные SSE имеют аморфную структуру, что приводит к ограниченному улучшению проводимости до 2,9 × 10 −5 См / см ( 2 ), что далеко от объемного значения (~ 10 −3 См / см) ( 28 ).В то время как твердотельные пленочные батареи с низкой плотностью тока от 50 до 800 мкА / см 2 были успешно коммерциализированы в электронике ( 17 , 29 ), этот успех невозможно перенести на крупномасштабные приложения ( например, электромобили), для которых требуется плотность тока от 3 до 10 мА / см 2 ( 30 ). В результате существует постоянная потребность в масштабируемом методе синтеза керамических SSE с превосходным контролем состава и кристалличностью для достижения необходимой высокой ионной проводимости.
В этой работе мы разработали нелогичный подход к синтезу керамических пленок SSE непосредственно из прекурсоров, в котором мы значительно увеличиваем температуру спекания (до 1500 ° C), но только на короткий период времени (~ 3 с). Такой быстрый нагрев позволяет формировать плотную поликристаллическую пленочную структуру, но с незначительными потерями летучих элементов из-за короткого времени спекания. Мы называем этот метод «печатью и радиационным нагревом» (PRH), основанный на растворе и пригодный для печати метод синтеза керамических SSE-пленок.В типичном процессе пленка-предшественник печатается на подложке с толщиной, точно настроенной путем контроля концентрации чернил и толщины во влажном состоянии. Затем высушенная на воздухе пленка прекурсора помещается в тесный контакт с полосой радиационного нагрева (обычно ~ 1500 ° C) для быстрого спекания в непосредственной близости (рис. 1A). Эта нагретая Джоуля полоса проходит через исходную пленку с зазором ~ 0,5 мм и общей продолжительностью нагрева несколько секунд для завершения процесса спекания, что потенциально позволяет производить обработку рулонов.Рисунок 1B и фиг. S1 представляет собой типичную керамическую SSE-пленку, спеченную методом PRH, Li 6,5 La 3 Zr 1,5 Ta 0,5 O 12 (LLZTO) на монокристаллической подложке MgO, которая имеет полупрозрачную и плотную структуру с шероховатость поверхности <1 мкм (рис. 1С). Этот метод также не зависит от материала и позволяет спекать целый ряд высокоэффективных твердотельных пленок.
Рис. 1 PRH процесс синтеза пленки.( A ) Схема методики печати на пленке, в которой используются чернила-предшественник керамики и процесс быстрого спекания, при котором материал нагревается до высокой температуры (1500 ° C) в течение ~ 3 секунд.( B ) Спеченная пленка граната LLZTO на монокристаллической подложке MgO. ( C ) Соответствующая профилометрическая кривая спеченной пленки. Фото: Вэйвэй Пинг, Мэрилендский университет, Колледж-Парк.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для демонстрации метода PRH мы синтезировали керамическую пленку LLZTO SSE (подробности см. В дополнительных материалах). Вкратце, мы смешали порошок прекурсора (Li 2 CO 3 , La 2 O 3 , ZrO 2 и Ta 2 O 5 ) с помощью шаровой мельницы с последующим диспергированием в этаноле. путем обработки ультразвуком для приготовления чернил-прекурсоров (рис.2А). Чернила-предшественник LLZTO демонстрируют хорошую текучесть и смачиваемость на различных подложках (рис. 2B), таких как стекло, металлическая фольга и керамика, что позволяет создавать многофункциональные устройства. Кроме того, концентрация и вязкость чернил-предшественников могут быть изменены для адаптации к различным методам печати, таким как нанесение покрытия распылением и метод ракельного ножа. Мы использовали распылительное покрытие для нанесения краски-прекурсора, чтобы (i) достичь широкого диапазона толщин спеченных пленок LLZTO (от 1 до 100 мкм) и (ii) создать узорчатые пленки с использованием теневой маски, которая позволяет генерировать различные электролиты и электродные конструкции для изготовления будущих устройств (рис.2C и рис. S2). Для более толстых пленок без рисунка мы применили метод ракельного ножа для нанесения суспензии прекурсора на металлическую фольгу (30 см на 10 см) в окружающей среде (рис. 2D), создавая гладкую и однородную пленку (рис. 2Е и рис. S3).
Рис. 2 Оптимизация условий печати и спекания керамической пленки.( A ) Краска-предшественник SSE, полученная диспергированием предшественников смешанных оксидов (Li 2 CO 3 , La 2 O 3 , ZrO 2 и Ta 2 O 5 ) в этаноле.( B ) Чернила SSE обладают хорошей текучестью. ( C ) Печать чернил-предшественников граната путем нанесения покрытия распылением через маску. ( D ) Печать чернил-предшественников SSE методом ракельного ножа. ( E ) Пленка SSE с печатью масштабируема и гибка. ( F — H ) Схематическое изображение и морфология поперечного сечения пленок граната LLZTO, спеченных при различных температурах и времени, при которых необходима адекватная температура спекания с соответствующим временем спекания для получения плотной пленки граната с ограниченными потерями Li и однородными гранулометрический состав.Рентгенограммы пленок LLZTO, спеченных при температурах от ( I ) от 800 до 1300 ° C и времени выдержки от 1 до 180 с и при ( J ) от 1400 до 1700 ° C и времени выдержки от 1 до 10 с. а.е., условные единицы. Фото: Вэйвэй Пинг, Мэрилендский университет, Колледж-Парк.
В типичном процессе PRH мы быстро спекали напечатанную пленку-предшественник в атмосфере аргона, перемещая нагретую Джоуля углеродную полосу по образцу в течение ~ 3 с (рис. S4).Чтобы продемонстрировать большую пленку на металлических подложках, мы изготовили гибкую композитную пленку LLZTO / LiBO 2 на фольге из нержавеющей стали размером 5 см на 2 см (рис. S5, A и B). LiBO 2 [30 мас.% (Мас.%)] Был добавлен для снижения температуры спекания композитной пленки SSE, чтобы подложка из нержавеющей стали не плавилась. Поверхность пленки LLZTO / LiBO 2 оставалась конформной и плоской без каких-либо явных трещин или точечных отверстий при спекании, что демонстрирует превосходную однородность полученной большой пленки SSE (рис.S5, от C до E). Мы исследовали влияние температуры и времени спекания на полученные пленки LLZTO с помощью сканирующей электронной микроскопии (SEM) и дифракции рентгеновских лучей (XRD). При более низкой температуре спекания (~ 1000 ° C) полученная пленка имеет чистую фазу граната (рис. S6), но с пористой структурой даже при более продолжительном времени спекания, составляющем 10 с (рис. 2F). При более высокой температуре спекания (~ 1700 ° C) спеченная пленка показывает аномальный рост зерен (рис. 2H), значительную потерю Li (рис. S6) и побочную реакцию с подложкой (рис.S7), даже если время спекания ограничено всего 1 с. Однако мы обнаружили, что оптимизированное сочетание высокой температуры и короткого времени обработки (1500 ° C, 3 с) позволило получить плотную структуру граната с минимальными потерями Li и побочными реакциями (рис. 2G и рис. S6).
Чтобы лучше понять эволюцию пленки-предшественника LLZTO во время спекания PRH, мы спекали пленки при температурах от ~ 800 ° до 1700 ° C и временах от 1 до 180 с. Мы измерили дифрактограммы спеченных пленок, чтобы охарактеризовать потенциальные фазовые изменения, связанные с потерей лития (рис.2I). Согласно рентгенограммам, прекурсоры начинают реагировать и образовывать кубическую гранатовую фазу при низких температурах от 800 ° до 1000 ° C через ~ 30 с. Однако мы наблюдали, что низкотемпературные спеченные пленки оставались непрозрачно-белыми, что указывало на пористую структуру, что мы также подтвердили с помощью SEM (рис. S8). Пористая структура граната сохранялась даже при повышении температуры до ~ 1200 ° C и времени спекания до 180 с, где также наблюдалась небольшая потеря Li из-за появления небольшой частицы La 2 Zr 2 O 7 пик (рис.2I). Однако при повышении температуры до 1300-1500 ° C напечатанные пленки-предшественники стали прозрачными, что указывает на плотную структуру. При дальнейшем повышении температуры скорость испарения Li также быстро увеличивалась, о чем свидетельствует заметный фазовый переход до La 2 Zr 2 O 7 из-за значительных потерь Li (рис. 2, I и J). .
На основе дополнительных экспериментов по спеканию и рентгеноструктурных исследований мы построили диаграмму квазивремя-температура-превращение (TTT), чтобы определить оптимальные условия спекания, которые будут определять будущий синтез (рис.S9). На квази-TTT-диаграмме есть четыре основных участка, указывающих на различные плотности и фазы спеченных пленок LLZTO. Согласно диаграмме квази-ТТТ, спекание от 3 до 10 с при температуре от 1300 до 1500 ° C является предпочтительным для получения прочной пленки с минимальными потерями Li и плотной структурой. Когда температура спекания ниже 1200 ° C, требуется длительное время спекания для достижения плотной структуры пленки. Однако повышенные потери Li во время такого длительного спекания приведут к образованию фазы La 2 Zr 2 O 7 , особенно для пленок граната, из-за низкого исходного содержания Li и более коротких расстояний диффузии.Следовательно, температура и время спекания должны быть хорошо оптимизированы для получения плотной пленки SSE с чистой фазой граната и минимальными потерями Li.
Как показано на сканирующем электронном микроскопе в поперечном сечении (рис. 3A), высокая температура 1500 ° C может обеспечить достаточно энергии для спекания пленки LLZTO и получения однородной структуры без видимых пор (рис. S10, A и B). . Даже при толщине всего ~ 1,5 мкм пленка все еще имеет плотную структуру без явных точечных отверстий на изломанной поверхности (рис. S10C). Рентгенограмма пленки LLZTO также соответствует стандартной кубической фазе граната (PDF № 01-080-4947; рис.S10D), что указывает на минимальные потери Li. Кроме того, в традиционных методах спекания Al 2 O 3 может легко легироваться в SSE на основе граната в процессе спекания ( 31 , 32 ), что может повлиять на ионную проводимость и химическую стабильность SSE. Картирование поперечного сечения энергодисперсионной рентгеновской спектроскопии (EDS) PRH-спеченного LLZTO (рис. 3B) показывает четкую границу раздела с подложкой Al 2 O 3 , что подтверждает отсутствие очевидного кроссоверного легирования между LLZTO. пленка и подложка.Отсутствие перекрестного легирования дополнительно демонстрирует преимущество сочетания высокой температуры и короткого времени спекания, которое стало возможным благодаря технологии PRH. Кроме того, быстрый процесс спекания предотвращает аномальный рост зерен при высокой температуре, что демонстрируется равномерным распределением зерен по размерам (~ 1,6 ± 0,7 мкм) на изображениях СЭМ вида сверху (рис. 3, C и D).
Рис. 3 Характеристики пленки LLZTO, спеченной методом PRH.( A ) СЭМ-изображение поперечного сечения и ( B ) EDS-отображение спеченной пленки LLZTO на подложке из Al 2 O 3 .( C ) Морфология поверхности спеченной пленки LLZTO на подложке из Al 2 O 3 . ( D ) Статистика гранулометрического состава спеченной пленки LLZTO. ( E ) Энергия активации спеченной с помощью PRH пленки LLZTO, согласованная с соотношением Аррениуса. ( F ) Профили напряжения и тока симметричной ячейки Li / LLZTO / Li с плоскими Li-электродами для испытания критической плотности тока. ( G ) Сравнение потерь Li в пленках, спеченных PRH и традиционными методами.( H ) Сравнение ионной проводимости при комнатной температуре пленок SSE, синтезированных методом PRH и другими известными методами ( 2 , 8 , 9 , 11 , 35 — 41 ) .
Мы оценили ионную проводимость пленок граната LLZTO, спеченных методом PRH, с помощью спектроскопии электрохимического импеданса (EIS) в диапазоне температур от 30 ° до 140 ° C (рис. S11) с использованием плоских Li-электродов (рис. S12). Энергия активации переноса лития, соответствующая аррениусовскому поведению литий-ионной проводимости, составляла 0.34 эВ (рис. 3E), аналогично массивному гранату, в то время как ионная проводимость при комнатной температуре достигала ~ 1.0 × 10 −3 См / см, что сравнимо с проводимостью массивного граната ( 23 , 33 ). Мы также оценили критическую плотность тока пленки LLZTO, проводя осаждение / зачистку Li в плоскости пленки Li / LLZTO / симметричной ячейки Li. Симметричная ячейка подвергалась циклическому циклу при плотностях тока от 0,2 до 5 мА / см 2 с продолжительностью 10 мин (рис. 3F). Пленка LLZTO, спеченная с помощью PRH, показала плотность критического тока 5 мА / см 2 (рис.3F и рис. S12), что является одним из самых высоких заявленных значений даже для массивных гранатовых SSE ( 28 , 34 ). Чтобы лучше охарактеризовать устойчивость к циклированию пленки LLZTO, спеченной методом PRH, для симметричной ячейки Li / LLZTO пленка / Li также было проведено испытание на длительное циклирование (фиг. S13 и S14). Пленка Li / LLZTO / симметричная ячейка Li может успешно работать в течение более 140 часов при плотностях тока от 0,2 до 3 мА / см 2 , что свидетельствует о превосходной стабильности при циклировании пленки LLZTO, спеченной методом PRH.
Мы приписываем отличные электрохимические свойства пленок LLZTO, спеченных методом PRH, благодаря строгому контролю содержания Li, плотной морфологии и высокой кристалличности, которые достигаются во время чрезвычайно высокотемпературного и сверхбыстрого процесса спекания. Напротив, обычные процессы спекания обычно занимают часы при температуре> 1000 ° C, что приводит к значительным потерям Li. Это особенно верно для пленок (например, толщиной ~ 1 мкм) по сравнению с обычными толстыми гранулами (например, ~ 1000 мкм), поскольку количество Li намного ниже, а удельная площадь поверхности намного выше, что приводит к большим потерям Li. в обычных процессах спекания (рис.3G). Однако быстрая скорость метода PRH ограничивает потери Li в таких пленочных структурах, что позволяет нам получить пленку граната LLZTO, которая демонстрирует самую высокую ионную проводимость среди тонкопленочных SSE (рис. 3H) ( 2 , 8 , 9 , 11 , 35 — 41 ).
Метод спекания PRH основан на радиационном нагреве, который не зависит от материала и может применяться для спекания широкого диапазона составов. Чтобы продемонстрировать универсальность этой методики, мы успешно изготовили Li 0.3 La 0,567 TiO 3 (LLTO), Li 1,3 Al 0,3 Ti 1,7 (PO 4 ) 3 (LATP) и β-Al 2 O 3 пленки из растворов чернил-предшественников (рис. 4A), все из которых содержат летучие компоненты. LLTO, LATP и β-Al 2 O 3 — это высокоэффективные литий-ионные и Na-ионные проводники, пленки которых также сталкиваются с проблемой контроля потерь Li / Na во время синтеза ( 19 , 42 , 43 ).В нашем методе мы напечатали краски LLTO, LATP и β-Al 2 O 3 на подложке Al 2 O 3 путем нанесения покрытия распылением с последующим высокотемпературным (1500 ° C) спеканием. в течение ~ 3–5 с, что приводило к однородным и плотным пленкам толщиной от 5 до 10 мкм (рис. 4Б). Пленки LATP и LLTO спекались на воздухе, чтобы предотвратить возможное восстановление Ti 4+ . Как и в случае с пленкой LLZTO, в соответствии с картированием EDS не наблюдалось явного перекрестного легирования или побочных реакций между слоем SSE и подложкой (рис.4Б). Границы зерен спеченных пленок также хорошо сливались из-за эффекта плавления при высокой температуре спекания. Кроме того, из-за быстрого процесса спекания в течение 3 с потери Li / Na в SSE LATP, LLTO и β-Al 2 O 3 были минимизированы, что мы подтвердили с помощью чистых фаз на дифрактограммах ( рис. S15 — S17).
Рис. 4 Другие пленки SSE, спеченные на PRH.( A ) Печатные краски на основе прекурсоров LLTO, LATP, β-Al 2 O 3 и LiBO 2 -LLZTO.( B ) Слева: морфология поперечного сечения и результаты элементарного картирования пленок LLTO, LATP, β-Al 2 O 3 , спеченных с помощью PRH. Справа: Схема сравнения потерь летучих элементов между PRH и традиционными методами спекания. ( C ) Слева: морфология поперечного сечения и результаты картирования пленки LiBO 2 -LLZTO, спеченной методом PRH. Справа: Схема сравнения контроля побочной реакции между PRH и традиционными методами. Фото: Вэйвэй Пинг, Мэрилендский университет, Колледж-Парк.
Помимо однокомпонентных пленок, нашу технологию PRH можно также использовать для быстрого спекания композитных пленок, так как короткое время спекания может эффективно предотвратить побочные реакции между материалами. Чтобы продемонстрировать эту способность, мы спекали композитную SSE-пленку LiBO 2 -LLZTO (рис. 4, A и C). Полученный материал содержал LiBO 2 , равномерно распределенный между зернами LLZTO с конформными поверхностями раздела и без явного совместного легирования, вероятно, из-за короткого времени спекания, составляющего 3 секунды, даже при высокой температуре спекания 1200 ° C.Напротив, когда мы спекали те же материалы в обычной печи в течение 1 часа, мы получили пористую структуру с крупными прореагировавшими зернами, а не плотный композит (рис. S18). Часовое спекание в обычной печи приводит к заметной перекрестной диффузии и побочным реакциям между компонентами, в то время как метод PRH позволяет избежать таких побочных реакций с образованием композитных структур (рис. 4C, справа). Эта способность производить широкий спектр как однокомпонентных, так и многокомпонентных компаундов указывает на универсальность нашего быстрого процесса печати и спекания для производства высококачественных керамических пленок.
Технология PRH также может применяться для изготовления твердотельных батарей со слоистой структурой посредством послойной печати и спекания. Раствор прекурсора LiCoO 2 (рис. S19) был напечатан на тонкой, быстро спеченной таблетке LLZTO с последующим спеканием PRH при ~ 800 ° C (из-за низкой температуры реакции) в течение ~ 3 с для синтеза LiCoO in situ. 2 катод. Затем мы покрыли металлический Li-анод с другой стороны таблетки, чтобы сформировать твердотельную батарею LiCoO 2 / LLZTO / Li для работы на велосипеде (рис.5А). Изображение поперечного сечения SEM и картирование EDS (рис. 5, B и C) показывают, что катод LiCoO 2 был равномерно спечен на поверхности LLZTO с конформной и четкой границей раздела. LiCoO 2 , синтезированный методом PRH, также показывает пики XRD, хорошо соответствующие стандартной фазе LiCoO 2 без большого количества вторичной фазы, что указывает на успешный синтез в течение 3-секундного времени спекания (рис. S20). Из-за высокой температуры и короткого времени спекания спеченный LiCoO 2 имеет нанопористую структуру с размером зерна ~ 200 нм (рис.S21) и четко определенный конформный интерфейс без явного перекрестного легирования с гранатом LLZTO (рис. 5C). Чтобы облегчить перенос Li в пористом слое LiCoO 2 и избежать снижения емкости из-за изменения объема катода во время циклирования, мы использовали LiBO 2 в качестве твердотельного связующего, смешанного с катодом LiCoO 2 ( 44 ). Поскольку LiBO 2 может плавиться при ~ 850 ° C, мы напечатали и спекали прекурсор LiBO 2 в течение 3 с в пористом слое LiCoO 2 с использованием метода PRH, что привело к однородной структуре композита (рис.5, Г и Д). Затем мы охарактеризовали электрохимические характеристики полученной послойно напечатанной и спеченной твердотельной батареи LiBO 2 -LiCoO 2 / LLZTO / Li.
Рис. 5 Полностью твердотельный аккумулятор LiBO 2 -LiCoO 2 / LLZTO / Li, спеченный методом PRH.( A ) Процесс печати и спекания твердотельной батареи, изготовленной с помощью PRH. ( B ) SEM-изображение поперечного сечения и ( C ) EDS-отображение спеченного с помощью PRH катода LiCoO 2 на поверхности LLZTO.( D ) Поперечное сечение и ( E ) увеличенные SEM-изображения интерфейса LiBO 2 -LiCoO 2 / LLZTO. ( F ) Спектры ЭИС полностью твердотельной батареи (LiBO 2 -LiCoO 2 / LLZTO / Li) до цикла и после цикла 450 th . ( G ) Профили напряжения полностью твердотельной батареи, изготовленной на месте, при различных плотностях тока. ( H ) Циклические характеристики и кулоновская эффективность LiBO 2 -LiCoO 2 / LLZTO / Li полностью твердотельный аккумулятор при 60 ° C.
Из-за конформных интерфейсов межфазное сопротивление этой спеченной PRH батареи было всего лишь ~ 100 Ом · см 2 при 60 ° C (рис. 5F), что значительно меньше, чем у других спеченных совместно спеченных элементов. твердотельные батареи ( 44 — 46 ). Профили напряжения напечатанной батареи демонстрируют типичные плато катода LiCoO 2 (рис. 5G), что дополнительно демонстрирует успешный синтез LiCoO 2 с помощью метода быстрого PRH.Кроме того, емкость аккумулятора и его характеристики при циклическом использовании демонстрируют хорошее сохранение емкости и отличную стабильность при циклическом использовании в течение ~ 450 циклов (рис. 5H). В частности, начальная удельная емкость составляла ~ 87 мА · час / г при плотности тока 30 мА / г, что лучше, чем в большинстве предыдущих отчетов с использованием совместно спеченного LiCoO 2 и граната ( 37 , 43 , 44 ). Емкость немного уменьшается с увеличением плотности тока, но мало изменяется за циклы при каждой плотности тока (рис.5H). После ~ 450 циклов межфазное сопротивление немного увеличилось до ~ 170 Ом · см 2 (рис. 5F), что дополнительно демонстрирует превосходную стабильность спеченного катода in situ и поверхности раздела, синтезированных методом PRH.
Благодарности: Мы признательны за поддержку наноцентру Мэриленда, включая его Центр анализа поверхности и AIMLab. Финансирование: Этот проект не финансируется напрямую. Вклад авторов: L.H., C.W. и W.П. разработал эксперименты. W.P. и R.W. проводили эксперименты. З.Л. и J.D. создали трехмерные иллюстрации. L.H., W.P., C.W., Q.D., A.H.B. и J.L. совместно написали статью. Все авторы прокомментировали окончательный вариант рукописи. Конкурирующие интересы: Авторы подали заявку на предварительный патент через Университет Мэриленда (предварительный патент США 62/849578). Авторы заявляют, что у них нет других конкурирующих интересов. Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в статье и / или дополнительных материалах.Дополнительные данные, относящиеся к этой статье, могут быть запрошены у авторов.
% PDF-1.6 % 127 0 объект > эндобдж xref 127 136 0000000016 00000 н. 0000003907 00000 н. 0000004118 00000 п. 0000004159 00000 н. 0000004194 00000 п. 0000004484 00000 н. 0000004695 00000 н. 0000004802 00000 н. 0000004910 00000 н. 0000005018 00000 н. 0000005098 00000 н. 0000005179 00000 н. 0000005259 00000 н. 0000005338 00000 н. 0000005417 00000 н. 0000005495 00000 н. 0000005574 00000 н. 0000005653 00000 п. 0000005732 00000 н. 0000005811 00000 н. 0000005891 00000 н. 0000005969 00000 н. 0000006049 00000 п. 0000006128 00000 н. 0000006207 00000 н. 0000006285 00000 н. 0000006364 00000 н. 0000006442 00000 н. 0000006522 00000 н. 0000006602 00000 н. 0000006682 00000 н. 0000006808 00000 н. 0000006842 00000 н. 0000007002 00000 н. 0000007255 00000 н. 0000007337 00000 н. 0000007383 00000 п. 0000007437 00000 н. 0000010072 00000 п. 0000012639 00000 п. 0000012887 00000 п. 0000013065 00000 п. 0000013134 00000 п. 0000013496 00000 п. 0000013952 00000 п. 0000014154 00000 п. 0000014568 00000 п. 0000014897 00000 п. 0000015099 00000 п. 0000015519 00000 п. 0000015814 00000 п. 0000016162 00000 п. 0000016522 00000 п. 0000016700 00000 н. 0000016996 00000 н. 0000017191 00000 п. 0000017351 00000 п. 0000017420 00000 п. 0000019888 00000 п. 0000020319 00000 п. 0000020517 00000 п. 0000020804 00000 п. 0000020863 00000 п. 0000021041 00000 п. 0000021213 00000 п. 0000021282 00000 п. 0000021577 00000 п. 0000021779 00000 п. 0000022296 00000 п. 0000022464 00000 п. 0000022667 00000 п. 0000022869 00000 п. 0000023372 00000 п. 0000023970 00000 п. 0000024256 00000 п. 0000024722 00000 п. 0000024900 00000 п. 0000024969 00000 п. 0000025335 00000 п. 0000025632 00000 п. 0000028155 00000 п. 0000028325 00000 п. 0000028680 00000 п. 0000028874 00000 п. 0000029034 00000 п. 0000029462 00000 п. 0000029670 00000 п. 0000032403 00000 п. 0000032603 00000 п. 0000032927 00000 н. 0000033147 00000 п. 0000033313 00000 п. 0000033589 00000 п. 0000033913 00000 п. 0000034132 00000 п. 0000034492 00000 п. 0000034760 00000 п. 0000035226 00000 п. 0000038003 00000 п. 0000040204 00000 п. 0000042756 00000 п. 0000043160 00000 п. 0000044650 00000 п. 0000049711 00000 п. 0000049971 00000 п. 0000051705 00000 п. 0000055008 00000 п. 0000057298 00000 п. 0000058241 00000 п. 0000058547 00000 п. 0000060391 00000 п. 0000061405 00000 п. 0000061800 00000 п. 0000065801 00000 п. 0000066121 00000 п. 0000068815 00000 п. 0000069156 00000 п. 0000069982 00000 п. 0000072388 00000 п. 0000072895 00000 п. 0000073050 00000 п. 0000086552 00000 п. 0000086591 00000 п. 0000107800 00000 н. 0000107839 00000 п. 0000129048 00000 н. 0000129087 00000 н. 0000150296 00000 н. 0000150335 00000 н. 0000170457 00000 н. 0000170496 00000 п. 0000170549 00000 н. 0000170676 00000 н. 0000170746 00000 н. 0000170816 00000 н. 0000003016 00000 н. трейлер ] >> startxref 0 %% EOF 262 0 объект > поток x ڴ S; LSa> ז BZ, gA * MVnPR ͥڒ & @ KEr QV] A «F Ը VuKNw?
Водный гибридный электролит для низкотемпературных цинковых накопителей энергии
Устройства для накопления энергии на водной основе цинка (ZES) являются многообещающими кандидатами для портативных и сетевых приложений из-за их высокой безопасности, низкой стоимости и высокой теоретической плотности энергии.Однако обычные водные электролиты не могут работать при низкой температуре. Здесь мы сообщаем о холодостойком, экономичном, безопасном и экологически чистом гибридном электролите с высокой проводимостью по ионам цинка (6,9 мСм см −1 при −40 ° C) и высокой обратимостью цинкования / удаления покрытия, что состоит из воды, этиленгликоля (EG) и соли сульфата цинка (ZnSO 4 ). Эксперименты вместе с теоретическими расчетами показали, что уникальное сольватационное взаимодействие Zn 2+ с EG может эффективно усиливать водородную связь между EG и H 2 O и ослаблять сольватационное взаимодействие Zn 2+ с H 2 O, таким образом обеспечивая гибридный электролит с более низкой температурой замерзания и обратимым химическим составом Zn / Zn 2+ .В качестве доказательства концепции, как Zn-ионные гибридные суперконденсаторы (ZHSC), так и Zn-ионные батареи (ZIB) с гибридными электролитами обеспечивали высокую плотность энергии (36 Вт · ч кг -1 для ZHSC и 121 Вт. ч кг −1 для ZIB), высокой удельной мощности (3,1 кВт кг −1 для ZHSC и 1,7 кВт кг −1 для ZIB) и длительный срок службы (5500 циклов более 110 дней для ZHSC и 250 циклов для ZIB) при -20 ° C. Эта работа предоставляет новую возможность для низкотемпературных накопителей энергии.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?| Вкладчик постоянного тока.советник | Йет-Мин Чан. | ru_US |
| dc.contributor.author | Pan, Menghsuan Sam | en_US |
| dc.contributor.other | Массачусетский технологический институт. Департамент материаловедения и инженерии. | ru_US |
| dc.date.accessed | 2015-09-17T19: 03: 16Z | |
| dc.date.available | 2015-09-17T19: 03: 16Z | |
| постоянного тока.дата. авторское право | 2010 | ru_US |
| dc.date.issued | 2015 | en_US |
| dc.identifier.uri | http://hdl.handle.net/1721.1/98665 | |
| dc. описание | Диссертация: S.B., Массачусетский технологический институт, Департамент материаловедения и инженерии, июнь 2015 г. | ru_US |
| dc. описание | Каталогизируется из PDF-версии диссертации.«Май 2015 года». | ru_US |
| dc.description | Включает библиографические ссылки (страницы 32-33). | ru_US |
| dc.description.abstract | Литий-полисульфидные проточные батареи, в которых используется высокая растворимость полисульфида лития в неводных электролитах для обеспечения текучих электродов, имеют высокую теоретическую плотность энергии и низкую стоимость сырья. Для достижения большей плотности энергии на уровне электрода необходимы более высокие концентрации серы.В данной системе электролита емкость накопления заряда серы (например, мАч / г серы) резко уменьшается с увеличением концентрации серы при фиксированной скорости C, что соответствует более высокому выходному току в системе с более высокой концентрацией. Понимание ограничивающих факторов, которые снижают пропускную способность, имеет решающее значение для повышения производительности систем с высокой плотностью энергии. В частности, мы систематически исследуем ионную проводимость и плотность тока обмена на поверхности электрода с растворами полисульфида лития различной концентрации и в различных растворителях, которые растворяют молекулы разных размеров.Ионную проводимость измеряют с помощью имеющегося в продаже зонда проводимости, а плотности тока обмена измеряют с помощью спектроскопии импеданса и гальваностатической поляризации с использованием рабочих электродов из стеклоуглерода. Установлено, что растворитель электролита существенно влияет на ионную проводимость раствора и плотность тока обмена. В интересующем диапазоне концентраций (1-8 M [S]) ионная проводимость монотонно уменьшается с увеличением концентрации серы, в то время как плотность тока обмена показывает более сложный отклик в данной системе растворителей.Между системами растворителей мы наблюдали пятикратное увеличение ионной проводимости и более чем 15-кратное увеличение плотности тока обмена. Результаты по проводимости и плотности тока используются для интерпретации скоростной способности ячеек на основе суспензии, использующих электролит на основе полисульфида лития и углеродную сажу в качестве катода с различными растворителями. С улучшением кинетических параметров мы также наблюдали лучшую скорость реакции в растворителе. Мы также изучаем неуглеродные электродные материалы, чтобы понять, как электродный материал может повлиять на плотность тока обмена и, следовательно, на емкость ячейки.Электрод из оксида индия и олова показывает более низкую плотность тока обмена, чем стеклоуглеродный электрод по предварительным результатам. | ru_US |
| dc.description.statementofresponsibility | от Menghsuan Sam Pan. | ru_US |
| формат постоянного тока, объем | 53 страницы | ru_US |
| dc.language.iso | eng | en_US |
| dc.publisher | Массачусетский технологический институт | en_US |
| постоянного тока.права | M.I.T. Тезисы защищены авторским правом. Их можно просматривать из этого источника для любых целей, но воспроизведение или распространение в любом формате запрещено без письменного разрешения. См. Предоставленный URL-адрес для запросов о разрешении. | ru_US |
| dc.rights.uri | http://dspace.mit.edu/handle/1721.1/7582 | en_US |
| dc.subject | Материаловедение и инженерия. Наверх
|
