ГАЗ 21 Волга технические характеристики
Эксплуатационные характеристики ГАЗ 21 Волга
Максимальная скорость: 130 км/ч
Расход топлива на 100км в смешанном цикле: 9 л
Объем бензобака: 60 л
Снаряженная масса автомобиля: 1460 кг
Допустимая полная масса: 1885 кг
Размер шин: 6.70-15
Характеристики двигателя
Расположение: спереди, продольно
Объем двигателя: 2445 см3
Мощность двигателя: 70 л.с.
Количество оборотов: 4000
Крутящий момент: 170/2200 н*м
Система питания: Карбюратор
Турбонаддув: нет
Газораспределительный механизм: нет
Расположение цилиндров: Рядный
Количество цилиндров: 4
Диаметр цилиндра: 92 мм
Ход поршня: 92 мм
Степень сжатия: 6. 6
6
Количество клапанов на цилиндр: 2
Рекомендуемое топливо: АИ-80
Тормозная система
Передние тормоза: Барабанные
Задние тормоза: Барабанные
Рулевое управление
Тип рулевого управления: Глобоидный червяк с рециркулирующими шариками
Усилитель руля: нет
Трансмиссия
Привод: Задний
Количество передач: механическая коробка — 3
Передаточное отношение главной пары: 3.78
Подвеска
Задняя подвеска: Рессора
Передняя подвеска: Винтовая пружина
Кузов
Тип кузова: седан
Количество дверей: 4
Количество мест: 5
Длина машины: 4770 мм
Ширина машины: 1885 мм
Высота машины: 1620 мм
Колесная база: 2700 мм
Колея передняя: 1410 мм
Колея задняя: 1420 мм
Дорожный просвет (клиренс): 190 мм
Модификации
Первая серия с 1956 по 1958
ГАЗ-М-21Г — с форсированным двигателем от «Победы»,
ГАЗ-М-21Б — с форсированным двигателем от «Победы», такси.
ГАЗ-М-21 — двигатель 2,445 л. и АКПП,
ГАЗ-М-21А — такси на базе ГАЗ-М-21В,
ГАЗ-М-21В — общего назначения с двигателем 2,445 л.,
ГАЗ-М-21Д — экспортная с МКПП (двигатель 80 л.с.), дополнительные хромовые элементы отделки (только поясной молдинг, оклады стекол появились начиная со второй серии).
ГАЗ-М-21Е — экспортная с АКПП.
Вторая серия с 1959 по 1962
ГАЗ-М-21И — базовый седан,
ГАЗ-М-21А — такси,
ГАЗ-М-21 — версия с АКПП (значилась в производственной программе, но реально выпущенные экземпляры не известны),
ГАЗ-М-21Е — версия с АКПП (очень ограниченный выпуск по спецзаказу),
ГАЗ-М-21У — улучшенная комплектация (более богатая отделка, но со стандартным двигателем),
ГАЗ-М-21К — экспортная (двигатель 80 л.с. или 75 л.с., дополнительные хромированные элементы отделки).
Третья серия с 1962 по 1970
ГАЗ-М-21Л — базовый седан,
ГАЗ-М-21М — экспортная,
ГАЗ-М-21У — улучшенная комплектация (к комплектации добавились хромовые декоративные молдинги по крыльям — на передних в виде стрел и на задних — в форме плавников),
ГАЗ-М21Т — таксомотор, имел раздельные передние сидения для перевозки крупногабаритных грузов.
На базе ГАЗ-21 третьей серии выпускались самостоятельные модели:
Грузопассажирский ГАЗ-22
ГАЗ-22 — малосерийный универсал (прототипы и первые серийные экземпляры возможно имели оформление второй серии), выпускавшися в 1962-1970 гг; на его базе выпускалась карета скорой помощи.
ГАЗ-22А — фургон, созданный в 1961 году; в серию не пошёл, но по его образцу строили фургоны авторемонтные заводы.
ГАЗ-23 — мелкосерийная машина сопровождения («быстроходная модификация», «догонялка»), с двигателем и автоматической коробкой передач от лимузина «Чайка» ГАЗ-13 (V8, 5,53 л., 160, позднее 195 л.с.) и усиленными кузовом и ходовой частью, которая выпускалась в 1962-1974 гг в крайне ограниченных количествах (по информации исследователя вопроса Дмитрия Гвоздева, 608 экземпляров) для нужд КГБ и других силовых ведомств.
Производство
Год выпуска: с 1956 по 1970
| Фотоальбом Гараж Библиотека Гостевая_книга Ссылки Магазин Контакты |
Технические
характеристики автомобилей ГАЗ-21 «ВОЛГА» Автомобиль модели М-21А, М-21Т, ГАЗ-21Т легковой такси Автомобиль модели М-21, М-21Б, М-21В, М-21И, М-21Л, ГАЗ-21Р, ГАЗ-21УС легковой, пассажирский, общего пользования Автомобиль модели М-21Д, М-21Е, М-21К, М-21М, М-21П, ГАЗ-21С, ГАЗ-21Н легковой, пассажирский, экспортная комплектация Число мест (включая место водителя) 5 Низшие точки автомобиля с полной нагрузкой при нормальном давлении в шинах: поперечина передней подвески 200 мм труба глушителя 190 мм Картер заднего моста (по фланцу) 190 мм Наименьший радиус поворота по колее наружного колеса 6,3 м Углы въезда с полной нагрузкой: передний 27° Примечание. Сорт топлива Автомобильный бензин А-72 Примечание. Контрольный расход бензина является показателем, определяющим исправность автомобиля. Норма расхода бензина заводом не устанавливается. Временная государственная норма расхода бензина равна 13,5 л на 100 км пробега. Заводские номера двигателя и шасси вы биты на табличке, расположенной под капотом. Номер двигателя выбит также на блоке цилиндров с левой стороны, в середине верхней части. ДВИГАТЕЛЬ Тип Четырехтактный, карбюраторный, бензиновый. Подвеска двигателя В 3 точках на резиновых подушках: две спереди и одна сзади. Блок цилиндров Отлит из алюминиевого сплава, имеет мокрые легкосъемные чугунные гильзы. В верхней части имеющие вставку из антикоррозийного износоустойчивого чугуна. Головка блока Из алюминиевого сплава. Поршни Из алюминиевого сплава, луженые. Поршневые кольца 2 компрессионных и 1 маслосъемное кольцо на каждом поршне. Верхнее компрессионное кольцо хромированное, остальные луженые. Число опор коленчатого вала 5 Коленчатый вал- из магниевого чугуна литой с противовесами, статически и динамически сбалансированный. Поверхность шеек закалена. Вкладыши подшипников Тонкостенные, биметаллические. Распределительный вал и его привод Стальной, кованый, привод парой шестерен Фазы распределения (при рас четной величине зазора:.  Впуск: открытие 24°
до ВМТ, закрытие 64° после НМТ. 0,35 мм между коромыслом и клапаном).
Выпуск: открытие 50° до НМТ, закрытие 22° после ВМТ. Впуск: открытие 24°
до ВМТ, закрытие 64° после НМТ. 0,35 мм между коромыслом и клапаном).
Выпуск: открытие 50° до НМТ, закрытие 22° после ВМТ.Клапаны . Верхние установлены в головку блока, вертикально в один ряд. Система смазки Комбинированная. Подшипники коленчатого и распределительного вала, шатунные подшипники, подшипники коромысел и верхние наконечники штанг смазываются под давлением, остальные детали- разбрызгиванием.  Масляный картер Стальной, штампованный Забор масла из картера Плавающим маслоприемником Масляный фильтры Два: грубой очистки- пластинчатый, фильтрующий 100% масла, подаваемого насосом в магистраль, и тонкой очистки- со сменным фильтрующим элементом, частичной фильтрации. Элементы фильтра тонкой очистки Сменный, типа ДАСФО- 2 Клапаны масляной системы Два: редукционный, поршневого типа- установлен с правой стороны (изменять их регулировку воспрещается) двигателя, в передней части, и перепускной- в корпусе фильтра грубой очистки Вентиляция картера Принудительная Воздушный фильтр ……Инерционно- масляной, сетчатый с глушителем шума всасывания Карбюратор Типа К-22И или К-105.(второй выпуск) Типа К-124.(третий выпуск) Бензиновый насос Диафрагменный, с верхним отстойником, в котором помещен сетчатый фильтр, и рычагом для ручной подкачки Бензиновый бак Штампованный из двух половин, расположен в задней части кузова под полом.  Система охлаждения двигателя Жидкостная, закрытая, с принудительной циркуляцией. Радиатор Трубчатый, с гофрированными пластинами между трубок, трехрядный. Пробка радиатора Герметичная. Снабжена двумя клапанами. Створки радиатора Установлены перед радиатором. Величина открытия створок. регулируется вручную с места водителя. Водяной насос Центробежный с торцовым самоподтягивающимся сальником Вентилятор Четырех лопастный, штампованный Привод вентилятора и водяного насоса Клиновидным ремнем от коленчатого вала. ШАССИ Сцепление Однодисковое сухое с гидравлическим приводом выключения Передаточные числа 1 передача — 3,115 ХОДОВАЯ ЧАСТЬ Колеса Штампованные, дисковые. Запасное колесо помещается в багажнике. Передняя подвеска Независимая, рычажная, на витых цилиндрических пружинах, смонтированная на отъемной поперечине. Все шарниры рычагов подвески выполнены с применением резьбовых пальцев и втулок. Стабилизатор поперечной устойчивости Торсионного типа, расположен впереди передней подвески. Передние амортизаторы Гидравлические, поршневые, рычажные, двустороннего действия. Задняя подвеска Рессорная. Рессоры листовые, продольные, полуэллиптические, закрытые чехлами. Все шарниры подвески снабжены резиновыми втулками. Задние амортизаторы Гидравлические, поршневые, рычажные,(второй выпуск) телескопические (третий выпуск) РАМА Рама Короткая рама только в передней части автомобиля. РУЛЕВОЕ УПРАВЛЕНИЕ Тип рулевого механизма Глобоидальный червяк с двойным роликом ТОРМОЗА Основной Колодочный, на все 4 колеса ЭЛЕКТРООБОРУДОВАНИЕ И ПРИБОРЫ Номинальное напряжение в сети 12 вольт «плюс» соединен с «массой» (до1960 года), «минус» соединен с «массой» (после 1960 года) Электродвигатель вентилятора отопителя Типа МЭ13 мощностью 20 ватт (автомобили такси приемника не имеют) первый выпуск Типа А-8, двухдиапазонный , с плавной и кнопочной настройкой (с плюсом на корпусе) второй выпуск Типа А-12, двухдиапазонный, с плавной и кнопочной настройкой(с плюсом на корпусе до 1960 года, и соответственно с минусом после 1960 года), блок питания БП-12 или ВП-9 третий выпуск Типа А-18, Трехдиапозонный, с плавной и кнопочной настройкой (с минусом на корпусе), блок питания П4А (П4В) Антенна Типа АР41- Б телескопическая КУЗОВ Кузов Закрытый, четырехдверный, цельнометаллический, несущий ОБОРУДОВАНИЕ Шоферский инструмент к автомобилю прилагается: две сумки с набором
инструмента, домкрата, пусковая рукоятка, ручной насос и переносная
лампа. ЗАПРАВОЧНЫЕ ЕМКОСТИ И НОРМЫ Бензиновый бак 60 л РЕГУЛИРОВОЧНЫЕ ДАННЫЕ Зазор между рычагом коромысла и клапаном. 0,25 мм, на холодном
двигателе.
|
7.1: Характеристики газов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 371599
- Мухаммад Ариф Малик
- Hampton University, Hampton, VA
Что такое газ
Газ — это одно из четырех состояний вещества, которое находится между жидким и плазменным состоянием. Окружающий нас воздух представляет собой газ, состоящий примерно на 78% из азота (N 2 ), примерно на 21% из кислорода, а оставшийся ~1% составляют другие газы, включая углекислый газ, пары воды, аргон и т. д., как показано на рис. Рис. 7.1.1.
Рисунок \(\PageIndex{1}\): Изображение состава атмосферы Земли; нижняя диаграмма представляет наименее распространенные газы, составляющие 0,037680% атмосферы. Источник: Брокерт из английской Википедии/общественное достояние 9.0033 Элементы, существующие в виде газов при комнатной температуре и атмосферном давлении, включают благородные газы, представляющие собой одноатомные молекулы, включая гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). и двухатомные элементарные молекулы, которые включают водород (H 2 ), азот (N 2 ), кислород (O 2 ) и два галогена: фтор (F 2 ) и хлор (Cl 2 ) . Несколько молекулярных соединений существуют в виде газов при комнатной температуре, например, двуокись углерода (CO 2 ), оксид углерода (CO), метан (CH 4 ), диоксид азота (NO 2 ), диоксид серы (SO 2 ), сероводород (H 2 S), аммиак (NH 3 ).
Источник: Брокерт из английской Википедии/общественное достояние 9.0033 Элементы, существующие в виде газов при комнатной температуре и атмосферном давлении, включают благородные газы, представляющие собой одноатомные молекулы, включая гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). и двухатомные элементарные молекулы, которые включают водород (H 2 ), азот (N 2 ), кислород (O 2 ) и два галогена: фтор (F 2 ) и хлор (Cl 2 ) . Несколько молекулярных соединений существуют в виде газов при комнатной температуре, например, двуокись углерода (CO 2 ), оксид углерода (CO), метан (CH 4 ), диоксид азота (NO 2 ), диоксид серы (SO 2 ), сероводород (H 2 S), аммиак (NH 3 ).Свойства газов определяются их количеством в молях (n), объемом (V), температурой (T) и давлением (P). Эти параметры описаны ниже.
Количество газа
Количество газа измеряется в молях (n), т. е. 6,022 x 10 23 молекул газа составляет один моль газа. Газ имеет массу и может быть измерен в единицах массы, таких как граммы или килограммы, но массу необходимо разделить на молярную массу газа, чтобы получить количество в молях для расчетов.
е. 6,022 x 10 23 молекул газа составляет один моль газа. Газ имеет массу и может быть измерен в единицах массы, таких как граммы или килограммы, но массу необходимо разделить на молярную массу газа, чтобы получить количество в молях для расчетов.
Примечание
Количество газа в молях необходимо в газовых законах, потому что свойства газов пропорциональны количеству молекул, а не их массам.
Пример \(\PageIndex{1}\)
Сколько молей содержится в 10,0 г газообразного кислорода?
Раствор
Этап 1. Дано: Масса = 10,0 г O 2 , Требуемое: ? моли O 2 .
Шаг 2. Равенство заданной и искомой единиц: 1 моль O 2 = 32,00 г O 2 .
Шаг 3. Коэффициенты пересчета из равенства: \(\frac{1~моль~O_2}{32,00~г~O_2}\) и \(\frac{32,00~г~O_2}{1~моль~O_2 }\)
Шаг 4. Умножить данное количество на коэффициент пересчета, который отменяет данное и оставляет в ответе нужную единицу: \[10. 0 \cancel{~g~O_2)}\times\frac{1~mol~ O_2}{32.00\cancel{~g~O_2}} = 0.312 ~g~O_2\nonumber\]
0 \cancel{~g~O_2)}\times\frac{1~mol~ O_2}{32.00\cancel{~g~O_2}} = 0.312 ~g~O_2\nonumber\]
Объем газа
Объем ( V ) – это пространство, которое занимает вещество. Единицей объема в системе СИ является кубический метр (м 9{3}=1000 \mathrm{~L}\nonnumber\]
\[1 \mathrm{~L}=1000 \mathrm{~mL}\nonnumber\]
Газы не имеют фиксированной формы или объема . Газы приобретают форму сосуда. Газы расширяются или сжимаются, чтобы заполнить доступное пространство в контейнере.
Температура газа
Температура ( T ) является мерой того, насколько горячим или холодным является объект.
Температура – это проявление тепловой энергии вещества. Тепловая энергия является источником тепла. Тепло – это поток энергии от горячего объекта к холодному. Единицей температуры в СИ является Кельвин (К), который имеет значение 273,15 К при температуре замерзания воды и 375,15 К при температуре кипения воды. Нуль шкалы Кельвина называется абсолютным нулем, при котором энергия больше не может выделяться из вещества в виде тепла. На шкале температуры Кельвина нет отрицательного числа.
На шкале температуры Кельвина нет отрицательного числа.
Другими часто используемыми единицами измерения температуры являются градусы Цельсия ( o C), которые имеют значение 0 o C при температуре замерзания воды и 100 o C при температуре кипения воды. Соотношение между температурой в кельвинах ( T K ) и температурой в градусах Цельсия ( T C ) выглядит следующим образом.
\[T_{K}=T_{C}+273,15\номер\]
Фаренгейт — это температурная шкала, используемая в английской системе измерения, которая имеет значение 32 o F при температуре замерзания воды и 212 o F при температуре кипения воды. Соотношение между температурой в Фаренгейтах ( T F ) и температурой в градусах Цельсия ( T C ) выглядит следующим образом.
\[T_{F}=\frac{9}{5} T_{C}+32\nonumber\]
Примечание
Температура в Кельвинах (К) используется в расчетах газового закона.
Давление газа
Давление ( P ) это сила ( F ) на единицу площади ( A ), т. е. \(P = \frac{F}{A}\).
Материя имеет массу и прикладывает силу, которая представляет собой вес из-за гравитационного притяжения. Например, столб размером 1 м x 1 м на уровне моря и высотой, равной земной атмосфере, как показано на рис. 7.1.2, имеет массу ~10 000 кг. Ртуть (Hg), заполненная столбом размером 1 м х 1 м и высотой 0,760 м, имеет такую же массу, как масса воздуха столба 1 м х 1 м, простирающегося от уровня моря до всей атмосферы земли.
Рисунок \(\PageIndex{2}\): Иллюстрация столба воздуха размером 1 м x 1 м в основании и в высоту, покрывающего всю атмосферу земли. Изменено с: http://wikimapia.org/8706099/Norfolk…/photo/1606686 Столб воздуха, простирающийся от уровня моря до всей атмосферы, приложил давление, равное одной атмосфере (атм), где атм — единица измерения давления . Одна атмосфера (атм) равна 760 миллиметрам ртутного столба (мм рт. ст.), где мм рт. ст. — еще одна единица измерения давления. Один мм рт. ст. также называется торр. Соотношение между атм, мм рт. ст. и Торр следующее. 9{2} \mathrm{~kP}=1,01325 \mathrm{~бар}=14,7 \mathrm{~psi}\номер\]
ст.), где мм рт. ст. — еще одна единица измерения давления. Один мм рт. ст. также называется торр. Соотношение между атм, мм рт. ст. и Торр следующее. 9{2} \mathrm{~kP}=1,01325 \mathrm{~бар}=14,7 \mathrm{~psi}\номер\]
Эти отношения изменены на коэффициенты преобразования, которые позволяют преобразовать одну единицу измерения давления в другую, как показано в следующих примерах.
Пример \(\PageIndex{2}\)
Выразите 51 мм рт.ст. в a) атм и b) в Па.
Решение
Дано: Давление = 51 мм рт.ст. Требуется: давление в атм и Па
Соотношение между мм рт.ст. и атм: \(1\mathrm{~атм}=760 \mathrm{~мм рт.ст.}\номер\) 9{3} \mathrm{~Pa}\nonumber\]
Измерение давления газа
Прибор, используемый для измерения атмосферного давления, называется барометром.
Барометр, показанный на рис. 7.1.3, был изобретен Евангелистой Торричелли. Это стеклянная трубка длиной более 760 мм, закрытая с одного конца. Стеклянная трубка наполняется ртутью и переворачивается, чтобы окунуть ее открытый конец в блюдо, содержащее слой ртути.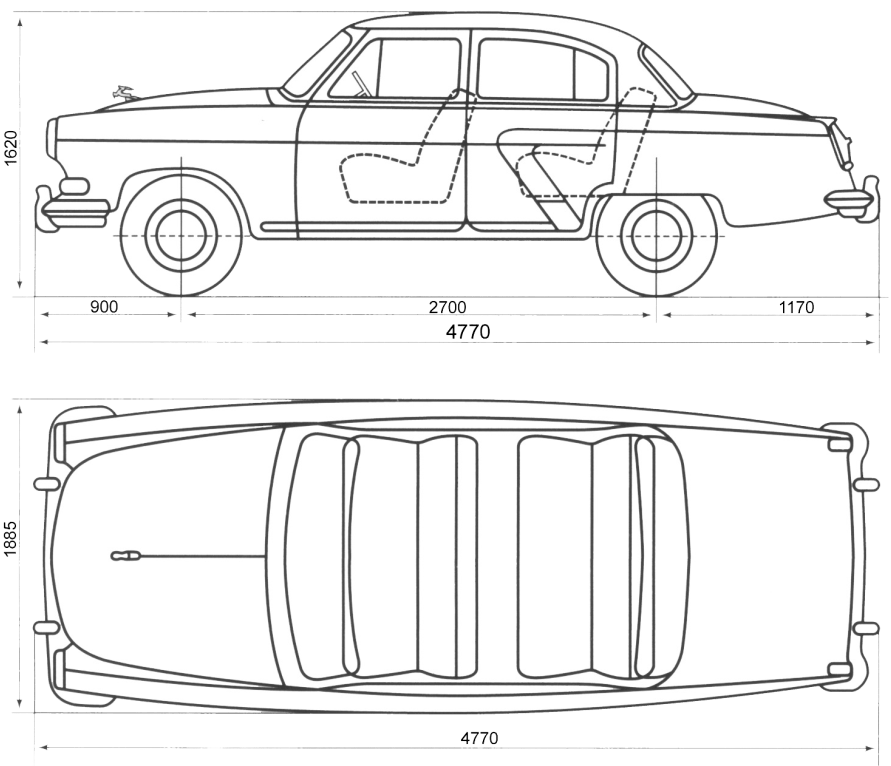 Ртуть падает из трубки из-за своего веса, но перестает падать, когда столбик ртути достигает высоты 760 мм на уровне моря из-за атмосферного давления, выталкивающего ее обратно в трубку. Помните, что 760 мм рт. ст. = 1 атм. Выше 760 мм в трубе вакуум.
Ртуть падает из трубки из-за своего веса, но перестает падать, когда столбик ртути достигает высоты 760 мм на уровне моря из-за атмосферного давления, выталкивающего ее обратно в трубку. Помните, что 760 мм рт. ст. = 1 атм. Выше 760 мм в трубе вакуум.
Давление газов в лаборатории обычно измеряется с помощью прибора, называемого манометром.
Манометр представляет собой U-образную стеклянную трубку, частично заполненную ртутью, как показано на рис. 7.1.4. Один конец U-образной трубки соединен с газовой камерой, в которой измеряется давление, а другой конец либо закрыт (с вакуумом на закрытом конце), называемом манометром с закрытым концом, либо открыт для атмосферы, называется манометром с открытым концом.
Рисунок \(\PageIndex{4}\): Манометры. Источник: изменено из Algarabia/общественное достояние. В случае манометра с закрытым концом давление газа равно разнице высоты ртутного столба в двух плечах U-образной трубки в мм рт. ) от точки N до точки B в миллиметрах, как показано на рис. 7.1.4.
) от точки N до точки B в миллиметрах, как показано на рис. 7.1.4.
Пример \(\PageIndex{3}\)
Рассчитайте давление в атм для газа, показанного на рис. 7.1.4, в закрытом манометре, если ч = 40 мм? 9{-2} \mathrm{~atm}\nonumber\]
В случае открытого манометра давление газа равно разнице высоты ртутного столба в двух плечах U-образной трубки в мм. рт.ст. плюс внешнее атмосферное давление, выраженное в мм рт.ст.
Изменение атмосферного давления с высотой
Атмосферное давление уменьшается, а концентрация газа уменьшается с увеличением высоты, как показано на рис. 7.1.5. Концентрация кислорода в воздухе также уменьшается с увеличением высоты. Вот почему альпинисты испытывают недостаточное снабжение организма кислородом на больших высотах — это заболевание называется гипоксией.
Рисунок \(\PageIndex{5}\): Атмосферное давление уменьшается, а концентрация воздуха и кислорода в нем уменьшается с увеличением высоты. Источник: Brendan Scott/The Conversation, CC BY-ND https://images. theconversation.com/f….png?ixlib=rb-
theconversation.com/f….png?ixlib=rb-Артериальное давление
Сердце перекачивает кровь в кровеносную систему. Когда сердце сокращается, оно оказывает давление на кровь в нем, и кровь перекачивается из сердца в кровеносную систему, как показано на рис. 7.1.6. Кровяное давление в кровеносной системе самое высокое в этот момент, и оно называется систолическое давление. Оно может находиться в пределах от 100 до 200 мм рт. Желательный диапазон систолического давления составляет от 100 до 120 мм рт. Когда сердечная мышца расслабляется, полость в сердце расширяется, и сердце наполняется большим количеством крови. Кровяное давление в системе кровообращения в этот момент минимально и называется диастолическим давлением. Диастолическое давление может колебаться в пределах от 60 до 110 мм рт. Желаемое диастолическое давление составляет менее 80 мм рт.
Рисунок \(\PageIndex{6}\): Диаграмма сердца, иллюстрирующая систолу, т. е. откачку крови из сердца, в сравнении с диастолой, т. е. наполнение кровью сердца. Источник: BruceBlaus/CC BY-SA (https://creativecommons.org/licenses/by-sa/4.0)
е. наполнение кровью сердца. Источник: BruceBlaus/CC BY-SA (https://creativecommons.org/licenses/by-sa/4.0) Устройство, используемое для измерения кровяного давления, называется сфигмометром . Он состоит из манжеты, которая надевается на плечо, насоса для накачивания воздуха в манжету и стетоскопа для прослушивания звука кровотока, как показано на рис. 7.1.7. Манжета наполняется воздухом до давления выше систолического, что приводит к прекращению кровотока через плечевую артерию в плече. Стетоскоп используется для прослушивания звука кровотока. В этот момент звука не слышно. Давление в манжете медленно снижается. Когда давление в манжете становится равным систолическому давлению, кровь начинает выбрасываться в артерию, и через стетоскоп слышен постукивающий звук. В момент, когда давление становится равным диастолическому давлению, кровь свободно течет по артерии, и постукивающий звук исчезает. Показания артериального давления представляются в виде набора из двух чисел, например, 120/80, где большее число соответствует систолическому, а меньшее — диастолическому давлению.
Кинетическая молекулярная теория газов
Физические характеристики газов можно объяснить с помощью модели, называемой кинетическая молекулярная теория газов , проиллюстрированная на рис. 7.1.8.
Рисунок \(\PageIndex{8}\): Модель газа, основанная на кинетической молекулярной теории газов. Молекулы представляют собой сферы, а хвосты, прикрепленные к молекулам, представляют собой траектории молекулярного движения. Красные хвосты представляют собой молекулы, отскакивающие от стенки, в результате чего газ оказывает давление на стенку контейнера. Источник: Becarlson/CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)Постулаты кинетической молекулярной теории газов
- Газы состоят из частиц, называемых молекулами, которые находятся далеко друг от друга.
 Вследствие больших расстояний межмолекулярные силы пренебрежимо малы, и объем, занимаемый молекулами газа, пренебрежимо мал.
Вследствие больших расстояний межмолекулярные силы пренебрежимо малы, и объем, занимаемый молекулами газа, пренебрежимо мал. - Молекулы газа движутся прямолинейно в случайных направлениях, пока не столкнутся с другой молекулой или стенкой сосуда.
- Столкновения упругие, т. е. полная энергия сохраняется, но молекулы меняют направление и скорость после столкновения. Это приводит к распределению молекулярных скоростей в широком диапазоне.
- Средняя кинетическая энергия молекул газа прямо пропорциональна абсолютной температуре. Средняя кинетическая энергия молекул разных газов одинакова при одной и той же температуре.
Объяснение характеристик газов на основе кинетической молекулярной теории газов
- При воздействии на газ вакуумом молекулы газа продолжают двигаться по прямой траектории в вакууме, пока не столкнутся с границей контейнера и не отскочат назад . Это объясняет, что газы расширяются. Столкновения молекул газа со стенкой оказывают внешнее давление на стенку, и в результате реакции стенка оказывает равное внутреннее давление на газ.
 Приложение большего давления к газу через любую часть границы газа нарушает вышеупомянутый баланс сил действия и противодействия, что приводит к перемещению части граничной поверхности внутрь. Другими словами, газы сжимаемы.
Приложение большего давления к газу через любую часть границы газа нарушает вышеупомянутый баланс сил действия и противодействия, что приводит к перемещению части граничной поверхности внутрь. Другими словами, газы сжимаемы. - Если удалить границу, разделяющую два газа, беспорядочные молекулярные движения в конечном счете смешивают два газа, образуя гомогенную смесь, т. е. газы полностью смешиваются с другими газами.
- При повышении температуры молекулы газа движутся быстрее и чаще коллоидируют, что объясняет тот факт, что газы оказывают большее давление при нагревании и расширяются, если граница не является жесткой. Летом шины чаще лопаются из-за повышения давления из-за нагрева.
- Когда в шину заливается больше газа, давление увеличивается из-за более частых столкновений. Сжатие газа до меньшего объема имеет тот же эффект, т. Е. Молекулярные столкновения увеличиваются, увеличивая давление.
Физические характеристики газов не зависят от природы молекул газа из-за незначительных межмолекулярных взаимодействий, но зависят от четырех физических свойств, т. е. давления, объема, температуры и количества газа. В следующих разделах описываются взаимосвязи между физическими свойствами газов.
е. давления, объема, температуры и количества газа. В следующих разделах описываются взаимосвязи между физическими свойствами газов.
Эта страница под названием 7.1: Характеристики газов распространяется в соответствии с лицензией Public Domain, автором, ремиксом и/или куратором которой является Мухаммад Ариф Малик.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Мухаммад Малик
- Лицензия
- Общественное достояние
- Теги

10.1: Характеристики газов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21759
Цели обучения
- Описать характеристики газа.
Три распространенные фазы (или состояния) материи — это газы, жидкости и твердые тела. Газы имеют самую низкую плотность из трех, легко сжимаются и полностью заполняют любой контейнер, в который они помещены. Газы ведут себя так, потому что их межмолекулярные силы относительно слабы, поэтому их молекулы постоянно движутся независимо от других присутствующих молекул. Твердые тела, напротив, относительно плотные, жесткие и несжимаемые, потому что их межмолекулярные силы настолько сильны, что молекулы, по существу, заперты на месте. Жидкости относительно плотны и несжимаемы, как и твердые тела, но они легко текут, приспосабливаясь к форме своих емкостей, как газы. Таким образом, мы можем заключить, что сумма межмолекулярных сил в жидкостях находится между силами газов и твердых тел. На рисунке \(\PageIndex{1}\) сравниваются три состояния вещества и показаны различия на молекулярном уровне.
Жидкости относительно плотны и несжимаемы, как и твердые тела, но они легко текут, приспосабливаясь к форме своих емкостей, как газы. Таким образом, мы можем заключить, что сумма межмолекулярных сил в жидкостях находится между силами газов и твердых тел. На рисунке \(\PageIndex{1}\) сравниваются три состояния вещества и показаны различия на молекулярном уровне.
Состояние данного вещества сильно зависит от условий. Например, H 2 O обычно находится во всех трех состояниях: твердый лед, жидкая вода и водяной пар (его газообразная форма). В большинстве случаев мы сталкиваемся с водой как с жидкостью, необходимой для жизни; мы пьем его, готовим на нем и купаемся в нем. Когда температура достаточно низкая, чтобы превратить жидкость в лед, мы можем кататься по ней на лыжах или коньках, упаковывать ее в снежный ком или снежный конус и даже строить из нее жилища. Водяной пар (член пар относится к газообразной форме вещества, которое является жидким или твердым при нормальных условиях, поэтому азот (N 2 ) и кислород (O 2 ) относятся к газам, но газообразная вода в атмосфере водяной пар) — это компонент воздуха, которым мы дышим, и он вырабатывается всякий раз, когда мы нагреваем воду для приготовления пищи или приготовления кофе или чая. Водяной пар при температуре выше 100°С называется паром. Пар используется для привода крупных машин, в том числе турбин, вырабатывающих электроэнергию. Свойства трех состояний воды приведены в таблице 10.1.
В большинстве случаев мы сталкиваемся с водой как с жидкостью, необходимой для жизни; мы пьем его, готовим на нем и купаемся в нем. Когда температура достаточно низкая, чтобы превратить жидкость в лед, мы можем кататься по ней на лыжах или коньках, упаковывать ее в снежный ком или снежный конус и даже строить из нее жилища. Водяной пар (член пар относится к газообразной форме вещества, которое является жидким или твердым при нормальных условиях, поэтому азот (N 2 ) и кислород (O 2 ) относятся к газам, но газообразная вода в атмосфере водяной пар) — это компонент воздуха, которым мы дышим, и он вырабатывается всякий раз, когда мы нагреваем воду для приготовления пищи или приготовления кофе или чая. Водяной пар при температуре выше 100°С называется паром. Пар используется для привода крупных машин, в том числе турбин, вырабатывающих электроэнергию. Свойства трех состояний воды приведены в таблице 10.1.
| Температура | Государственный | Плотность (г/см3) |
|---|---|---|
| ≤0°C | твердый (лед) | 0,9167 (при 0,0°С) |
| 0°C–100°C | жидкость (вода) | 0,9997 (при 4,0°С) |
| ≥100°C | пар (пар) | 0,005476 (при 127°С) |
Геометрическое строение и физические и химические свойства атомов, ионов и молекул обычно не зависят от их физического состояния; отдельные молекулы воды во льду, жидкой воде и паре, например, идентичны. Напротив, макроскопические свойства вещества сильно зависят от его физического состояния, которое определяется межмолекулярными силами и условиями, такими как температура и давление.
Напротив, макроскопические свойства вещества сильно зависят от его физического состояния, которое определяется межмолекулярными силами и условиями, такими как температура и давление.
На рисунке \(\PageIndex{2}\) показано расположение в периодической таблице тех элементов, которые обычно находятся в газообразном, жидком и твердом состояниях. За исключением водорода, элементы, встречающиеся в природе в виде газов, находятся в правой части периодической таблицы. Из них все благородные газы (группа 18) являются одноатомными газами, тогда как другие газообразные элементы представляют собой двухатомные молекулы ( H 2 , N 2 , O 2 , F 2 и Cl 2 ). ). Кислород также может образовывать второй аллотроп — высокореактивную трехатомную молекулу озона (9).0078 O 3 ), который также является газом. Напротив, бром (как Br 2 ) и ртуть (Hg) являются жидкостями при нормальных условиях (25°C и 1,0 атм, что обычно называют «комнатной температурой и давлением»). Галлий (Ga), который плавится при температуре всего 29,76°C, можно превратить в жидкость, просто взяв контейнер с ним в руку или оставив его в комнате без кондиционера в жаркий летний день. Все остальные элементы являются твердыми телами при нормальных условиях.
Галлий (Ga), который плавится при температуре всего 29,76°C, можно превратить в жидкость, просто взяв контейнер с ним в руку или оставив его в комнате без кондиционера в жаркий летний день. Все остальные элементы являются твердыми телами при нормальных условиях.
Все газообразные элементы (кроме одноатомных инертных газов) являются молекулами. В той же группе (1, 15, 16 и 17) самыми легкими элементами являются газы. Для всех газообразных веществ характерны слабые взаимодействия между составляющими их молекулами или атомами.
Объемное вещество может существовать в трех состояниях: газообразное, жидкое и твердое. Газы имеют самую низкую плотность из трех, хорошо сжимаемы и полностью заполняют свои сосуды. Элементы, которые существуют в виде газов при комнатной температуре и давлении, сгруппированы в правой части периодической таблицы; они встречаются либо в виде одноатомных газов (благородные газы), либо в виде двухатомных молекул (некоторые галогены, N 2 , О 2 ).
Газы имеют самую низкую плотность из трех, хорошо сжимаемы и полностью заполняют свои сосуды. Элементы, которые существуют в виде газов при комнатной температуре и давлении, сгруппированы в правой части периодической таблицы; они встречаются либо в виде одноатомных газов (благородные газы), либо в виде двухатомных молекул (некоторые галогены, N 2 , О 2 ).
10.1: Характеристики газов распространяются под лицензией CC BY-NC-SA 3.0 и были созданы, изменены и/или курированы LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.


 В сухой вес автомобиля не включается вес топлива, воды,
смазки, запасного колеса и набора шоферского инструмента, составляющий в
сумме округленно 100 кг.
В сухой вес автомобиля не включается вес топлива, воды,
смазки, запасного колеса и набора шоферского инструмента, составляющий в
сумме округленно 100 кг. с. при 4000 об/мин
с. при 4000 об/мин Снабжена синхронизатором на второй и третей передачах.
Снабжена синхронизатором на второй и третей передачах.
.jpg) Ручной механический — действует от рычага, расположенного под
панелью приборов.
Ручной механический — действует от рычага, расположенного под
панелью приборов.
 Комплект из двух тональных сигналов
Комплект из двух тональных сигналов Загорается при повышении температуры воды до 92-98С
Загорается при повышении температуры воды до 92-98С Ящик для мелких
вещей в панели приборов, стеклоочиститель, зеркало, 2 противосолнечных
козырька, пепельница, прикуриватель, отопитель кузова и обогреватель
ветрового стекла
Ящик для мелких
вещей в панели приборов, стеклоочиститель, зеркало, 2 противосолнечных
козырька, пепельница, прикуриватель, отопитель кузова и обогреватель
ветрового стекла
 narod.ru/
обязательна!
narod.ru/
обязательна! Вследствие больших расстояний межмолекулярные силы пренебрежимо малы, и объем, занимаемый молекулами газа, пренебрежимо мал.
Вследствие больших расстояний межмолекулярные силы пренебрежимо малы, и объем, занимаемый молекулами газа, пренебрежимо мал. Приложение большего давления к газу через любую часть границы газа нарушает вышеупомянутый баланс сил действия и противодействия, что приводит к перемещению части граничной поверхности внутрь. Другими словами, газы сжимаемы.
Приложение большего давления к газу через любую часть границы газа нарушает вышеупомянутый баланс сил действия и противодействия, что приводит к перемещению части граничной поверхности внутрь. Другими словами, газы сжимаемы.
