Аккумуляторная батарея: устройство, принцип работы, типы
Мы не представляем жизни без них. Они окружают нас повсюду. Лежат у людей в карманах, висят дома на стенах, установлены в каждом автомобиле и общественном транспорте, даже стационарные компьютеры не работают без них, не говоря уже о ноутбуках. Человечество в окружении этих элементов под названием аккумуляторы. Но несмотря на такое разнообразие источников энергии, единицы знают, как они устроены и как ими правильно пользоваться. В этой статье рассмотрены некоторые виды аккумуляторных батарей, применяемых в большинстве сферах человеческой жизни.
Содержание
- История
- Обзор автомобильных аккумуляторов
- Сурьмянистый АКБ
- Малосурьмянистые АКБ
- Кальциевый АКБ
- Гелиевые АКБ
- Принцип работы свинцово-кислотного АКБ
- Принцип работы литий-ионного аккумулятора
- Отличие Li-Pol, щелочных аккумуляторов от Ni-Cd и Ni-Mh.
- Ni-Cd Никель-кадмиевые аккумуляторы
- Ni-MH Никель-металлогидридные аккумуляторы
- Li-Pol Литий-полимерный аккумуляторы
- Щелочные аккумуляторы.

История
Впервые свет увидел аккумулятор в 1859 году. Изобретенный блестящим физиком и профессором имя которого Луи́ Гасто́н Планте́. Это имя широко известно в узких кругах. Человечество уже на протяжении 160 лет пользуется этим изобретением, которое серьезно облегчает жизнь каждого человека. Начиная от часов на руках и заканчивая сложными аппаратами поддерживающими жизнь в больницах.
С каждым годом электромобили сильнее заполняют улицы городов. Самый дорогой элемент такого транспорта — аккумуляторная батарея. Работали над созданием и усовершенствованием батарей ученые умы, такие как Томас Эдисон, Камилл Фор, Пейкер, и другие. Подобные исследования продолжаются по сегодняшний день.
Обзор автомобильных аккумуляторов
Сурьмянистый АКБ
Название «Сурьмянистый» происходит из того факта, что в этом источнике питания большое количество сурьмы (Sb) – это вещество, которое придает свинцу твердость. Устройство батареи основано на сплаве сурьмы со свинцом (5-15% Sb), из которого изготовляют пластины применяемые. Когда в АКБ напряжение достигает 12 В — происходит бурная активизация процесса электролиза благодаря сурьме. В процессе выделяются водород и кислород. При такой работе понижается уровень электролита из которого начинают выступать пластины электродов. Как результат — частая доливка воды в аккумулятор. Это устаревший вид батарей, который уже не применяют, кроме старой аппаратуры. Современные АКБ содержат сурьму, но в меньшем количестве.
Когда в АКБ напряжение достигает 12 В — происходит бурная активизация процесса электролиза благодаря сурьме. В процессе выделяются водород и кислород. При такой работе понижается уровень электролита из которого начинают выступать пластины электродов. Как результат — частая доливка воды в аккумулятор. Это устаревший вид батарей, который уже не применяют, кроме старой аппаратуры. Современные АКБ содержат сурьму, но в меньшем количестве.
Малосурьмянистые АКБ
Это аккумуляторы идентичные описанным выше, но содержащие меньше пяти процентов сурьмы. Это сделали для меньшего испарения вода, в результате – проблема частой доливки воды уходит. Еще было достигнуто уменьшение уровня саморазряда батареи при простоях. Данный вид батарей принято называть необслуживаемыми, но через полгода лучше проверять уровень дистиллированной воды, т.к. в ходе химической реакции она испаряется.
Важно! Клеммы аккумуляторов «плюс» и «минус» изготавливают разной толщины.
Преследовалась цель не дать клиенту перепутать контакты местами и сделать «короткое замыкание» в электрике автомобиля.
Модернизация вызвала повышение уровня стабильности батареи при нестабильности в сети автомобиля. Данный вид батареи по стабильности стоит на первом месте среди других АКБ.
Кальциевый АКБ
Устройство аккумулятора этого типа отличается тем, что сурьму заменили кальцием, что привело к еще меньшему испарению воды, которое стремится к нулю. Обозначение Са/Са на корпусе свидетельствует, что это кальциевый аккумулятор причем Са расположен в решетках как положительных так и отрицательных электродов. Если сравнить такой накопитель с сурьмянистым, то мы заметим, что саморазряд батареи с кальцием на семьдесят процентов понизился. Еще увеличилось напряжение с 12 вольт до 16.
Гелиевые АКБ
Гелиевые аккумуляторы разработали, чтобы уйти от опасности вытекания электролита, который токсичен для человека. При повреждении этого источника энергии химический состав не вытекает как в других АКБ из-за вязкой структуры электролита.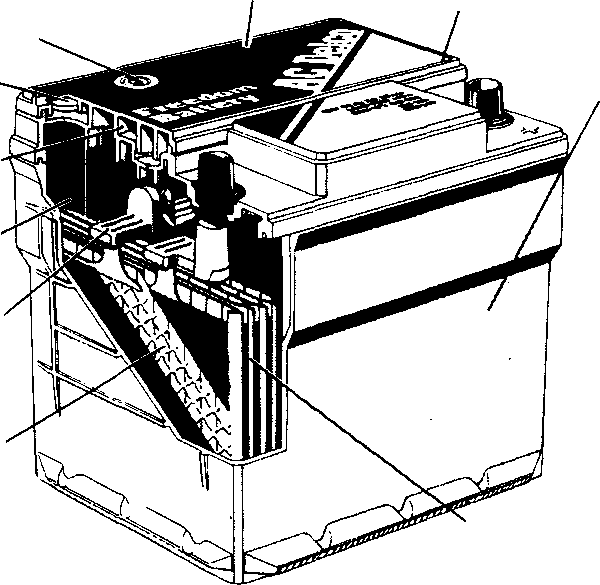 Преимущества таких АКБ положение установки, их можно устанавливать под углом, но меру знать тоже нужно. Еще такие аккумуляторы лучше других выдерживают вибрацию и способны до полной разрядки выдавать большой ток. Гелиевые батареи не боятся полной разрядки и способны восстанавливаться. Такие накопители лучше ставить на исправную машину в плане стабильности бортовой электрики, такой как генератор и др.
Преимущества таких АКБ положение установки, их можно устанавливать под углом, но меру знать тоже нужно. Еще такие аккумуляторы лучше других выдерживают вибрацию и способны до полной разрядки выдавать большой ток. Гелиевые батареи не боятся полной разрядки и способны восстанавливаться. Такие накопители лучше ставить на исправную машину в плане стабильности бортовой электрики, такой как генератор и др.
Принцип работы свинцово-кислотного АКБ
Это распространенные источники энергии, применяемые для механических транспортных средств. В первую очередь используются для заводки автомобиля и питания всей бортовой электрики.
Как работает аккумулятор? Принцип выглядит следующим образом: в сосуд с серной кислотой помещены свинец и диоксид свинца. В спокойном состоянии процесс не протекает, но как только к электродам подключается нагрузки происходит электрохимический процесс взаимодействия серной кислоты с оксидом свинца, который окисляется до сульфата свинца. Больше 60 химический реакций протекает во время этого процесса.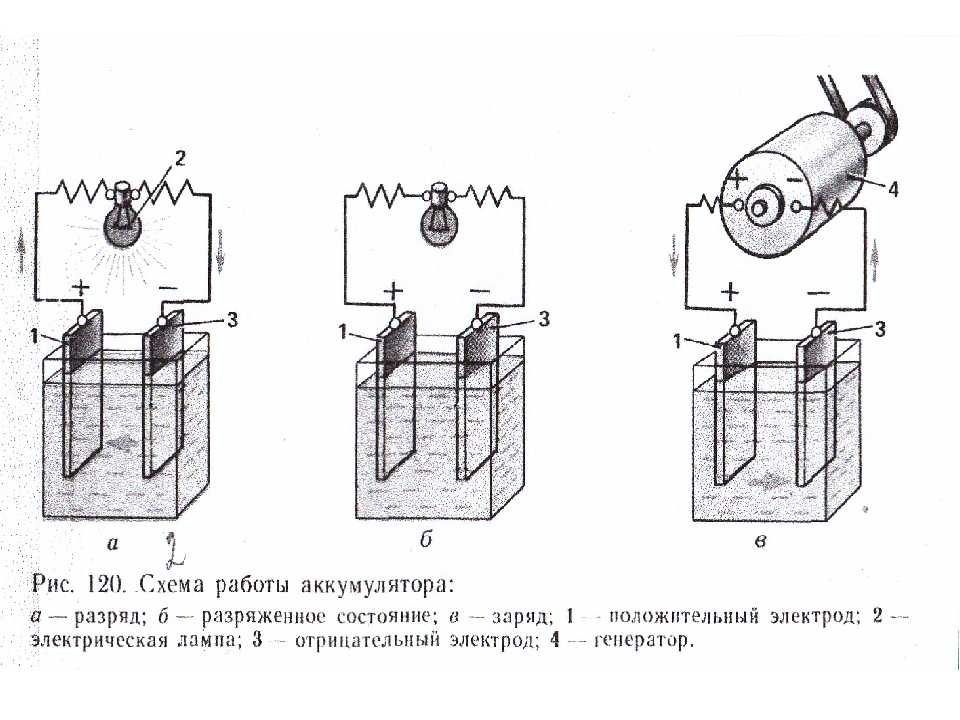 Формула выглядит так:
Формула выглядит так:
Принцип работы литий-ионного аккумулятора
Литий-ионные батареи зарекомендовали себя на мировом рынке лучшие накопители для современной техники, такой как смартфоны, ноутбуки, электромобили и другие виды домашней и производственной техники. В 1991 году впервые была выпущена литий-ионная батарея.
Напряжение такого источника составляет 3.7 В, около 800 циклов разряда/заряда способна выдержать это изобретение. Саморазряд составляет 2% в месяц. Работать такие элементы способны на температуре от -20 °C до +60 °C.
Принцип действия основан на электрохимической реакции лития при внедрении в кристаллическую решетку других материалов с образованием химической связи. Еще основной особенностью таких батарей является то, что они почти на 100% без эффекта памяти. Для определения этого факта проводили множество экспериментов и определили, что эффект памяти есть, но он настолько незначительный, что принято считать его нулевым.
Формула:
Совет! Для водителей, которые желают быстро запускать свой автомобиль на морозе.
За несколько минут до запуска двигателя включите ближний свет фар или другой потребитель. При этих действиях батарея «просыпается» и приходит в рабочее состояние. Были проведены эксперименты и установлено, что этот метод работает на практике.
Отличие Li-Pol, щелочных аккумуляторов от Ni-Cd и Ni-Mh.
Ni-Cd Никель-кадмиевые аккумуляторы
Данный вид аккумуляторов широко применяли несколько лет назад для различного инструмента. Такие источники в своей структуре содержат кадмий, который является тяжелым металлом и токсичен, но хорошо ведет себя на морозе и имеет не высокую стоимость.
Новые модели аккумуляторов раньше приходят в негодность, чем батареи выпущенные 20 лет назад. Но уровень технических характеристик присущий современным решениям намного выше, чем у их предшественников.
Ni-MH Никель-металлогидридные аккумуляторы
Такие батареи претерпели некоторые изменения по сравнению с Ni-Cd Никель-кадмиевыми. Избавились от токсичных металлов, стали легче по весу и теперь можно не боятся причинить вред окружающей среде при ликвидации таких аккумуляторов.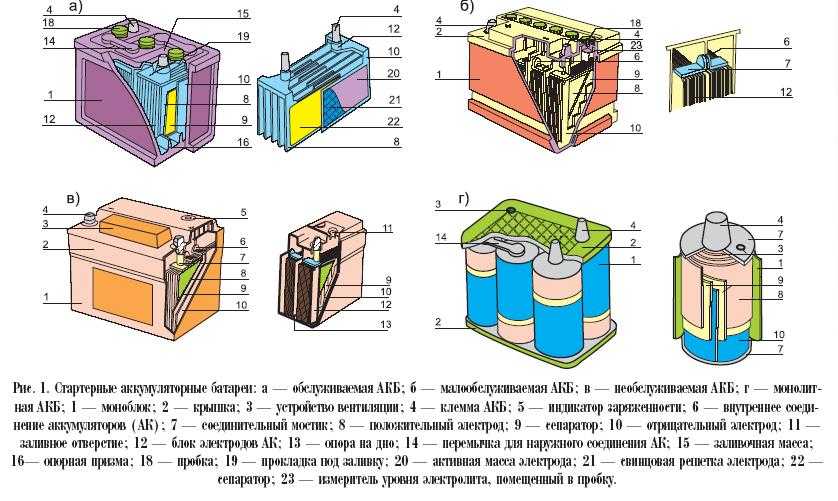 Еще удалось повысить энергоемкость и уменьшить эффект памяти.
Еще удалось повысить энергоемкость и уменьшить эффект памяти.
Li-Pol Литий-полимерный аккумуляторы
Вид этих аккумуляторов — улучшенная модернизация литий-ионных. Электролит был заменен полимерными материалами. Такие батареи установлены в смартфонах, планшетах, ноутбуках, цифровой фототехнике и др. Особенность таких источников энергии состоит в форме изготовления, она может быть очень тонкой, что позволяет поместить батарею в любой корпус. Главное преимущество литий-полимерных элементов питания в том, что они не имеют эффекта памяти и энергоемкие.
Щелочные аккумуляторы.
Широкое применение щелочные аккумуляторы нашли в бытовой технике. Известные модели таких батарей — тип ААА и АА. Они установлены в:
- детских игрушках
- портативных приборах
- карманных фонарях
- фото, видео аппаратуре
- аудио магнитофонах, плеерах и пр.
Щелочной электролит впервые нашел применение в химически активных источниках тока благодаря Вальдемару Джангнеру в 1899 году.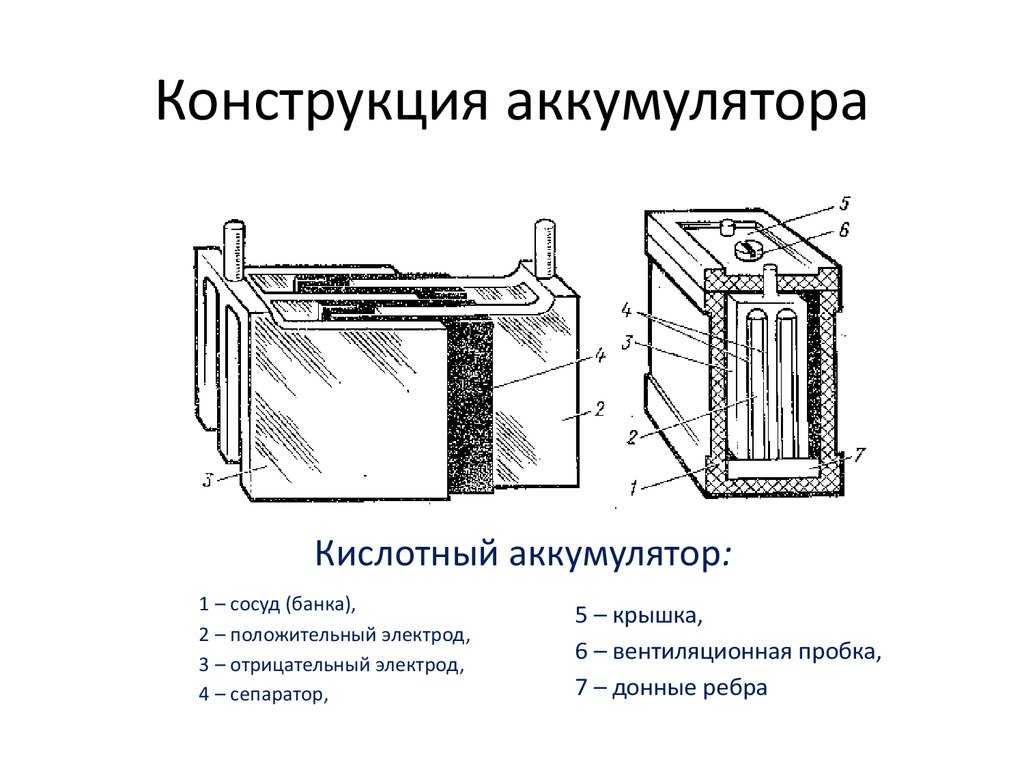 С этого времени ученые разных стран вовлечены в разработку щелочных источников питания.
С этого времени ученые разных стран вовлечены в разработку щелочных источников питания.
Принцип действия аккумуляторной батареи таков: при работе щелочного элемента происходит химическая реакция, при которой цинк окислившись выделяет гидроксид цинка, далее последний распадается на оксид цинка и воду. При этом происходит восстановление оксида марганца на катоде. Формула выглядит следующим образом:
| Таблица сравнения 4-х видов АКБ | ||||
| Вид аккумулятора | Ni-Cd | Ni-Mh | Щелочные АКБ | Li-Pol |
| Работа при низких температурах | + | + | + | — быстро теряет емкость |
| Цена | низкая | средняя | средняя | Высокая |
| Быстрая зарядка | + | + | — | + |
| Кол-во циклов разряда-заряда | 1000 | 300-500 | 300 | 1000-2000 |
| Токсичность | + | — | — | — |
| Эффект памяти | + | низкий | + | — |
| Саморазрядка | + | + | — | — |
Обычный аккумулятор оказывается сложной и в то же время простой вещью, если разобраться с ней.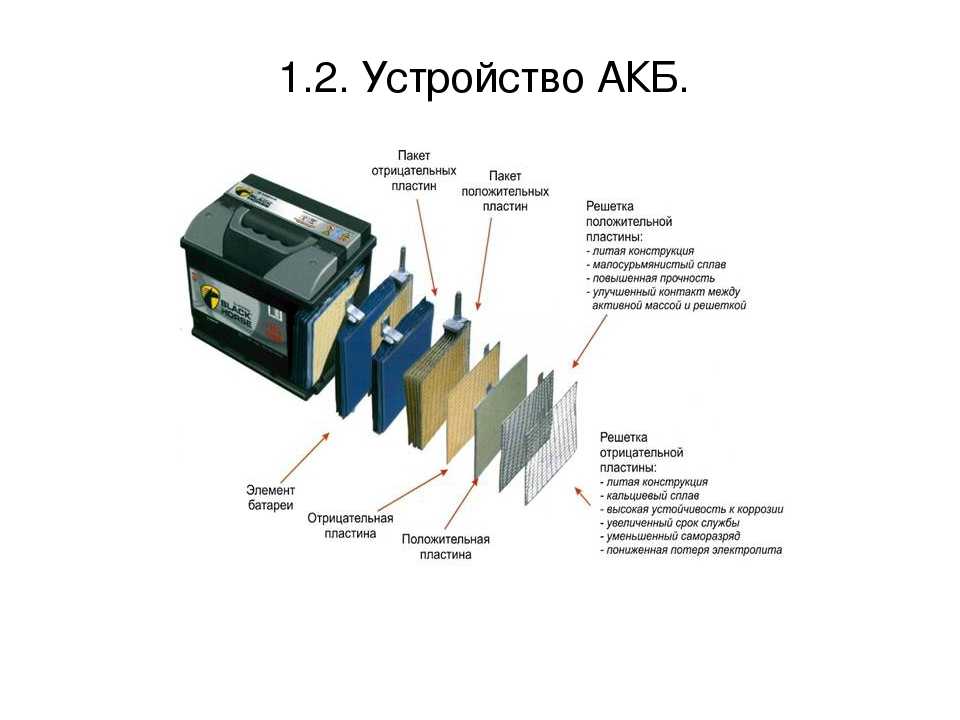 Прежде чем выбрать для авто элемент питания, стоит изучить нюансы, которые в последствии могут сыграют весомую роль в вашей жизни.
Прежде чем выбрать для авто элемент питания, стоит изучить нюансы, которые в последствии могут сыграют весомую роль в вашей жизни.
https://www.youtube.com/watch?v=Ip-BMxu8tZA
Принцип действия и устройство аккумуляторных батарей автомобиля
Принцип действия и устройство аккумуляторных батарей автомобиля
Аккумуляторная батарея предназначена для питания электрической энергией всех потребителей при неработающем двигателе и при работе его с малой частотой вращения коленчатого вала, а также для пуска двигателя стартером.
На автомобилях используют стартерные свинцово-кислот-ные аккумуляторные батареи. Такие батареи способны кратковременно отдавать ток большой величины, что необходимо при пуске двигателя стартером.
Аккумуляторная батарея состоит из трех, шести или двенадцати последовательно соединенных аккумуляторов напряжением 2В каждый. Аккумуляторные батареи выпускаются на 6, 12 и 24В. Простейший свинцово-кислотный аккумулятор представляет собой пластмассовый сосуд, в который опущены две свинцовые пластины и залит электролит из химически чистой (аккумуляторной) серной кислоты и дистиллированной воды. Если через такой аккумулятор пропускать постоянный электрический ток, то в нем будет протекать химическая реакция с образованием на положительной пластине двуокиси свинца, а на отрицательной — чистого губчатого свинца (Рb). Плотность электролита по мере заряда аккумулятора будет повышаться за счет выделения серной кислоты и поглощения воды. Напряжение на клеммах аккумулятора также будет повышаться. Такой процесс называется зарядом аккумулятора. При включении заряженного аккумулятора во внешнюю цепь будет происходить обратная химическая реакция с отдачей электрической энергии на питание включенных потребителей. По мере разряда пластины аккумулятора будут покрываться сернокислым свинцом, плотность электролита и напряжение аккумулятора будут уменьшаться. Такой процесс называется разрядом аккумулятора. После разряда необходимо вновь зарядить аккумулятор от источника постоянного тока. Поскольку при заряде и разряде аккумулятора изменяется плотность электролита, то по плотности электролита определяют степень раз-ряженности (заряженности) аккумулятора.
Если через такой аккумулятор пропускать постоянный электрический ток, то в нем будет протекать химическая реакция с образованием на положительной пластине двуокиси свинца, а на отрицательной — чистого губчатого свинца (Рb). Плотность электролита по мере заряда аккумулятора будет повышаться за счет выделения серной кислоты и поглощения воды. Напряжение на клеммах аккумулятора также будет повышаться. Такой процесс называется зарядом аккумулятора. При включении заряженного аккумулятора во внешнюю цепь будет происходить обратная химическая реакция с отдачей электрической энергии на питание включенных потребителей. По мере разряда пластины аккумулятора будут покрываться сернокислым свинцом, плотность электролита и напряжение аккумулятора будут уменьшаться. Такой процесс называется разрядом аккумулятора. После разряда необходимо вновь зарядить аккумулятор от источника постоянного тока. Поскольку при заряде и разряде аккумулятора изменяется плотность электролита, то по плотности электролита определяют степень раз-ряженности (заряженности) аккумулятора.
Рекламные предложения на основе ваших интересов:
Дополнительные материалы по теме:
Таким образом, действие аккумулятора основано на превращении электрической энергии в химическую при заряде и, наоборот, химической энергии в электрическую — при разряде.
Основными параметрами аккумулятора являются напряжение и емкость.
Напряжение на выводных штырях исправного и полностью заряженного аккумулятора около 2 В. Допускается в процессе эксплуатации разряжать аккумуляторы до 1,7 В.
Количество электричества в ампер-часах (А-ч), полученное от аккумулятора при его разряде до допустимого напряжения, называется емкостью, которую определяют как произведение силы разрядного тока в амперах на время разряда в часах. Емкость зависит от количества и размеров пластин аккумуляторов, силы разрядного тока, плотности и температуры электролита, а также степени заряженности, технического состояния и срока службы аккумулятора (батареи).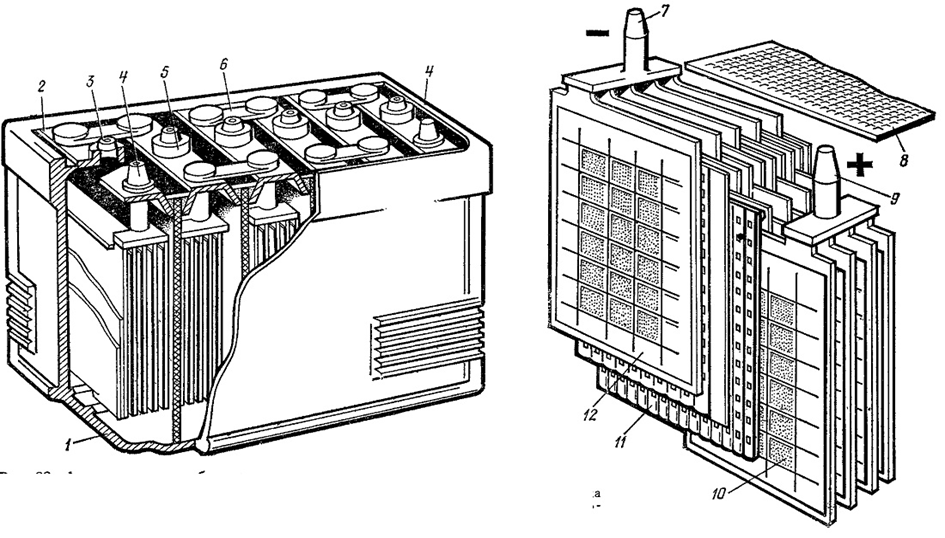
Номинальной емкостью аккумуляторной батареи называется наименьшее количество электричества в ампер-часах, которое должна отдать новая, полностью заряженная батарея при непрерывном разряде ее током, равным 0,05 номинальной емкости до напряжения 1,7 В при температуре электролита 25 °С. Номинальная емкость в основном зависит от размеров и количества пластин в аккумуляторе.
Каждый тип стартерной аккумуляторной батареи имеет свое условное обозначение, которое наносится на межэлементном соединении (перемычке) или на баке и означает:
— первое число (3, 6 или 12)—количество последовательно соединенных аккумуляторов в батарее;
— СТ или ТСТ — назначение батареи: стартерная или стартерная для тяжелых условий эксплуатации, соответственно;
— число после букв — номинальную емкость батареи, выраженную в ампер-часах.
Остальные буквы означают:
— Э, П, Т — материал бака, соответственно: эбонит, пластмасса асфальтопековая, термопластмасса;

Например, условное обозначение батареи 6СТ-90ЭМС указывает, что батарея состоит из шести последовательно соединенных аккумуляторов, стартерная, номинальная емкость батареи 90 А-ч, бак эбонитовый, а сепараторы двойные — мипласт со стекловолокном.
На автомобилях ГАЗ-66 и ГАЗ-53А устанавливается аккумуляторная батарея 6СТ-75ЭМС. Батарея состоит из шести последовательно соединенных аккумуляторов, размещенных в шестикамерном эбонитовом баке. Каждый аккумулятор включает в себя пять положительных и шесть отрицательных пластин. Положительные и отрицательные пластины представляют собой свинцовые решетки, заполненные активной массой, которая и участвует в химических реакциях при зарядах и разрядах аккумулятора. После сложной технологической обработки пластин активная масса положительных пластин превращается в двуокись свинца (РЬОг) (темно-коричневого цвета), а отрицательных — в губчатый свинец (Рb) (серого цвета).
Однородные пластины аккумулятора соединяются между собой с помощью бареток 5 и образуют полублоки положительных и отрицательных пластин.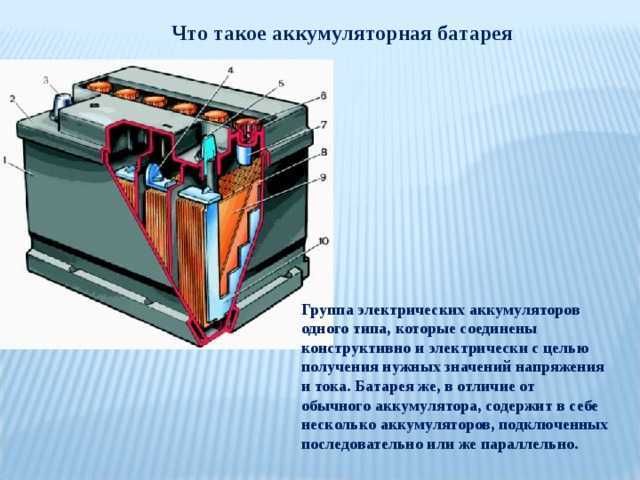 Чтобы предотвратить соприкосновение разноименных пластин, между ними установлены прокладки — сепараторы. Ребристая сторона сепаратора всегда обращена к положительной пластине. При такой установке сепараторов обеспечивается лучший доступ электролита в поры активной массы положительных пластин, что повышает работоспособность аккумулятора.
Чтобы предотвратить соприкосновение разноименных пластин, между ними установлены прокладки — сепараторы. Ребристая сторона сепаратора всегда обращена к положительной пластине. При такой установке сепараторов обеспечивается лучший доступ электролита в поры активной массы положительных пластин, что повышает работоспособность аккумулятора.
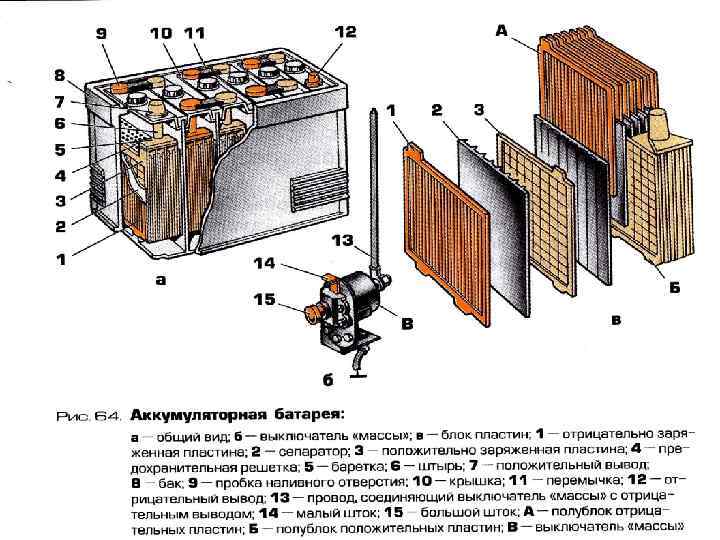
Рис. 1. Аккумуляторная батарея:
1 — отрицательная пластина; 2 — сепаратор: 3 — положительная пластина; 4 — предохранительный щиток; 5 —баретка: 6 — штырь: 7 — плюсовая клемма; 8 — бак аккумуляторной батареи; 9 — уплотнительная мастика: 10 — пробка; 11 — крышка аккумулятора; 12 — межэлементное соединение; 13 — вентиляционное отверстие; 14 — минусовая клемма
Для защиты кромок сепараторов и пластин от .механических повреждений при замере плотности и уровня электролита сверху положен предохранительный щиток из кислотостойкого материала.
Сверху каждый аккумулятор закрывается крышкой II с двумя отверстиями для полюсных штырей от положительных и отрицательных пластин. В крышках также выполнены резьбовые отверстия под пробку для залива электролита и штуцеры с вентиляционными отверстиями для автоматической установки уровня электролита. На некоторых батареях 6СТ-75ЭМС штуцера может и не быть. У них вентиляционное отверстие выполнено в пробке. Стыки между крышкой и баком залиты мастикой.
В крышках также выполнены резьбовые отверстия под пробку для залива электролита и штуцеры с вентиляционными отверстиями для автоматической установки уровня электролита. На некоторых батареях 6СТ-75ЭМС штуцера может и не быть. У них вентиляционное отверстие выполнено в пробке. Стыки между крышкой и баком залиты мастикой.
На дне бака выполнены ребра, на которые опираются полублоки пластин. В пространстве между ребрами скапливается осыпающаяся со временем активная масса (шлам), что на гарантийный срок исключает за.мыкание разноименных пластин.
Аккумуляторы соединяют между собой с помощью межэлементных соединений, которые привариваются к штырям полублоков. Крайние штыри аккумуляторной батареи выполняют роль плюсовой и минусовой клемм.
Камеры аккумуляторов изолированы друг от друга. Через резьбовые отверстия крышек в аккумуляторы заливается электролит.
Плотность электролита должна соответствовать климатическому району, в котором эксплуатируется батарея.
Минусовая клемма батареи соединена с массой автомобиля через выключатель батареи, а плюсовая — с бортовой сетью.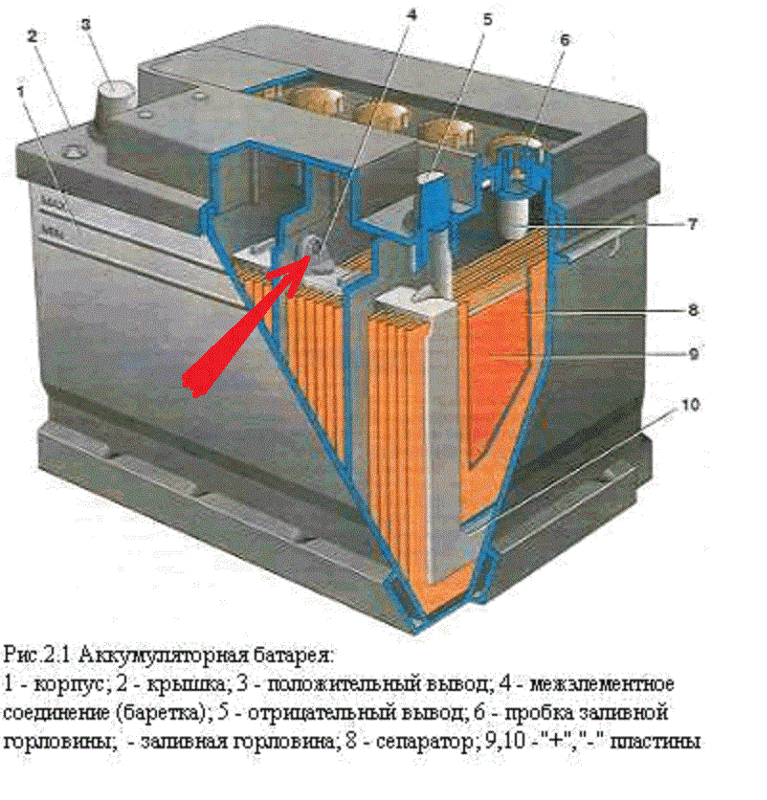 Для уменьшения падения напряжения на проводах и их нагрева батарея подсоединена к сети проводами большого сечения.
Для уменьшения падения напряжения на проводах и их нагрева батарея подсоединена к сети проводами большого сечения.
На автомобилях ЗИЛ-131 и ЗИЛ-130 используется батарея 6СТ-ЭМС. По устройству она аналогична батарее 6СТ-75ЭМС, но имеет в каждом аккумуляторе по шесть положительных и семь отрицательных пластин, что увеличивает ее емкость.
На автомобиле ЗИЛ-131 к батарее могут придаваться гидростатические пробки, которые исключают попадание воды в аккумуляторы при преодолении глубокого брода.
На автомобиле «Урал-375Д» устанавливается батарея типа 6СТЭН-140М. Ее особенностью является наличие деревянного ящика, в котором размещаются шесть эбонитовых баков. Клеммы выведены на панель ящика и защищены съемной коробкой. Емкость батареи повышена за счет увеличения количества и площади пластин.
Инженерная школа Массачусетского технологического института | » Как работает батарея?
Как работает батарея?
Ваши часы, ноутбук и лазерная указка питаются от одного и того же: химии…
Автор: Мэри Бейтс .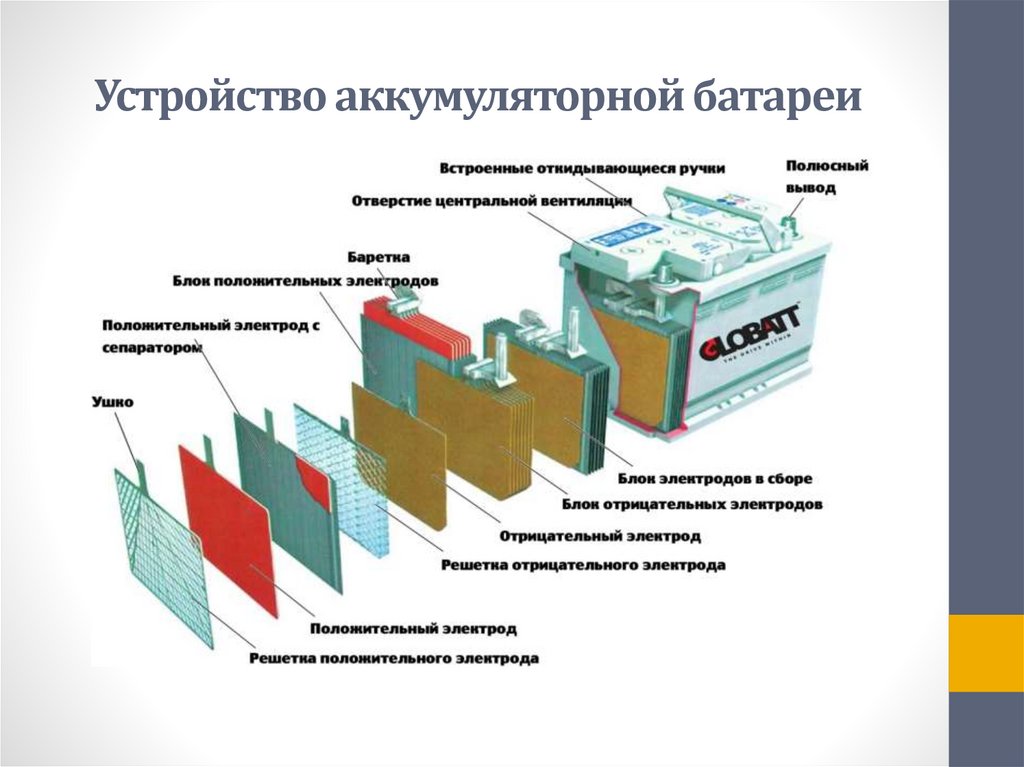 «Аккумулятор — это устройство, способное накапливать электрическую энергию в виде химической энергии и преобразовывать эту энергию в электричество», — говорит Антуан Алланоре, научный сотрудник факультета материаловедения и инженерии Массачусетского технологического института. «Вы не можете поймать и сохранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».
«Аккумулятор — это устройство, способное накапливать электрическую энергию в виде химической энергии и преобразовывать эту энергию в электричество», — говорит Антуан Алланоре, научный сотрудник факультета материаловедения и инженерии Массачусетского технологического института. «Вы не можете поймать и сохранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».
Батарея состоит из трех основных компонентов: две клеммы, изготовленные из разных химических веществ (обычно металлов), анод и катод; и электролит, который разделяет эти клеммы. Электролит представляет собой химическую среду, которая обеспечивает протекание электрического заряда между катодом и анодом. Когда устройство подключено к батарее — лампочке или электрической цепи — на электродах происходят химические реакции, которые создают поток электрической энергии к устройству.
Более конкретно: во время разряда электричества химическое вещество на аноде высвобождает электроны на отрицательную клемму и ионы в электролит посредством так называемой реакции окисления. Между тем, на положительной клемме катод принимает электроны, замыкая цепь потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновешиваться от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию. «Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и именно это генерирует электрический ток».
Между тем, на положительной клемме катод принимает электроны, замыкая цепь потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновешиваться от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию. «Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и именно это генерирует электрический ток».
Если батарея одноразовая, она будет производить электричество до тех пор, пока не закончатся реагенты (одинаковый химический потенциал на обоих электродах). Эти батареи работают только в одном направлении, преобразуя химическую энергию в электрическую. Но в других типах аккумуляторов реакция может быть обратной. Перезаряжаемые батареи (например, в вашем мобильном телефоне или в вашем автомобиле) сконструированы таким образом, что электрическая энергия из внешнего источника (зарядное устройство, которое вы подключаете к стене, или динамо-машина в вашем автомобиле) может быть применена к химической системе и наоборот. его работы, восстанавливая заряд аккумулятора.
его работы, восстанавливая заряд аккумулятора.
Лаборатория Group Sadoway в Массачусетском технологическом институте работает над созданием более эффективных аккумуляторов для многократного использования. Для крупномасштабного хранения энергии команда работает над жидкометаллической батареей, в которой электролит, анод и катод являются жидкими. Для портативных приложений разрабатывается тонкопленочная полимерная батарея с гибким электролитом из негорючего геля. Еще одной целью лаборатории является создание аккумуляторов с использованием ранее не рассматривавшихся материалов, с упором на широко распространенные, дешевые и безопасные вещества, которые имеют такой же коммерческий потенциал, как и популярные литиевые аккумуляторы.
Спасибо 18-летнему Стивену Минкусу из Гленвью, Иллинойс, за этот вопрос.
Posted: May 1, 2012
Battery Operated Devices and Systems
Select country/regionUnited States of AmericaUnited KingdomAfghanistanÅland IslandsAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntigua and BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelgiumBelizeBeninBermudaBhutanBoliviaBonaire, Sint Eustatius and SabaBosnia and HerzegovinaBotswanaBrazilBritish Indian Ocean TerritoryBritish Virgin IslandsBruneiBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCanary IslandsCape VerdeCayman IslandsCentral African RepublicChadChileChinaChristmas IslandCocos ( Килинг) островаКолумбияКоморыКонгоострова КукаКоста-РикаХорватияКубаКюрасаоКипрЧехияДемократическая Республика КонгоДанияДжибутиДоминикаДоминиканская РеспубликаЭквадорЕгипетЭль-СальвадорЭкваториальная ГвинеяЭритреяЭстонияЭфиопияФолклендские (Мальвинские) островаФарерские островаФедеративные Штаты МикронезииФиджиГамбон ФинляндияФранцияГамбонФранцияФранцияГубон biaGeorgiaGermanyGhanaGibraltarGreeceGreenlandGrenadaGuadeloupeGuamGuatemalaGuernseyGuineaGuinea-BissauGuyanaHaitiHondurasHong KongHungaryIcelandIndiaIndonesiaIranIraqIrelandIsle of ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKuwaitKyrgyzstanLaoLatviaLesothoLiberiaLibyaLiechtensteinLuxembourgMacaoMacedoniaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMoldovaMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNiueNorfolk IslandNorth KoreaNorthern Mariana IslandsNorwayOmanPakistanPalauPanamaPapua New GuineaParaguayPeruPhilippinesPitcairnPolandPortugalPuerto RicoQatarRéunionRomaniaRwandaSaint BarthélemySaint HelenaSaint Kitts and NevisSaint LuciaSaint Martin (French part)Saint Pierre and MiquelonSaint Vincent and the GrenadinesSamoaSan MarinoSao Tome and PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Maarten (Dutch part)SlovakiaSlov eniaSolomon IslandsSomaliaSouth AfricaSouth Georgia and the South Sandwich IslandsSouth KoreaSouth SudanSpainSri LankaSudanSurinameSvalbard and Jan MayenSwazilandSwedenSwitzerlandSyriaTaiwanTajikistanTanzaniaThailandTimor LesteTogoTokelauTongaTrinidad and TobagoTunisiaTurkeyTurkmenistanTurks and Caicos IslandsTuvaluUgandaUkraineUnited Arab EmiratesUruguayUS Virgin IslandsUzbekistanVanuatuVatican CityVenezuelaVietnamWallis and FutunaWestern SaharaYemenZambiaZimbabwe
Варианты покупки Компания (хард -переплет, электронная книга) 50% скин. $164,50
$164,50
Налог с продаж будет рассчитываться при оформлении заказа
Бесплатная доставка по всему миру
Минимальный заказ не указан новейшие технологические разработки. Книга охватывает самые последние тенденции, особенно для вездесущих литий-ионных аккумуляторов. Особое внимание уделяется энергопотреблению устройств и систем с батарейным питанием, а также последствиям для срока службы батареи и времени работы. Управление батареями также подробно рассматривается, особенно в том, что касается методов зарядки, а также критериев выбора батареи. В этой книге описываются различные портативные и промышленные устройства, а также основные характеристики всех первичных и вторичных батарей, используемых в этих приложениях. Портативные приложения включают мобильные телефоны, ноутбуки, фотоаппараты, видеокамеры, персональные цифровые помощники, медицинские инструменты, электроинструменты и портативные GPS. Промышленные приложения варьируются от аэрокосмической и телекоммуникационной до аварийных систем, выравнивания нагрузки, хранения энергии, сбора платы за проезд, различных счетчиков, регистраторов данных, бурения нефтяных скважин, океанографии и метеорологии. В книге также обсуждается беспроводная связь, т. е. Wi-Fi, Bluetooth и Zigbee, и в заключение приводятся некоторые рыночные соображения. Ссылки для дальнейшего чтения предоставляются через 275 ссылок. Эта книга будет ценным источником информации для исследователей, интересующихся устройствами и системами, питающимися от батарей. Он также понравится выпускникам, работающим в научно-исследовательских учреждениях; университеты и предприятия, занимающиеся источниками энергии и преобразованием энергии; инженеры-строители, электрики и транспортники; и химики.
В книге также обсуждается беспроводная связь, т. е. Wi-Fi, Bluetooth и Zigbee, и в заключение приводятся некоторые рыночные соображения. Ссылки для дальнейшего чтения предоставляются через 275 ссылок. Эта книга будет ценным источником информации для исследователей, интересующихся устройствами и системами, питающимися от батарей. Он также понравится выпускникам, работающим в научно-исследовательских учреждениях; университеты и предприятия, занимающиеся источниками энергии и преобразованием энергии; инженеры-строители, электрики и транспортники; и химики.
Основные характеристики
- Подробный обзор применения аккумуляторов
- Включает 209 рисунков и 62 таблицы
- Описывает современные технологические разработки источники питания и преобразования энергии, инженеры-строители, инженеры-электрики и транспортники, а также химики
Содержание
- Глава 1
Области применения аккумуляторов
1.1. Введение
1.2. Секторы применения и рыночные соображения
1. 2.1. Вычислительная техника
2.1. Вычислительная техника
1.2.2. Связь
1.2.3. Портативные инструменты
1.2.4. Медицинские приложения
1.2.5. Другие портативные устройства
1.2.6. ИБП и резервные батареи
1.2.7. Аэрокосмическая и военная промышленность
1.2.8. Электромобили и гибридные электромобили
1.2.9. Автомобили с двигателем внутреннего сгорания (ДВС)
1.3. Срок службы приложений и батареи
Каталожные номераГлава 2
Категории и типы батарей
2.1. Введение
2.2. Батареи для портативных устройств
2.2.1. Цинк-угольные батареи
2.2.2. Щелочные батареи
2.2.3. Первичные батареи на основе оксида цинка/оксида серебра
2.2.4. Первичные воздушно-цинковые батареи
2.2.5. Сильные и слабые стороны и основные области применения первичных аккумуляторов на водной основе
2.3. Батареи, используемые как в портативных, так и в промышленных/автомобилях
2.3.1. Первичные литиевые батареи
2.3.1.1. Литий-диоксидные батареи
2. 3.1.2. Литий/тионилхлоридные батареи
3.1.2. Литий/тионилхлоридные батареи
2.3.1.3. Литий-диоксид-марганцевые батареи
2.3.1.4. Литий/угольные монофторидные батареи
2.3.1.5. Сравнение первичных литиевых батарей и рыночных соображений
2.3.2. Перезаряжаемые литиевые батареи (Li отрицательный электрод)
2.3.3. Литий-ионные батареи
2.3.4. Аккумуляторы на водной основе
2.3.4.1. Свинцово-кислотные аккумуляторы
2.3.4.2. Никель-кадмиевые батареи
2.3.4.3. Никель-металлогидридные батареи
2.3.4.4. Вторичные батареи из оксида цинка/оксида серебра
2.3.4.5. Сравнение главных вторичных батарей
2.4. Аккумуляторы, используемые только в промышленных/автомобилях
2.4.1. Вторичные водные батареи
2.4.1.1. Никель-водородные батареи
2.4.1.2. Никель-железные батареи
2.4.1.3. Никель-цинковые батареи
2.4.1.4. Большие воздушно-цинковые батареи
2.4.1.5. Цинк/бромные батареи
2.4.1.6. Ванадиевые окислительно-восстановительные батареи (VRB)
2. 4.2. Тепловые батареи
4.2. Тепловые батареи
1. Литий-алюминиевые/железо-сульфидные батареи
2. Натриевые/серные батареи
3. Натрий-никель-хлоридные (Zebra) батареи
4. Литий-металло-полимерные батареи
СсылкиГлава 3
Портативные приложения
3.1. Общие соображения
3.2. Характеристики некоторых приложений
A. Видео/аудиоприложения
3.2.1. Ноутбуки, планшеты и ультрамобильные ПК (UMPC)
3.2.2. Электронные книги
3.2.3. Сотовые телефоны и смартфоны
3.2.4. Персональные цифровые помощники (КПК)
3.2.5. Мобильное ТВ
3.2.6. Цифровые фотокамеры (DSC)
3.2.7. Цифровые видеокамеры
3.2.8. Портативные плееры
3.2.9. Портативные телефоны VoIP (передача голоса по протоколу Интернет)
3.2.10. Профессиональное аудио/видео оборудование
B. Медицинское оборудование
B1. Счетчики
3.2.11. Глюкометр
3.2.12. Пульсоксиметрия
3.2.13. Разное
B2. Терапевтические устройства
3.2.14. CPR (сердечно-легочная реанимация) и AED (автоматический внешний дефибриллятор
)
3. 2.15. Кардиостимуляторы и другие портативные устройства для управления сердечным ритмом
2.15. Кардиостимуляторы и другие портативные устройства для управления сердечным ритмом
3.2.16. Другие терапевтические устройства
B3. Диагностические приборы
B4. Разные медицинские устройства
C. Разное применение
3.2.17. Любительские и профессиональные электроинструменты
3.2.18. Портативные считыватели штрих-кодов
3.2.19. Портативные платежные терминалы
3.2.20. Ручной GPS (система глобального позиционирования)
3.2.21. Рыболовные принадлежности
3.3. Управление питанием портативных устройств
A. Управление питанием компонентов устройства
3.3.1. Транзисторы
3.3.2. Микропроцессоры и микроконтроллеры
3.3.3. Регуляторы напряжения
3.3.4. Радиочастотная связь
3.3.5. Дисплей
3.3.6. Питание и защита порта
3.3.7. Дополнительное освещение
3.3.8. Жесткие диски
B. Управление температурным режимом компонентов устройства
C. Управление батареями
3.3.9. Концепция Smart Battery
3. 3.10. Использование аккумуляторных батарей в экстремальных условиях
3.10. Использование аккумуляторных батарей в экстремальных условиях
3.3.11. Радиочастотные помехи
3.3.12. Зарядка аккумулятора
3.4. Тенденции в выборе аккумуляторов для портативных устройств
СсылкиГлава 4
Промышленное применение (кроме дорожных транспортных средств)
4.1. Введение
4.2. Счетчики
4.2.1. Измерители мощности
4.2.2. Счетчики газа
4.2.3. Счетчики воды
4.2.4. Теплосчетчики
4.2.5. Расходомеры
4.2.6. Прочие счетчики
4.2.7. Счетчики с функцией AMR
4.3. Регистраторы данных
4.4. Сенсоры и сенсорные сети
4.5. Сигнализация и системы безопасности
4.5.1. Портативное видеонаблюдение
4.5.2. Беспроводные будильники
4.5.3. Дистанционное управление уровнем
4.5.4. Наблюдение за линиями электропередач
4.5.5. Контрольно-измерительные приборы для трубопроводов (PIG)
4.5.6. Системы контроля доступа
4.6. Автоматические вспомогательные системы
4. 6.1. Аварийное освещение
6.1. Аварийное освещение
4.6.2. Маяки
4.6.3. Автоматическое уведомление о сбое (ACN)
4.7. Бурение нефтяных скважин
4.8. Океанография
4.8.1. Измерители тока
4.8.2. GPS-буи
4.8.3. Сейсмометрия
4.8.3.1. Обнаружение цунами
4.8.4. Подводные планеры
4.8.5. Местоположение Argos System
4.9. Системы слежения и мониторинга
4.9.1. Радиочастотная идентификация (RFID)
4.9.1.1. Электронный сбор платы за проезд (ETC)
4.9.2. Спутниковое слежение
4.9.2.1. Созвездие GPS
4.10. Метеорология и атмосферные науки
4.10.1. Метеорологические спутники
4.10.2. Пусковые установки
4.10.3. Портативные станции мониторинга погоды и окружающей среды
4.11. Аэрокосмические приложения
4.11.1. Самолет
4.11.2. Планетарные и космические исследования
4.11.2.1. Роботизированное исследование космоса
4.11.2.2. Миссии по исследованию человека
4.11.2.3. Общие характеристики космических батарей
4. 11.2.4. Примеры миссий
11.2.4. Примеры миссий
4.12. Военное применение
4.12.1. Боеприпасы
4.12.2. Беспилотные авиационные системы
4.12.3. Солдатское снаряжение
4.12.4. Разное военно-морское применение
4.13. Робототехника
4.13.1. Подробная информация об оборудовании робота
4.13.2. Примеры мобильных автономных роботов
4.13.2.1. Мобильные микророботы
4.14. Микроэлектромеханические системы (МЭМС)
4.15. Сельскохозяйственные приложения
4.16. Стационарные приложения, связанные с энергетикой
4.16.1. Выравнивание нагрузки, качество электроэнергии и ИБП
4.16.2. Телекоммуникации
4.17. Часы реального времени и резервное копирование памяти
4.18. Беспроводная связь
Каталожные номераГлава 5
Применение в транспортных средствах: системы тяги и управления
5.1. Введение
5.2. Электромобили (ЭМ)
5.2.1. Новые предложения: будут ли они успешными?
5.3. Основы гибридных электромобилей (HEV)
5. 3.1. Микрогибриды
3.1. Микрогибриды
5.3.2. Мягкие гибриды
5.3.3. Мягкие гибриды
5.3.4. Полные гибриды или Power Assist
5.3.5. Подключаемые гибриды (PHEV)
5.3.6. Гибридный электромобиль на топливных элементах (FCHEV)
5.3.7. Большие гибридные автомобили: автобусы, легкие грузовики и трамваи
5.4. Дополнительная информация о гибридных автомобилях
5.4.1. Современное производство ГЭМ и перспективы
5.4.2. Тойота Приус
5.5. Тяговые батареи
5.5.1. Общие требования
5.5.2. Система управления батареями (BMS)
5.5.3. Аккумуляторные технологии
5.5.3.1. Свинцово-кислотные аккумуляторы
5.5.3.2. Ni-MH батареи
5.5.3.3. Литий-ионные аккумуляторы
5.5.3.4. Другие химические вещества для аккумуляторов
5.6. Системы управления транспортными средствами
5.6.1. Последние разработки в области автомобильных свинцово-кислотных аккумуляторов
5.7. Электрические велосипеды
Каталожные номераСписок сокращений
Информация о продукте
- Количество страниц: 408
- Язык: английский
- Авторские права: © Elsevier Science 2008
- Опубликовано: 24 сентября 2008 г.

- Глава 1


 Преследовалась цель не дать клиенту перепутать контакты местами и сделать «короткое замыкание» в электрике автомобиля.
Преследовалась цель не дать клиенту перепутать контакты местами и сделать «короткое замыкание» в электрике автомобиля. За несколько минут до запуска двигателя включите ближний свет фар или другой потребитель. При этих действиях батарея «просыпается» и приходит в рабочее состояние. Были проведены эксперименты и установлено, что этот метод работает на практике.
За несколько минут до запуска двигателя включите ближний свет фар или другой потребитель. При этих действиях батарея «просыпается» и приходит в рабочее состояние. Были проведены эксперименты и установлено, что этот метод работает на практике.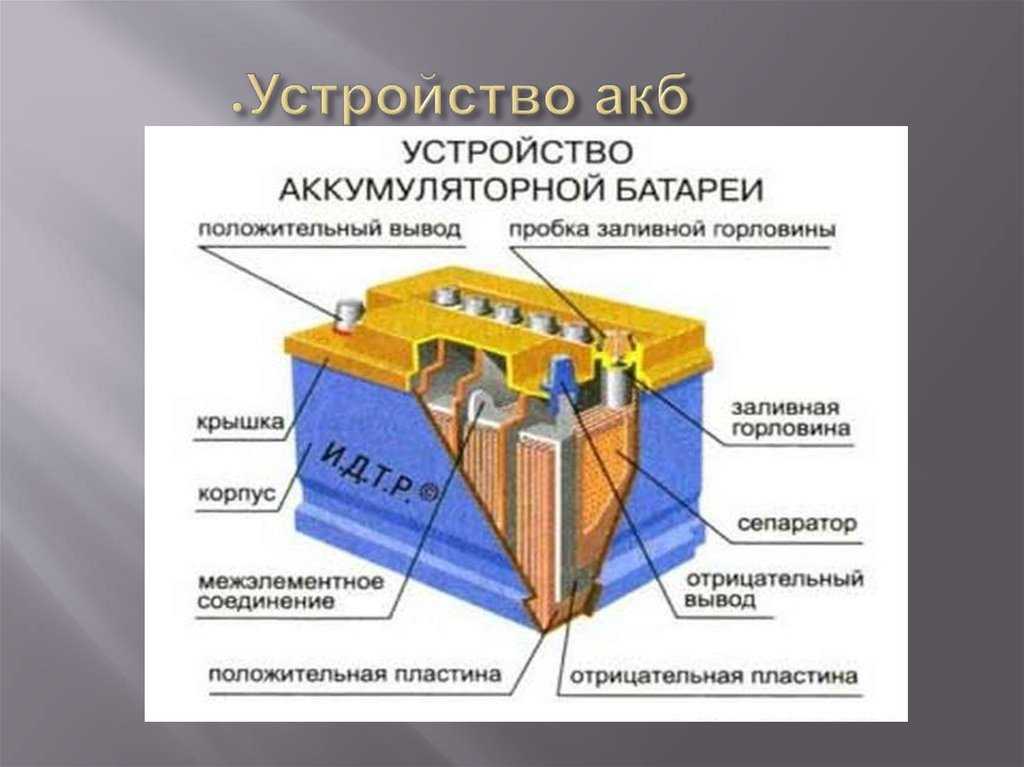 2.1. Вычислительная техника
2.1. Вычислительная техника  3.1.2. Литий/тионилхлоридные батареи
3.1.2. Литий/тионилхлоридные батареи  4.2. Тепловые батареи
4.2. Тепловые батареи  2.15. Кардиостимуляторы и другие портативные устройства для управления сердечным ритмом
2.15. Кардиостимуляторы и другие портативные устройства для управления сердечным ритмом  3.10. Использование аккумуляторных батарей в экстремальных условиях
3.10. Использование аккумуляторных батарей в экстремальных условиях  6.1. Аварийное освещение
6.1. Аварийное освещение  11.2.4. Примеры миссий
11.2.4. Примеры миссий  3.1. Микрогибриды
3.1. Микрогибриды 