Аккумулятор — Что такое Аккумулятор?
19208
Для создания аккумуляторной батареи, несколько аккумуляторов соединяют в одну цепь.
Аккумулятор — это многоразовый источник тока, который предназначен для накопления и хранения энергии.
Его работа основана на обратимых окислительно-восстановительных реакциях, что дает возможность использовать батарею многократно.
Для создания аккумуляторной батареи, несколько аккумуляторов соединяют в одну цепь.
Батареи — это электрохимические устройства, которые преобразуют активные материалы более высокого уровня в альтернативное состояние во время разряда.
Скорость такой преобразования определяет нагрузочные характеристики аккумулятора.
Никелевые и литиевые батареи превосходят свинцовые батареи по скорости реакции.
Для бытовых приборов и инструментов используется несколько типов аккумуляторных батарей, которые отличаются по используемым для их изготовления материалам.
Никель-кадмиевые (NiCd)
Никель-кадмиевые батареи:
- являются одними из самых долговечных аккумуляторов с точки зрения срока службы.
- способны выдерживать большое количество разрядов и зарядов, устойчивы к низким температурам, также у них большой допустимый ток разряда.
- имеют низкую цену и большой срок службы.
Недостатки :
- быстро саморазряжается,
- имеет низкую плотность энергии,
- имеет «эффект памяти», что приводит к снижению полезной емкости при неполном разряде батареи.
Для восстановления номинальной мощности, надо полностью разрядить, а потом снова зарядить это устройство.

Для заряда надо использовать только то устройство, которое шло в комплекте, либо таким, которое соответствует требованиям производителя батареи.
Никель-металлогидридные (NiMh)
Эта батарея предлагает до 50% больше энергии, чем никель-кадмиевые.
Имеет короткий срок службы.
Такие батареи появились позже, и они являются более перспективными.
Сейчас они массово используются для разной бытовой техники, но для телефонов и ноутбуков применяются еще более прогрессивные виды.
Литий-ионные (LiIon)
Среди аккумуляторов имеют самую высокую плотность энергии и самые легкие.
Чаще всего используется для питания ноутбуков, фотоаппаратов и другой техники, но в современных телефонах они уже используются редко, т. к. вытесняются более прогрессивным типом батарей.
Их основной недостаток в высокой чувствительности к перезаряду, поэтому в устройствах, где используются такие батареи, обязательно устанавливают контроллер, который ограничивает заряд.

Литий-полимерные (LiPol)
Самые современные устройства.
Основным их отличием является то, что электролит гелеобразный, поэтому такие аккумуляторы могут быть очень тонкими.
Они чаще всего применяются в мобильных телефонах, плеерах и другой технике, имеющей небольшие размеры.
Т. к. такие батареи также чувствительны к перезаряду, использовать их в устройствах с неисправным контроллером заряда нельзя.
Независимо от типа, любой аккумулятор работает благодаря наличию разности напряжения между пластинами из металла, погруженными в электролит.
Химические процессы, происходящие в батарее, являются обратимыми, поэтому после ее разряжения, есть возможность при помощи заряда восстановить работоспособность.
Во время заряда ток пропускают в направлении, противоположном тому, которое будет при разряде аккумуляторной батареи.
Основной характеристикой аккумулятора является емкость, т. е. величина заряда, которую полностью заряженная батарея может отдать при разряде до наименьшего допустимого значения.
Для ее измерения обычно используют Ач.
Промышленные аккумуляторы:
- обычно крупнее аккумуляторов, используемых в потребительских товарах,
- имеют более длительный срок службы,
- сконструированы таким образом, чтобы выдерживать ряд условий, которые не могут выдержать потребительские батареи;
- примеры:
- батареи, используемые для контроля структурных нагрузок на мосты,
- вилочные погрузчики, где надлежащее обслуживание и системы зарядки имеют решающее значение;
- номенклатура промышленных аккумуляторов гораздо шире, нежели бытовых;
- стоимость выше, чем потребительских аккумуляторов;
- нуждаются в обслуживании, чтобы обеспечить их эффективную работу как можно дольше.

#аккумулятор #батарея
Последние новости
Что такое аккумулятор?
Аккумулятор — химический источник тока, в котором энергия химической реакции многократно преобразуется в электрическую и наоборот. Таким образом, аккумулятор, имея возможность преобразовывать химическую энергию в электрическую, способен запасать ее и хранить в течение длительного времени. Заряжаясь, аккумулятор накапливает электрическую энергию, разряжаясь, отдает ее потребителю.
Первый аккумулятор (прототип современного свинцово-кислотного) был создан в 1860
г. Гастоном Планте и представлял собой две свинцовые полосы, разделенные пористым
изолятором и помещенные в раствор серной кислоты. Выполненный по такой схеме единичный
аккумуляторный элемент способен обеспечивать напряжение на выходе около 2 вольт.
Емкость такого аккумулятора была невелика, и рабочие характеристики достигались
только после многократных зарядно-разрядных циклов.
Положительно заряженная пластина (электрод) представляет собой свинцовую решетку с активной массой из двуокиси свинца (PbO2), а электрод со знаком минус — решетку с активной массой из губчатого свинца (Pb). Во избежание возникновения короткого замыкания между пластинами, их разделяют пористыми сепараторами из изоляционного материала. Собранные блоки помещаются в корпус и заливаются электролитом (раствором серной кислоты плотностью 1.27-1.29 г/см 3).
Если к аккумулятору подключить нагрузку, то свинцовые пластины с активной массой,
электролит и нагрузка образуют замкнутую цепь. Внутри аккумулятора начинается химическая
реакция, в результате которой активная масса обоих электродов начнет менять первоначальный
состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат
свинца PbSO4), а плотность электролита начинает падать. В итоге, в цепи
образуется направленное движение ионов, и течет электрический ток. Такой процесс
представляет собой разряд аккумулятора. При подключении к аккумулятору внешнего
источника тока начинается обратный процесс — заряд. При заряде активная масса пластин
восстанавливает свой первоначальный состав, плотность электролита растет. Эти химические
процессы можно описать следующими уравнениями:
Внутри аккумулятора начинается химическая
реакция, в результате которой активная масса обоих электродов начнет менять первоначальный
состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат
свинца PbSO4), а плотность электролита начинает падать. В итоге, в цепи
образуется направленное движение ионов, и течет электрический ток. Такой процесс
представляет собой разряд аккумулятора. При подключении к аккумулятору внешнего
источника тока начинается обратный процесс — заряд. При заряде активная масса пластин
восстанавливает свой первоначальный состав, плотность электролита растет. Эти химические
процессы можно описать следующими уравнениями:
| 1 – отpицательная пластина; 2 – сепаpатоp; 3 – положительная пластина; 4 – пpедохpанительная сетка; 5 – баpетка; 6 – штыpь; 7 – моноблок; 8 – уплотнительная мастика; 9 – положительный вывод; 10 – пpобка наливного отвеpстия; 11 – межэлементная пеpемычка; 12 – кpышка; 13 – отpицательный вывод |
— на положительной пластине: PbO2 + H2SO4 = PbSO4+ H2O + 2e — на отрицательной пластине: Pb + H2SO4 = PbSO4+ H2 — 2e |
Батареи первого поколения — батареи с жидким электролитом
Активной массой положительного электрода обычной батареи служит двуокись свинца,
отрицательного — чистый свинец, а электролитом — водный раствор серной кислоты.
Для повышения твердости и коррозионной стойкости электродов свинцовые решетки, удерживающие
активную массу, сначала легировали добавками сурьмы и мышьяка. Но сурьма способствует
повышенному расходу воды и снижению ЭДС аккумуляторной батареи в процессе эксплуатации.
Такое неудобство, как необходимость обслуживания классических батарей, заставила
производителей искать способы упрощения эксплуатации. Сначала было снижено содержание
сурьмы в пластинах, затем из отрицательных пластин сурьму вытеснил кальций. Гибридные
АКБ продолжали требовать долива воды, но уже гораздо реже. Применение кальция в
положительных пластинах привело к появлению батарей, теоретически не требующих долива
на протяжении всего срока эксплуатации.
Батареи второго поколения — герметизированные гелевые батареи (Gelled Electrolite)
В таких батареях кислотный электролит находится в гелеобразном состоянии благодаря добавлению в него соединений кремния. Гелевый электролит позволяет добиться полной герметичности батареи, так как все газовыделение происходит внутри сильно развитой системы пор в массе геля. Это решает проблему необслуживаемости АКБ.
Однако аккумуляторы с загущенным электролитом имеют несколько худшие нагрузочные
характеристики по сравнению с классическими АКБ: большие токи с них снять сложнее
из-за более высокого внутреннего сопротивления. Батареи с жидким электролитом лучше
работают при высоких токах нагрузки при коротких режимах.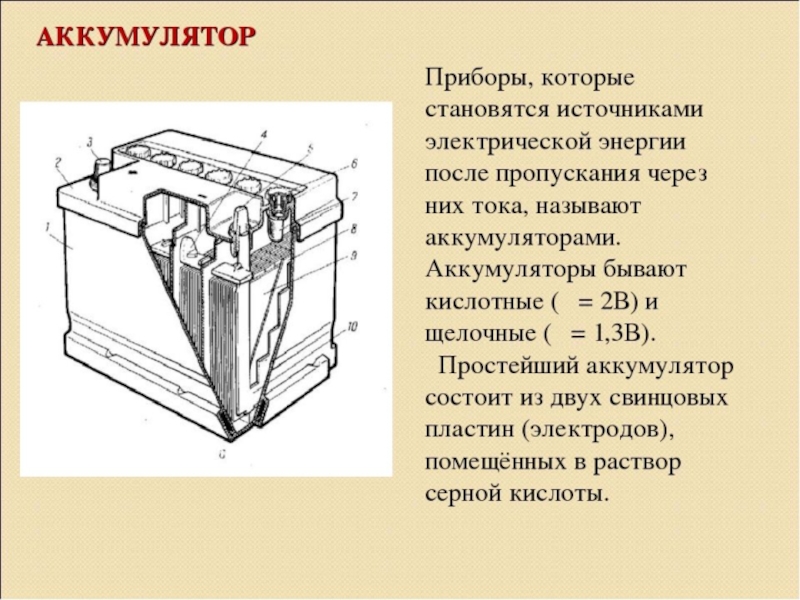 Кроме того, гелевые батареи
критичны к температуре окружающей среды и стабильности зарядного напряжения. Для
их подзаряда нужно использовать зарядные устройства, обеспечивающие нестабильность
напряжения заряда не хуже +/- 1% для предотвращения обильного газовыделения.
Кроме того, гелевые батареи
критичны к температуре окружающей среды и стабильности зарядного напряжения. Для
их подзаряда нужно использовать зарядные устройства, обеспечивающие нестабильность
напряжения заряда не хуже +/- 1% для предотвращения обильного газовыделения.
Батареи типа GEL наиболее устойчивы к глубоким разрядам и не нуждаются в обслуживании в течение всего срока службы при нормальных условиях эксплуатации. Но при их нарушении происходит быстрое старение батареи.
Батареи третьего поколения — герметизированные батареи с абсорбированным сепараторами электролитом AGM (Absorptive Glass Mat)
AGM-технология вновь вернулась к жидкой кислоте, но теперь электролит удерживается
в порах сепаратора из ультратонких стеклянных волокон, размещенных между электродами.
Такой сепаратор представляет собой пористую систему, в которой каппилярные силы
удерживают электролит. При этом количество электролита дозируется так, чтобы мелкие
поры были заполнены, а крупные оставались свободными для свободной циркуляции газов. Принцип рециркуляции такой же, как у гелевых АКБ: блуждая по порам сепаратора, газы
успевают «вернуться» в электролит, не покидая корпус аккумулятора. Таким образом,
AGM батареи также не требуют обслуживания в течение всего срока эксплуатации.
Принцип рециркуляции такой же, как у гелевых АКБ: блуждая по порам сепаратора, газы
успевают «вернуться» в электролит, не покидая корпус аккумулятора. Таким образом,
AGM батареи также не требуют обслуживания в течение всего срока эксплуатации.
Конструкция AGM батарей позволяет не только герметизировать корпус, но и сохранить работоспособность батареи даже в случае повреждений наружной оболочки. Они нечувствительны к колебаниям температуры, долговечны и виброустойчивы.
Но главное преимущество таких батарей — в стойкости к глубоким разрядам. Происходит это за счет повышенной плотности сборки блока пластин и удержания активной массы. Электролит «связан», и разряд аккумулятора не сопровождается его выпариванием с последующим окислением пластин, как это случается с традиционными АКБ.
Но, как и гелевые, AGM батареи чувствительны к превышению зарядного напряжения,
только причиной здесь является существенно меньшее количество электролита в них. Поэтому единственным условием для длительной эксплуатации такого рода аккумуляторов
является правильный выбор зарядного устройства.
Поэтому единственным условием для длительной эксплуатации такого рода аккумуляторов
является правильный выбор зарядного устройства.
Версия для печати
Что такое батарея? — SparkFun Узнать
Авторы: Шон Хаймел
Избранное Любимый 23
Введение
Батареи представляют собой набор из одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны течь по цепи и возвращаться к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «умерла».
Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «умерла».
Батарейки, которые необходимо выбрасывать после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями .
Литий-полимерные батареи, например, можно перезаряжать
Без батарей ваш квадрокоптер должен быть привязан к стене, вам придется вручную заводить машину, а ваш контроллер Xbox должен быть подключен ко всем времени (как в старые добрые времена). Батареи предлагают способ хранения электрической потенциальной энергии в портативном контейнере.
Батарейки бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительного происшествия, связанного с вскрытием лягушки.
Чему вы научитесь
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батареи
- Из каких частей состоит батарея
- Как работает батарея
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в цепях
Рекомендуемая литература
Есть несколько понятий, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
- Что такое электричество
- Напряжение, ток, сопротивление и закон Ома
- Что такое цепь
- Серийные и параллельные цепи
- Электроэнергия
- Переменный ток (AC) и постоянный ток (DC)
Хотите изучить различные аккумуляторы?
Мы вас прикроем!
Литий-ионный аккумулятор — 400 мАч
В наличии ПРТ-13851
10
Избранное Любимый 41
Список желаний
Литий-ионный аккумулятор — 18650 ячеек (2600 мАч)
В наличии ПРТ-12895
Избранное Любимый 20
Список желаний
Батарейка типа «таблетка» — 20 мм (CR2032)
В наличии ПРТ-00338
Избранное Любимый 33
Список желаний
Щелочная батарея 9В
В наличии ПРТ-10218
1
Избранное Любимый 6
Список желаний
Просмотреть все батареи
История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 г., Бенджамин Франклин впервые использовал этот термин для описания ряда конденсаторов, которые он соединил вместе для своих экспериментов с электричеством. Позже этот термин будет использоваться для любых электрохимических элементов, соединенных вместе с целью обеспечения электроэнергии.
В 1749 г., Бенджамин Франклин впервые использовал этот термин для описания ряда конденсаторов, которые он соединил вместе для своих экспериментов с электричеством. Позже этот термин будет использоваться для любых электрохимических элементов, соединенных вместе с целью обеспечения электроэнергии.
(Изображение предоставлено Alvinrune из Викисклада)
Изобретение батареи биолог и философ Луиджи Гальвани препарировал лягушку, прикрепленную к латунному крючку. Когда он коснулся лягушачьей лапки железным скальпелем, та дернулась. Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта предположил, что импульсы лапок лягушки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, смоченную в рассоле, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, вольтов столб, в 1800 году. основные проблемы: из-за веса стека электролит вытекал из ткани, а особые химические свойства компонентов приводили к очень короткому сроку службы (около часа). Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, вольтов столб, в 1800 году. основные проблемы: из-за веса стека электролит вытекал из ткани, а особые химические свойства компонентов приводили к очень короткому сроку службы (около часа). Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправление гальванической батареи
Уильям Круикшенк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической батареи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и образованием пузырьков водорода на меди. В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвращает деградацию.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который реагировал с водородом, предотвращая отложения на медном катоде. Двухэлектролитная батарея Даниэля, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Двухэлектролитная батарея Даниэля, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция элементов Даниэля 1836 года
Первая перезаряжаемая батарея
В 1859 году французский физик Гастон Планте создал батарею из двух скрученных листов свинца, погруженных в серную кислоту. При реверсировании электрического тока через батарею химический состав вернется в исходное состояние, создав таким образом первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив свинцовые листы в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет. 1800-х годов электролит в батареях находился в жидком состоянии. Это делало транспортировку батарей очень осторожным делом, и большинство батарей никогда не предназначалось для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. В то время как электролит в элементе Лекланше все еще был жидким, химический состав батареи оказался важным шагом на пути к изобретению сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса. Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «цинково-угольными батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он выполняет важную роль электрического проводника в угольно-цинковой батарее.
-> 3-вольтовая угольно-цинковая батарея 1960-х годов
(Изображение предоставлено PhFabre из Wikimedia Commons) <-
известный как «Eveready», а затем «Energizer») заменил электролит хлорида аммония щелочным веществом на основе химии батареи, сформулированной Вальдемаром Юнгнером в 189 г. 9. Сухие щелочные батареи могут удерживать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
9. Сухие щелочные батареи могут удерживать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Популярность щелочных батарей возросла в 1960-х годах, они обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение предоставлено Aney~commonswiki из Викисклада) <-
Перезаряжаемые батареи 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи. Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлогидридной (NiMH) батареи. NiMH аккумуляторы были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой перезаряжаемым никель-водородным элементам.
Компания Asahi Chemical из Японии создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году. «литий-полимерный» или «LiPo» аккумулятор.
Химические реакции в литий-полимерном аккумуляторе в основном такие же, как и в литий-ионном аккумуляторе
Очевидно, что было изобретено, произведено и устарело намного больше химических элементов аккумуляторов. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Аккумуляторы состоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-нибудь кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные секции, но вы поняли идею. Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Анод и катод относятся к типам электродов . Электроды — это проводники, по которым электричество входит или выходит из компонента в цепи.
Анод
Электроны вытекают из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На батареях анод помечен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде. Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод отмечен как положительная (+) клемма
В батареях химическая реакция внутри или вокруг катода использует электроны, произведенные в аноде. Единственный способ для электронов добраться до катода — через цепь, внешнюю по отношению к батарее.
Единственный способ для электронов добраться до катода — через цепь, внешнюю по отношению к батарее.
Электролит
Электролит – это вещество, часто жидкое или гелеобразное, способное переносить ионы между химическими реакциями, протекающими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, а не через электролит.
-> Щелочные батареи могут вытекать из электролита, гидроксида калия, при воздействии сильного нагрева или обратного напряжения
(Изображение предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит играет решающую роль в работе аккумулятора. Поскольку электроны не могут пройти через него, они вынуждены путешествовать по электрическим проводникам в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, препятствующие соприкосновению анода и катода, которое могло бы вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы химически не реагируют ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы химически не реагируют ни с анодом, ни с катодом, ни с электролитом.
В гальваническом столбе используется ткань или картон (разделитель), пропитанные солевым раствором (электролитом), чтобы держать электроды разделенными.
Ионы в электролите могут быть положительно заряжены, отрицательно заряжены и могут быть разных размеров. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Корпус
Большинству аккумуляторов требуется способ содержания их химических компонентов. Корпуса, также известные как «корпуса» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних частей батареи.
Этот свинцово-кислотный аккумулятор имеет пластиковый корпус
Корпуса аккумуляторов могут быть изготовлены практически из чего угодно: пластика, стали, пакетов из мягкого полимерного ламината и т. д. В некоторых батареях используется проводящий стальной корпус, электрически соединенный с одним из электродов. В случае обычного щелочного элемента АА стальной корпус соединен с катодом.
д. В некоторых батареях используется проводящий стальной корпус, электрически соединенный с одним из электродов. В случае обычного щелочного элемента АА стальной корпус соединен с катодом.
Эксплуатация
Для работы аккумуляторов обычно требуется несколько химических реакций. По крайней мере, одна реакция происходит на аноде или вокруг него, и одна или несколько реакций происходят на катоде или вокруг него. Во всех случаях реакция на аноде производит дополнительные электроны в процессе, называемом окисление , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны обеспечивают химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы течь за пределы батареи, чтобы питать нашу цепь.
Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы течь за пределы батареи, чтобы питать нашу цепь.
Окисление анода
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионном аккумуляторе. В других химических реакциях расходуются ионы, как в обычной щелочной батарее. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит на катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются при восстановлении.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся в ходе реакции окисления, расходуются во время восстановления. В других случаях, например, в щелочных батареях, при восстановлении образуются отрицательно заряженные ионы.
В других случаях, например, в щелочных батареях, при восстановлении образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части реакции будут происходить в полную силу только тогда, когда между анодом и катодом замкнута электропроводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может протекать и тем быстрее происходят химические реакции.
Создание короткого замыкания в аккумуляторе (в данном случае даже случайного) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже дымят или загораются при наличии короткого замыкания.
Мы можем пропустить эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», чтобы сделать что-то полезное. На моушн-графике в начале этого раздела мы зажигаем виртуальную лампочку нашими движущимися электронами.
Разряженный аккумулятор
Химические вещества в аккумуляторе в конце концов достигнут состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате батарея больше не будет генерировать электрический ток. В этот момент аккумулятор считается «разряженным».
Первичные элементы должны быть утилизированы, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи обратного электрического тока через батарею. Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, когда говорят о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Ячейка относится к одному аноду и катоду, разделенным электролитом, используемым для получения напряжения и тока. Аккумулятор может состоять из одной или нескольких ячеек. Например, одна батарея типа АА представляет собой одну ячейку. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В каждая.
Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В каждая.
Обычная 9-вольтовая батарея состоит из шести щелочных элементов 1,5 В, установленных друг над другом
Первичные
Первичные клетки содержат химию, которую нельзя обратить. В результате батарея должна быть выброшена после того, как она мертва.
Вторичные
Вторичные элементы можно перезарядить, и их химический состав вернется в исходное состояние. Эти элементы, также известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение батареи — это напряжение, указанное производителем.
Например, щелочные батареи AA указаны как имеющие напряжение 1,5 В. В этой статье от Mad Scientist Hut показано, что их протестированные щелочные батареи начинаются с напряжения около 1,55 В, а затем постепенно теряют напряжение по мере разрядки. В этом примере номинальное напряжение «1,5 В» относится к максимальному или начальному напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разрядки их LiPo элементов, начиная с 4,2 В и падая примерно до 2,8 В по мере разрядки. Номинальное напряжение, указанное для большинства литий-ионных и LiPo элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению батареи в течение цикла ее разрядки.
Емкость
Емкость батареи — это мера количества электрического заряда, который она может отдать при определенном напряжении. Большинство аккумуляторов рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот аккумулятор LiPo рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают напряжение батареи в зависимости от емкости, например, эти тесты батареи AA от PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите минимальное допустимое напряжение и найдите соответствующее значение в мАч или Ач.
C-Rate
Многие аккумуляторы, особенно мощные литий-ионные батареи, обозначают ток разряда как C-Rate, чтобы более четко определить атрибуты батареи. C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1C — это величина тока, необходимая для разрядки аккумулятора за 1 час. Например, батарея емкостью 400 мАч, обеспечивающая ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их аккумулятор LiPo имеет меньшую емкость мАч при более высоких показателях C-Rate.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать аккумуляторы LiPo при температуре 1С или меньше.
Массачусетский технологический институт разработал фантастическое руководство по спецификациям аккумуляторов и терминологии, которое идет гораздо дальше этого обзора.
Применение
Одноэлементный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот Photon Battery Shield питается от одного элемента LiPo
Если напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
9Серия 0032Чтобы увеличить напряжение между клеммами батареи, вы можете расположить элементы последовательно. Серия означает укладку элементов встык, соединяя анод одного с катодом следующего.
Соединяя аккумуляторы последовательно, вы увеличиваете общее напряжение. Добавьте напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере последовательно соединены четыре элемента по 1,5 В. Напряжение на нагрузке составляет 6 В, а общий комплект аккумуляторов имеет емкость 2000 мАч.
В большинстве устройств бытовой электроники, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель для двух батарей типа АА может повысить номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или LiPo аккумуляторы последовательно, вам необходимо обязательно использовать специальную схему, известную как «балансир», чтобы обеспечить постоянное напряжение между элементами. Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.
Параллельный
Если напряжения одного элемента достаточно для нагрузки, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном соединении батарей! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо перепады напряжения, может произойти короткое замыкание, что приведет к перегреву и возгоранию.
В этом примере четыре элемента по 1,5 В соединены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серийные и параллельные батареи
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения для батарей, включенных параллельно, одинаков, так как может произойти короткое замыкание.
В этом примере общее напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные батареи, соединенные последовательно и параллельно.
Ресурсы и дальнейшее развитие
К этому моменту вы уже должны понимать, как были изобретены батареи и как они работают. Батареи — это один из способов обеспечения электроэнергией вашего проекта, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите узнать больше об аккумуляторах, вот еще несколько руководств:
- Battery Technologies
- Как включить проект
- Что такое цепь?
Хотите увидеть батареи в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Беспроводная связь Саймона Сплозиона
Это туториал, демонстрирующий одну из многих техник «взлома» Саймона Говорит. Мы расскажем, как взять ваш Simon Says Wireless.
Избранное Любимый 3
Базовая дифференциальная платформа Actobotics
Начните работу с Actobotics с помощью этого простого транспортного средства. Затем расширьте и настройте его для своей собственной империи злых роботов.
Избранное Любимый 7
Всплывающая плата со светодиодной бабочкой
Создайте светящуюся всплывающую карту бабочки с медной лентой, двумя светодиодами и батареей.
Избранное Любимый 8
Дистанционный фотонный датчик температуры
Узнайте, как построить собственную станцию для измерения температуры на солнечных батареях с подключением к Интернету, используя Photon from Particle.
Избранное Любимый 11
ESP8266 Пылесос на пропане
Узнайте, как Ник Пул построил огневую пушку, управляемую через WiFi, с помощью платы ESP8266 Thing Dev!
Избранное Любимый 4
Сигнализация стиральной/сушильной машины Blynk Board
Как настроить Blynk Board и приложение, чтобы уведомлять вас, когда ваша стиральная машина или сушилка перестали трястись.
Избранное Любимый 9
Аккумулятор — Energy Education
Energy EducationМеню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
ИНДЕКС
Поиск
Рис. 1. 9-вольтовая батарея. [1]
1. 9-вольтовая батарея. [1]
Аккумулятор — это устройство, которое накапливает энергию и затем разряжает ее путем преобразования химической энергии в электричество. Типичные батареи чаще всего производят электричество химическим путем за счет использования одного или нескольких гальванических элементов. [2] Многие различные материалы могут использоваться и использовались в батареях, но распространенными типами батарей являются щелочные, литий-ионные, литий-полимерные и никель-металлгидридные. Батареи могут быть соединены друг с другом последовательно или параллельно.
Существует большое разнообразие аккумуляторов, доступных для покупки, и эти разные типы аккумуляторов используются в разных устройствах. Большие батареи используются для запуска автомобилей, в то время как гораздо меньшие батареи могут питать слуховые аппараты. В целом, аккумуляторы чрезвычайно важны в повседневной жизни.
Ячейки
Ячейка — это отдельная единица, которая каким-то образом производит электричество. Вообще говоря, клетки генерируют энергию посредством термического, химического или оптического процесса.
Вообще говоря, клетки генерируют энергию посредством термического, химического или оптического процесса.
Типичный элемент имеет две клеммы (называемые электродами ), погруженные в химическое вещество (называемое электролитом ). Два электрода разделены пористой стенкой или перемычкой , которая позволяет электрическому заряду проходить с одной стороны на другую через электролит. Анод — отрицательная клемма — получает электроны, а катод — положительная клемма — теряет электроны. Этот обмен электронами позволяет создать разницу в потенциале или разнице напряжений между двумя терминалами, позволяя электричеству течь. [2]
В аккумуляторе может быть огромное количество элементов, от одного элемента в батарее типа АА до более 7100 элементов в аккумуляторе Tesla Model S мощностью 85 кВтч. [3]
Рис. 2. Схема в разрезе, показывающая строение щелочной батареи. [4]
Первичные элементы («сухие»)
В этих элементах химическое взаимодействие между электродами и электролитом вызывает необратимое изменение, то есть они не подлежат перезарядке . [2] Эти батареи одноразового использования, что приводит к большему количеству отходов при использовании этих батарей, поскольку они утилизируются через относительно короткий период времени.
[2] Эти батареи одноразового использования, что приводит к большему количеству отходов при использовании этих батарей, поскольку они утилизируются через относительно короткий период времени.
Вторичные элементы («влажные»)
Элементы этого типа (обозначаемые как влажные из-за использования жидкого электролита) генерируют ток через вторичный элемент в направлении, противоположном направлению первого/нормального элемента. Это заставляет химическое действие идти в обратном направлении, эффективно восстанавливаясь, а это означает, что они перезаряжаемый . [2] Эти батареи могут быть более дорогими при покупке, но они производят меньше отходов, поскольку их можно использовать несколько раз.
Емкость батареи
Батареи часто оцениваются по выходному напряжению и емкости. Емкость — это продолжительность работы конкретной батареи в Ач (ампер-часах) [2] :

Аккумуляторы также можно классифицировать по их энергоемкости. Это делается либо в ватт-часах, либо в киловатт-часах.
Моделирование Phet
Университет Колорадо любезно разрешил нам использовать следующее моделирование Phet. Эта симуляция исследует, как батареи работают в электрической цепи:
Для дополнительной информации
Для получения дополнительной информации см. соответствующие страницы ниже:
- Последовательная цепь
- Параллельная цепь
- Постоянный ток
- Диспетчерский источник электроэнергии
- Электрическая сеть
- Электрический генератор
- Или исследуйте случайную страницу!
Ссылки
- ↑ 2,0 2,1 2,2 2,3 2,4 Р.Т. Пейнтер, «Основные электрические компоненты и счетчики», в Введение в электричество , 1-е изд.



