что это такое, химический состав, как приготовить
Время на чтение: 3 мин
3452
Электролит – это специальная смесь, которая заливается в аккумуляторы. Это один из необходимых компонентов для работы батареи.
О существующих видах химического раствора и о способе приготовления этой жидкости мы расскажем вам здесь.
Что из себя представляет электролит и зачем его использовать
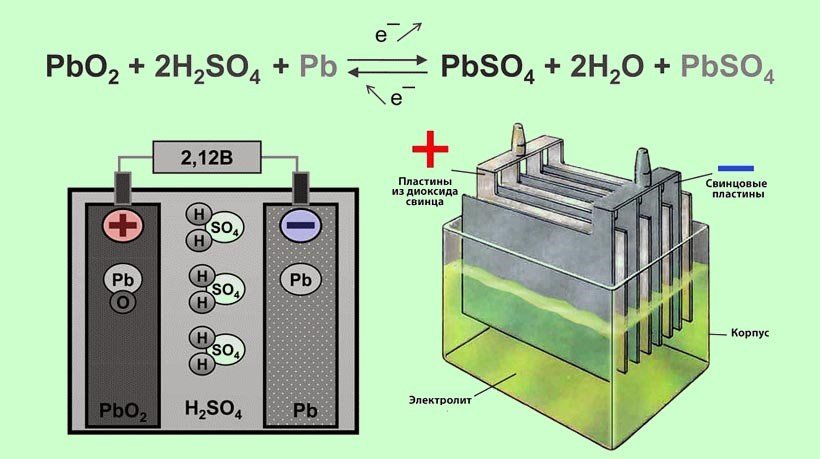
Это жидкость на основе кислоты или щелочи. Работает она как проводник тока. При повышении уровня заряда АКБ плотность жидкости повышается.
Химический раствор должен быть качественным, сделанным без отступлений от технологии изготовления. В противном случае заряд аккумулятора не произойдет.
Какие виды химической жидкости существуют
Поскольку электролит – это смесь либо на основе кислоты либо щелочи, то видов этой смеси два: щелочная и кислотная.
Кислотная – симбиоз кислоты и дистиллированной воды. Аккумуляторы с этим типом электролита нужны, чтобы запустить двигатель.
Аккумуляторы с этим типом электролита нужны, чтобы запустить двигатель.
В щелочном типе жидкости применяется смесь кальциево-литиевой основы и дистиллированной воды.
Такие смеси служат для накапливания электричества в АКБ. Область применения этих батарей – электроприборы, автопогрузчики, военная автотехника.
Способ приготовления кислотного раствора
Потребуется следующее:
- Емкость и шпатель для смешивания, способные противостоять к разъеданию кислотами.
- Очищенная (дистиллированная) вода.
- Серная кислота для аккумулятора.
- Защитная одежда (фартук, очки, перчатки).
- Сода (нейтрализатор кислоты).
Как готовим:
- В посуду наливаем нужное количество воды и аккуратно и медленно вливаем в воду кислоту.
- Перемешиваем шпателем.
- Оставляем на отстаивание не менее полусуток. На литр смеси берем 0,75 воды и 0,285 кислоты.
Готовим щелочной раствор
Нам понадобится посуда, устойчивая к химическим щелочным реакциям, щелочь (едкий калий или едкий натрий), можно добавлять литиевые вещества для улучшения качества раствора, вода.
Важно! Воду добавляем полностью очищенную, т.е. дистиллированную!
Способ приготовления:
- В посуду наливаем дистиллированную воду.
- Высыпаем щелочь и тщательно размешиваем. Если плотность неудовлетворительная, то добавляем щелочь или жидкость.
- Настаиваем три часа.
- Переливаем полученную жидкость в другой сосуд, не поднимая осадка.
Электролит с повышенной плотностью
Он может понадобиться нам для коррекции плотности находящегося в аккумуляторе. В случае если вы добавили в банки батареи много воды и плотность химической смеси упала, можно откорректировать ее с помощью электролита с большей плотностью.
Для приготовления немного меняем пропорции щелочи (кислоты) и воды (0,423 к-ты на 0,650 воды). Очередность действий такая же, как и при изготовлении основного раствора.
Химические свойства электролита такие же, но температура замерзания ниже. Смесь используется только для корректировки основного электролита.
Для каких аккумуляторов используют разные типы химической жидкости?
Чтобы не ошибиться, следует изучить этикетку на аккумуляторе. Если батарея свинцово-кислотного типа, то используем кислотную смесь.
В щелочные батареи наливаем раствор на основе калиевого или натриевого вещества. Тип щелочи можно узнать по горению. Калий горит фиолетово-красным, а натрий — желтым огнем.
Итак, если вдруг возникнет необходимость самостоятельно приготовить электролит для аккумулятора, то, в принципе, это возможно. Следует соблюдать технику безопасности и быть внимательным к пропорциям веществ — и все обязательно получится.
Свойства щелочных электролитов | Аккумуляторные батареи
- Подробности
- Категория: Оборудование
- эксплуатация
- ремонт
- хранение энергии
Содержание материала
- Аккумуляторные батареи
- Электрические характеристики аккумуляторных батарей
- Принцип действия аккумулятора
- Свинцово-кислотные аккумуляторы
- Пластины аккумуляторов
- Сепараторы для свинцово-кислотных аккумуляторов
- Сосуды для свинцово-кислотных аккумуляторов
- Сборка для свинцово-кислотных аккумуляторов
- Железо–никелевые аккумуляторы
- Никель-кадмиевые аккумуляторы
- Серебряно-цинковые аккумуляторы
- Электролит для свинцовых аккумуляторов
- Свойства щелочных электролитов
- Приготовление электролита
- Источники повреждений аккумуляторных батарей
- Заряд аккумуляторных батарей
- Зарядные устройства
- Ремонт аккумуляторных батарей
- Оборудование мастерской по ремонту аккумуляторных батарей
- Ремонт
- Сборка аккумуляторных батарей
- Охрана труда и техника безопасности
- Особенности эксплуатации аккумуляторных батарей на электростанциях и подстанциях
- Основные сведения по монтажу
- Порядок эксплуатации аккумуляторных батарей
- Техническое обслуживание аккумуляторных батарей
Страница 13 из 26
4. 2. Свойства щелочных электролитов
2. Свойства щелочных электролитов
Электролитом для щелочных аккумуляторов с электродами из железа и окиси никеля служит раствор едкого кали. К этому раствору для аккумуляторов Эдисона добавляют небольшое количество гидроокиси лития. Гидроокись лития имеет полезное влияние на работу аккумуляторов, но она не является необходимой для основных реакций, которые протекают в них. Применение гидроокиси лития скорее основано на опытных результатах, чем на теоретических соображениях.
Концентрация и химический состав щелочных электролитов, рассматриваемые в целом, не меняются в течение заряда, поэтому их измерение имеет меньшее значение, чем для сернокислотного электролита, применяемого в свинцовых аккумуляторах. Однако периодические измерения удельного веса все же должны производиться ввиду того, что происходит постепенное ослабление электролита, сопровождающееся уменьшением емкости батареи.
 Когда емкость упадет ниже известного предела, электролит должен быть заменен новым.
Когда емкость упадет ниже известного предела, электролит должен быть заменен новым.Щелочные электролиты для аккумуляторов Эдисона применяются трех составов: электролит для первого наполнения, для второго наполнения и электролит для возобновления. Первый состоит из 21%-ного водного раствора едкого кали с добавкой 50 г едкого лития на 1 л раствора. Второй также состоит из 21%-ного раствора едкого кали с добавкой х граммов едкого лития, где х – количество лития, приблизительно равное тому количеству, которое найдено в первоначальном электролите после формирования. Третий состоит из 25%-ного раствора едкого кали с 15 г едкого лития на 1 л. Применение этих растворов в общем указано уже самими их названиями. Начальное заполнение элементов на заводе производится электролитом первого наполнения из наиболее сухого едкого лития с тем, чтобы обеспечить правильное количество его на единицу веса положительного активного материала. Второй род электролита применяется главным образом для тех батарей, которые после формирования отправляются в сухом виде.

Удельные веса этих электролитов до заливки их в аккумуляторы следующие:
Растворы едкого калия
уд. вес при 15,50C
Электролит для первого наполнения. От 1,288 до 1,230
″ второго наполнения …………… ″ 1,210 ″ 1,215
″ возобновления……………………… ″ 1,248 ″ 1,250
Когда удельный вес электролита в процессе работы уменьшился до 1,160, он должен быть возобновлен. При определении удельного веса должны быть приняты некоторые меры предосторожности.
 Электролит нужно пополнить до надлежащего уровня и тщательно перемешать, доведя батарею до состояния полного заряда; проба, взятая для измерения удельного веса, не должна иметь пузырьков газа. Если измерения производятся при температуре, отличной от стандартной температуры 15°С, необходимо ввести соответствующие поправки. В нормальных условиях электролит требует замены 2 или 3 раза в течение полезного срока службы батареи. Необходимо время от времени производить химический анализ электролита и воды, применяемой для доливки элементов.
Электролит нужно пополнить до надлежащего уровня и тщательно перемешать, доведя батарею до состояния полного заряда; проба, взятая для измерения удельного веса, не должна иметь пузырьков газа. Если измерения производятся при температуре, отличной от стандартной температуры 15°С, необходимо ввести соответствующие поправки. В нормальных условиях электролит требует замены 2 или 3 раза в течение полезного срока службы батареи. Необходимо время от времени производить химический анализ электролита и воды, применяемой для доливки элементов.  Если элементы велики, то следует споласкивать каждый из них в отдельности. Пользоваться водой для споласкивания пластин не следует. После опорожнения каждого элемента следует его сейчас же наполнить новым электролитом, а по наполнении всей батареи ее надо зарядить нормальным 15-часовым режимом. Во время заряда необходимо время от времени измерять температуру, и если она достигает установленного предела 45°С, то следует прервать заряд до тех пор, пока батарея остынет.
Если элементы велики, то следует споласкивать каждый из них в отдельности. Пользоваться водой для споласкивания пластин не следует. После опорожнения каждого элемента следует его сейчас же наполнить новым электролитом, а по наполнении всей батареи ее надо зарядить нормальным 15-часовым режимом. Во время заряда необходимо время от времени измерять температуру, и если она достигает установленного предела 45°С, то следует прервать заряд до тех пор, пока батарея остынет. Гидрат окиси калия или едкое калия – белое твердое тело, расплывающееся при хранении в открытом виде и легко растворяющееся в воде. Оно растворяет кожу и целый ряд органических веществ. Едкое кали как в твердом состоянии, так и в растворе поглощает углекислоту из воздуха, поэтому необходимо защищать раствор в аккумуляторах от загрязнения углекислотой, пользуясь газовыми вентилями в выходном отверстии. Эти вентили имеют назначением предотвратить доступ углекислого газа, позволяя в то же время газу, образующемуся внутри элемента, свободно выходить наружу.
 Едкое кали может быть приготовлено электролитическим путем из хлористого калия. Едкий литий получается в растворе действием извести на раствор карбоната лития. Это бесцветная весьма едкая жидкость.
Едкое кали может быть приготовлено электролитическим путем из хлористого калия. Едкий литий получается в растворе действием извести на раствор карбоната лития. Это бесцветная весьма едкая жидкость. Кристаллы едкого лития содержат всего 54% гидрата окиси лития.
- Назад
- Вперёд
- Назад
- Вперёд
- Вы здесь:
- Главная
- Книги
- Оборудование
- Электрические машины
Еще по теме:
- Предремонтные испытания электрических машин
- Взрывозащищенная контрольно-измерительная и аппаратура автоматики
- Ремонт электрооборудования на судах
- Интеграция системы передачи и хранения ремонтных заявок с системой их режимной проработки
- Строительство, реконструкция и ремонт дымовых труб
Анализ свойств электролита – TA Instruments
Одним из наиболее важных компонентов батареи является электролит, представляющий собой проводящий раствор, переносящий положительно заряженные ионы от катода к аноду в процессе разряда. Электролиты литий-ионных аккумуляторов традиционно изготавливаются из соли лития, растворенной в смеси органических растворителей. Во время формирования батареи растворяющие и солевые компоненты электролита восстанавливаются на аноде с образованием межфазной фазы твердого электролита (SEI), которая играет решающую роль в работе и безопасности батареи.
Электролиты литий-ионных аккумуляторов традиционно изготавливаются из соли лития, растворенной в смеси органических растворителей. Во время формирования батареи растворяющие и солевые компоненты электролита восстанавливаются на аноде с образованием межфазной фазы твердого электролита (SEI), которая играет решающую роль в работе и безопасности батареи.
Современные исследователи батарей экспериментируют с различными составами жидких, гелевых, полимерных и твердотельных электролитов. Разработка успешных электролитов требует баланса вязкости, проводимости, электрохимической стабильности и стоимости. Большинство электролитов могут хорошо работать при низких температурах, но имеют ограниченную термическую стабильность даже при умеренных температурах.
Разработчики аккумуляторов полагаются на термический анализ для измерения термической стабильности электролитов и обеспечения того, чтобы их конструкции не разрушались и не возгорались. Термическую стабильность электролита можно исследовать с помощью дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (ТГА), и вместе эти методы обеспечивают комплексный анализ тепловых свойств электролита.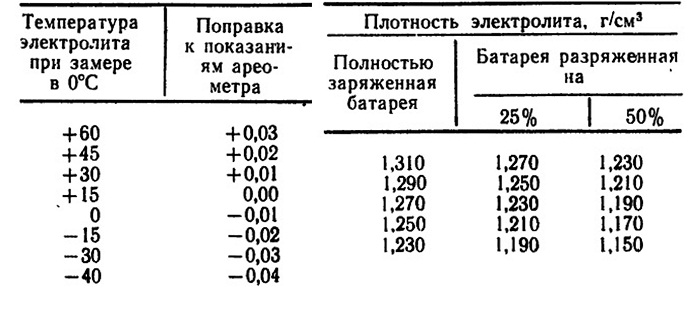 Реология позволяет инженерам измерять вязкость и производить электролитические растворители с оптимальной прокачиваемостью в процессе производства.
Реология позволяет инженерам измерять вязкость и производить электролитические растворители с оптимальной прокачиваемостью в процессе производства.
Instruments and Test Parameters
Material: Nonaqueous solvents
Material Examples: Carbonates and electrolytic solutions, Lithium hexafluorophosphate (LiPF 6 )
APCG & LCMS
Molecular degradation электролитов и добавок
Дифференциальная сканирующая калориметрия
Состав электролита
- Плавка
- Кристаллизация
Термическая стабильность
- Температурный разгон
- Теплота реакции
Реометрия
Перекачиваемость, транспортировка
- Предел текучести
- Вязкость (ньютоновская, уменьшение при сдвиге, увеличение при сдвиге)
- Вязкоупругость
Влияние циклов заряда-разряда на проводимость
- Вязкость
- Электрореология
Пример применения
Какие тепловые события приводят к тепловому разгону?
Несмотря на то, что остаются вопросы о процессе теплового разгона в батареях, текущее понимание предполагает, что он инициируется следующей серией событий. Экзотермические реакции, приводящие к тепловому разгону, разрушительно взаимодействуют с каждым внутренним компонентом литий-ионной батареи (LIB), поскольку температура батареи продолжает расти; некоторые элементы являются ранними жертвами, в то время как большинство непосредственно ускоряют накопление тепла при выходе из строя.
Экзотермические реакции, приводящие к тепловому разгону, разрушительно взаимодействуют с каждым внутренним компонентом литий-ионной батареи (LIB), поскольку температура батареи продолжает расти; некоторые элементы являются ранними жертвами, в то время как большинство непосредственно ускоряют накопление тепла при выходе из строя.
Первым компонентом, который начинает разрушаться, является интерфаза твердого электролита (SEI), которая обычно начинается при 80-120°C (176-248°F). В этот момент тепловой разгон можно замедлить, но он больше не обратим, если анод подвергается воздействию электролита. Экзотермические реакции, происходящие на поверхности реактивного анода, добавляют больше тепла в систему, пока она не достигнет следующих критических температур.
Следующим затронутым компонентом является сепаратор, который выходит из строя в два этапа. При температуре около 120-150°C (248-302°F) сепаратор начинает плавиться и вызывает небольшое короткое замыкание, за которым следует более серьезное внутреннее короткое замыкание, когда сепаратор разрушается при температуре около 220-250°C (428-482°F). Ф).
Ф).
Следующие реакции происходят быстро и непосредственно в соответствии с предыдущим температурным диапазоном; материал катода, связующее вещество и электролит начинают разлагаться, что резко повышает температуру элемента батареи до температуры около 800°C (1472°F). Эти реакции имеют газообразные продукты, которые повышают давление внутри ЛИА.
Термограмма ТГА, показывающая термическую нестабильность графитового материала анодаПомимо быстрого выделения тепла, катодные реакции имеют опасный побочный продукт — кислород, который легко воспламеняется. В зависимости от точных условий немедленным результатом будет либо «Тепло + Кислород = Огонь», либо «Тепло + Газ = Разрыв/Взрыв». Конечно, не все материалы сделаны одинаковыми и могут оказаться выше или ниже этих диапазонов — или даже за пределами этих температур в будущем — поэтому важно сделать максимально безопасный выбор материалов для данной батареи с надлежащим тестированием.
Чтобы избежать теплового разгона и выбрать материалы для батарей с оптимальными термостойкостью, исследователи аккумуляторов обращаются к дифференциальной сканирующей калориметрии (ДСК) и термогравиметрическому анализу (ТГА):
ДСК: ДСК измеряет поток тепла в материал или из него как функция температуры или времени. Фазовые изменения прерывают зависимость теплоемкости между изменением температуры и поглощенным или выделенным теплом и видны на выходе графика. Это позволяет проводить испытания в различных условиях, от безопасной рабочей температуры до теплового воздействия.
Фазовые изменения прерывают зависимость теплоемкости между изменением температуры и поглощенным или выделенным теплом и видны на выходе графика. Это позволяет проводить испытания в различных условиях, от безопасной рабочей температуры до теплового воздействия.
ТГА: ТГА измеряет массу образца как функцию температуры или времени. Вообще говоря, более термически стабильный материал может достичь более высокой температуры до того, как произойдет какое-либо изменение массы.
Ответьте на следующие вопросы по результатам ДСК:
- Температура плавления материала, Tm
- Температура стеклования материала, Tg
- Самая низкая температура фазового перехода различных материалов, из которых состоит батарея.
Ответьте на следующие вопросы, используя результаты ТГА:
- Температура, при которой материал начинает разлагаться.
- Количество массы образца, потерянной в результате термического или окислительного разложения при данной температуре.

- Скорость реакций разложения (как окислительных, так и термических) при данной температуре.
- Максимальная термически стабильная температура различных материалов, из которых состоит батарея.
Основные сведения об электролите литиевой батареи
Перейти к содержимому Основы электролита литиевой батареи Литиевые батареиявляются наиболее распространенным типом перезаряжаемых батарей, используемых сегодня в электронике.
Они известны своей высокой плотностью энергии, длительным сроком службы и т. д. Эти качества делают их идеальными для использования в портативной электронике, такой как телефоны, ноутбуки и планшеты.
Для достижения этих характеристик литиевые батареи должны содержать особый тип электролита, способный выдерживать многократные заряды без разрушения или утечки. Поскольку этот электролит не виден невооруженным глазом, важно понимать, как он работает, чтобы предотвратить возникновение каких-либо проблем!
-
Как работают литиевые батареи?
-
Что такое электролит батареи?
-
Основные требования к электролитам литий-ионных аккумуляторов
-
Из чего состоит электролит литий-ионного аккумулятора?
-
Типы электролита литий-ионного аккумулятора
-
Какое влияние оказывает электролит литий-ионного аккумулятора на работу аккумулятора?
-
Идеальные критерии электролита литий-батарея
Как работает литий-батареи. Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.
Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении. Движение ионов лития создает разность электрических потенциалов, называемую «напряжением». Когда вы подключаете свои электронные устройства к батарее, электроны (не литий-ионы) проходят через ваше устройство и питают его.
Что такое электролит литиевой батареи?
Аккумулятор состоит из трех основных компонентов: катода, анода и электролита, разделяющего эти два контакта. Электролит литиевой батареи представляет собой химическое вещество, позволяющее электрическому заряду проходить между двумя клеммами. Электролит помещает химические вещества, необходимые для реакции, в контакт с анодом и катодом, тем самым преобразуя накопленную энергию в пригодную для использования электрическую энергию.
Электролит литиевых батарей является своего рода носителем для передачи ионов в литиевых батареях. Основными компонентами являются соли лития и органические растворы. С электролитом между положительным и отрицательным электродами литиевой батареи существует ионная проводимость, и происходит явление зарядки и разрядки. Практически в литиевых батареях используется жидкий электролит с содержанием LiPF6, LiBF4 или LiClO4. Добавляя жидкий электролит, в основном существует 3 вида электролита для литиевых батарей, которые классифицируются по своему физическому состоянию. Все они имеют одинаковые функции:
Функция
1. Электролит обеспечивает часть активных ионов лития, которые используются в качестве проводящих ионов в процессе зарядки и разрядки.
2 электролит обеспечивает ионный канал или носитель, в котором ионы лития могут свободно перемещаться.
Эта реакция обеспечивает питание подключенного устройства, будь то свет, пылесос или электромобиль.
Основные требования к электролитам для литий-ионных аккумуляторов
Электролиты, используемые в литий-ионных батареях, должны соответствовать следующим основным требованиям. Это факторы, которые необходимо учитывать при измерении характеристик электролитов, а также важные предпосылки для реализации высоких характеристик, низкого внутреннего сопротивления, низкой цены, длительного срока службы и безопасности литий-ионных аккумуляторов.
- Ионная проводимость высока в широком диапазоне температур, а число миграций ионов лития велико, что снижает концентрационную поляризацию батареи во время заряда и разряда.
- Хорошая термическая стабильность, обеспечивающая работу батареи в подходящем диапазоне температур.
- Электрохимическое окно широкое, и лучше всего иметь окно электрохимической стабильности 0 ~ 5 В, чтобы гарантировать, что электролит не подвергается значительным побочным реакциям на полюсах, и чтобы соответствовать сингулярности электродных реакций в электрохимическом процессе.

- При использовании вместо диафрагмы он также должен иметь хорошие механические свойства и технологичность.
- Низкая цена и стоимость.
- Хорошая безопасность, высокая температура вспышки или отсутствие возгорания.
- Нетоксичен и не наносит вреда окружающей среде.
Из чего состоит электролит литий-ионного аккумулятора?
Электролиты обычно изготавливаются из
1. органических растворов высокой чистоты, C3h5O3, C4H6O3, C3H6O3, PF5 и т.д.
2. электролитные соли лития:
3. необходимые добавки
4. прочее сырье
Прежде всего при определенных условиях и в определенных пропорциях.
В разных типах батарей используются разные типы химических реакций и разные электролиты.
Например,
Гексафторфосфат лития (LiPF6) представляет собой раствор соли лития, который является наиболее распространенным электролитом в литиевых батареях. Гидроксид калия является электролитом в обычных бытовых щелочных батареях. В свинцово-кислотном аккумуляторе обычно используется серная кислота для создания предполагаемой реакции. Воздушно-цинковые батареи основаны на окислении цинка кислородом для реакции.
В свинцово-кислотном аккумуляторе обычно используется серная кислота для создания предполагаемой реакции. Воздушно-цинковые батареи основаны на окислении цинка кислородом для реакции.
Типы электролита литий-ионного аккумулятора
Существует три вида электролита литий-ионного аккумулятора. В зависимости от состояния электролитов электролиты литиевых батарей можно разделить на жидкие электролиты, твердые электролиты и твердожидкие композитные электролиты.
Жидкие электролиты включают органические жидкие электролиты и ионные жидкие электролиты при комнатной температуре
твердые электролиты включают твердые полимерные электролиты и неорганические твердые электролиты
твердые и жидкие композитные электролиты представляют собой гелевые электролиты, состоящие из твердого полимера и жидких электролитов.
Ниже приводится подробное описание этих пяти видов электролитов для ионно-литиевых аккумуляторов.
Органический жидкий электролит: Электролит, полученный путем растворения электролита на основе литиевой соли в полярном апротонном органическом растворителе
Преимущества:
1. Органический жидкий электролит обладает хорошей электрохимической стабильностью,
Органический жидкий электролит обладает хорошей электрохимической стабильностью,
2. Органический жидкий электролит имеет низкую температуру замерзания и высокую точка кипения
3. Органический жидкий электролит можно использовать в широком диапазоне температур.
недостатки:
1.Органические растворители органического жидкого электролита имеют малую диэлектрическую проницаемость
2.Органические растворители органического жидкого электролита имеют высокую вязкость
3.Органический жидкий электролит имеет плохую способность растворять неорганические солевые электролиты
4.Органическая жидкость электролит имеет низкую электропроводность
5. Органический жидкий электролит особенно чувствителен к следовым количествам воды.
6. Органические жидкие литиевые батареи склонны к утечке.
7. Продукт должен иметь прочный металлический корпус, модель корпуса и размер фиксированы, что не обеспечивает гибкости.
8. Низкая безопасность из-за воспламеняемости органических растворителей.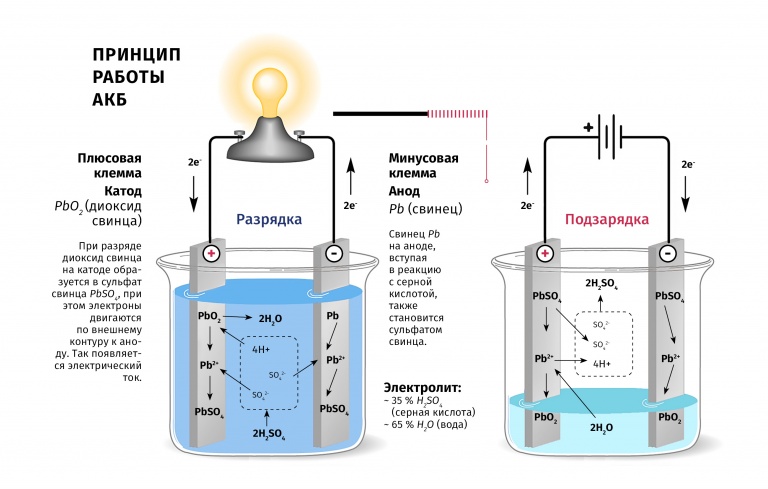 Таким образом, меры защиты батареи должны быть очень совершенными.
Таким образом, меры защиты батареи должны быть очень совершенными.
Ионный жидкий электролит при комнатной температуре: Функциональный материал или среда, состоящая из определенных катионов и анионов, которые являются жидкими при комнатной температуре или близкой к ней.
преимущества:
1. Ионный жидкий электролит комнатной температуры имеет выдающиеся преимущества, такие как высокая проводимость
2. Ионный жидкий электролит комнатной температуры имеет низкое давление паров
3. Ионный жидкий электролит комнатной температуры имеет широкий диапазон жидкостей
4. Ионная жидкость комнатной температуры электролит обладает хорошей химической и электрохимической стабильностью
5. Ионный жидкий электролит комнатной температуры не загрязняет окружающую среду
6. Ионный жидкий электролит комнатной температуры легко восстанавливается
7. Совершенная безопасность:
Расплавленная соль комнатной температуры используется в качестве электролита для литий-ионных аккумуляторов для повышения безопасности аккумуляторов при высокой плотности мощности и полного устранения угроз безопасности аккумуляторов.
твердый электролит для литий-ионных аккумуляторов
Преимущества:
1. Твердый электролит негорюч
2. Твердый электролит имеет низкую реакционную способность с материалом электрода
3. Твердый электролит обладает хорошей гибкостью
4. Твердый электролит может преодолеть вышеуказанные недостатки жидкостных литий-ионных аккумуляторов и позволяют изменять объем электродного материала при разряде
5. Твердый электролит более устойчив к ударам, вибрации и деформации, чем жидкие электролиты.
6. Его легко обрабатывать и формовать, и аккумулятору можно придать различные формы в соответствии с различными потребностями.
Гелевый электролит: Жидкие пластификаторы, такие как PC, EC и т. д., притягиваются к полимерной матрице для получения твердо-жидкого композиционного гелеобразного электролита.
преимущества: этот тройной электролит, состоящий из полимерных соединений, солей лития и полярных органических растворителей, обладает свойствами как твердых электролитов, так и жидких электролитов.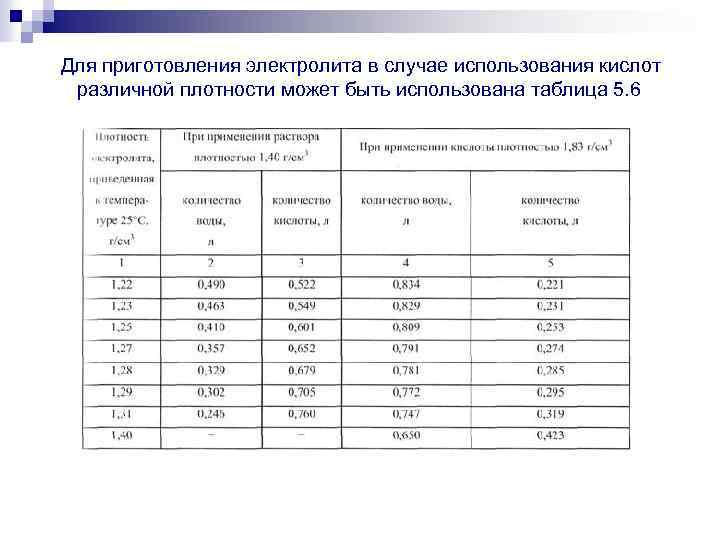
Неорганические твердые электролиты: Твердые материалы с высокой ионной проводимостью. Неорганические твердые электролиты, используемые в полностью твердых литий-ионных батареях, делятся на стеклянные электролиты и керамические электролиты.
Преимущества:
1. Твердые электролиты могут играть роль электролитов и заменять диафрагму в аккумуляторе.
2. Нет проблем с утечкой
3. Аккумулятор можно миниатюризировать и миниатюризировать, хотя количество миграций ионов лития в этом типе материала велико
Недостатки:
1. Электропроводность самого электролита намного меньше, чем у жидких электролитов.
2. Импеданс поверхности раздела между электролитом и материалом высок, когда такие материалы используются в литий-ионных батареях
3. Хрупкость неорганических твердых электролитов велика
4. Сейсмостойкость литий-ионных батарей как электролитов низкая .
| Органический жидкий электролит | Ионный жидкий электролит комнатной температуры | Гелевый электролит | Неорганический твердый электролит | Гелевый электролит | |
|---|---|---|---|---|---|
| состояний | жидкость | жидкость | Коллоид | Твердый | Коллоид |
| Место Li+ | нефиксированный | нефиксированный | Относительно фиксированный | фиксированный | Относительно фиксированный |
| Концентрация Li+ | низкий | высокий | низкий | Очень высокая | низкий |
| Проводимость | высокий | Немного высоковат | Немного высоковат | Немного низкий | Немного высоковат |
| безопасность | легковоспламеняющийся | отлично | Довольно хорошо | отлично | Довольно хорошо |
| цена | Дороговато | Очень дорого | Дороговато | дешевый | Дороговато |
Хотите получить более подробную информацию: Загрузите нашу электронную книгу по дизайну аккумуляторов.
Дизайн литиевой батареи Дизайн Электронная книга Скачать (2M, 20 страниц, PDF)
Какое влияние оказывает электролит литий-ионной батареи на работу батареи?
Влияние электролитов литий-ионных аккумуляторов на макроскопические электрохимические свойства аккумуляторов включает следующие аспекты:
Разберем их по порядку
1.
Влияние на емкость аккумулятораВо-первых, хотя материал электрода является необходимым условием для определения удельной емкости литий-ионных аккумуляторов, электролит также влияет на обратимую емкость аккумулятора. электродный материал в значительной степени.
То есть
Потому что процесс заливки, делития и процесс циркуляции электродного материала — это всегда процесс взаимодействия с электролитом. Это взаимодействие оказывает существенное влияние на состояние поверхности раздела электродного материала и изменения внутренней структуры.
Во-вторых, в рабочем процессе литий-ионных аккумуляторов помимо окислительно-восстановительных реакций, протекающих на положительном и отрицательном электродах при внедрении и удалении ионов лития, также имеет место большое количество побочных реакций.
Такие как
- окисление и восстановительное разложение электролитов на поверхности положительных и отрицательных электродов,
- пассивация поверхности электродно-активными веществами,
- высокий импеданс интерфейса между электродом и интерфейсом электролита….
Эти факторы влияют на способность электродного материала к внедрению и удалению лития.
Вот почему некоторые электролитные системы могут придать материалу электрода отличную способность к внедрению и удалению лития, в то время как некоторые электролитные системы очень разрушают материал электрода.
2.Влияние на внутреннее сопротивление батареи и увеличение характеристик заряда и разрядаКаково внутреннее сопротивление литий-ионных батарей?
Внутреннее сопротивление относится к сопротивлению току, когда он проходит через батарею. В него входят омическое внутреннее сопротивление и поляризационное сопротивление электрода при электрохимическом процессе. Для литий-ионных аккумуляторов оно должно включать сопротивление поверхности раздела между электродом и электролитом.
Для литий-ионных аккумуляторов оно должно включать сопротивление поверхности раздела между электродом и электролитом.
Таким образом, сумма омического внутреннего сопротивления, сопротивления границы электрод/электролит и внутреннего поляризационного сопротивления представляет собой общее внутреннее сопротивление литий-ионных аккумуляторов.
Это важный показатель для измерения производительности химических источников питания, который напрямую влияет на рабочее напряжение батареи, рабочий ток, выходную энергию и мощность.
Почему электролит влияет на внутреннее сопротивление батареи?
Внутреннее омическое сопротивление батареи в основном обусловлено проводимостью электролита и должно также включать сопротивление материала электрода и диафрагмы.
Механизмом проводимости электролитической части является ионная проводимость, и сопротивление во время процесса проводимости обычно намного больше, чем у электронной проводящей части.
Сопротивление поверхности раздела между электродом и электролитом имеет большое значение в литий-ионных батареях.
Чем больше сопротивление ионов лития при прохождении через интерфейс, тем выше внутреннее сопротивление аккумулятора. В нормальных условиях сопротивление интерфейса значительно выше внутреннего сопротивления в омах.
Почему электролит влияет на увеличение заряда и разряда?Определение скорости разряда и заряда:
Увеличение характеристик заряда и разряда является важным показателем для измерения способности сохранения емкости литий-ионных аккумуляторов в условиях быстрой зарядки и разрядки.
Причины, по которым электролит влияет на характеристики заряда и разряда:Характеристики заряда и разряда аккумулятора определяются
1. подвижность ионов лития в материале электрода,
2. проводимость электролита,
3. подвижность ионов лития на границе раздела фаз электрода или электролита.
Последние два тесно связаны с составом и свойствами электролита.
3.Влияние на диапазон рабочих температур аккумулятораИз-за большой температурной зависимости электродной реакции, протекающей на границе между электродом и фазой электролита, среди всех факторов окружающей среды температура оказывает наиболее очевидное влияние на аккумулятор производительность.
- В условиях низких температур скорость электродной реакции снижается, и даже реакция прекращается, а производительность батареи значительно снижается или даже не может нормально использоваться.
- При повышении температуры электродная реакция интенсифицируется, но одновременно усиливаются и побочные реакции на границе раздела фаз электрода или электролита. Эти побочные реакции часто очень разрушительны для батареи и влияют на ее производительность.
Таким образом, оптимальной температурой для работы батареи должна быть температура, наиболее благоприятная для электродной реакции без явных побочных реакций.
Например,
- диапазон рабочих температур жидкостных литий-ионных аккумуляторов обычно составляет -10-45℃;
- минимальная рабочая температура обычно не ниже -20℃,
- максимальная рабочая температура обычно не превышает 60℃.
1.расширить ассортимент жидкости электролита
2.улучшить проводимость электролита в условиях низких температур
3.улучшить стабильность электролита в условиях высоких температур.
Для твердых электролитов, чтобы расширить диапазон их рабочих температур,
- , чтобы попытаться увеличить проводимость электролита при комнатной температуре или даже при низкой температуре,
- уменьшает импеданс интерфейса между ним и материалом электрода.
Хотите узнать больше: загрузите нашу электронную книгу по дизайну аккумуляторов.
Lithium Battery Design Design Электронная книга Скачать (2M, 20 страниц, PDF)
4. Влияние на хранение и срок службы батареиСрок хранения:
Старение литий-ионных батарей при длительном хранении ключ к влиянию на характеристики хранения батарей. Даже если коммерческий литий-ионный аккумулятор никогда не используется, срок его хранения составляет всего около 3 лет.
Существует множество причин старения батареи. основные причины:Коррозия электрода коллекторной жидкости
Потеря электрохимической активности электродного активного вещества из коллекторной жидкости
Природа электролита тесно связана с коррозией коллектора жидкостью и стабильностью электродного материала в ней. Поэтому электролит в значительной степени влияет и даже определяет срок хранения батареи.
Для срока службы:
Срок службы является важным показателем для оценки достоинств вторичных батарей. Обычно измеряется количеством циклов, когда емкость батареи снижается до определенного значения.
Обычно измеряется количеством циклов, когда емкость батареи снижается до определенного значения.
1. стабильность материала электрода,
2. стабильность электролита,
3. скорость заряда и разряда ,
4.глубина заряда и разряда
5.температура. Для литий-ионных аккумуляторов
6.правильная эксплуатация и обслуживание,
основными дополнительными причинами короткого срока службы аккумулятора являются следующие:- Активная удельная поверхность активного вещества электрода во время зарядки и Процесс разряда продолжает уменьшаться, истинная плотность тока батареи при работе увеличивается, а внутреннее сопротивление батареи постепенно увеличивается.
- Активное вещество коллектора электродов отваливается или переносится, теряя должную электрохимическую активность
- Во время работы аккумулятора некоторые материалы в электролите стареют или подвергаются коррозии
- Мембрана повреждена или частично закрыта
- Из-за реакции окисления или восстановления электролита на границе раздела электродов количество примесей в электролите увеличивается
Из-за влияния вышеперечисленных факторов нормальный срок службы литий-ионных аккумуляторов в настоящее время составляет около 2-3 лет, причем большинство из вышеперечисленных факторов имеют определенную связь с характером электролита.
Литий-ионные аккумуляторы заменяют растворение и отложение металлического лития в традиционных литиевых вторичных аккумуляторах с механизмом хранения лития внутри решетки, устраняя рост дендритного лития на поверхности отрицательного электрода и уменьшая вероятность короткого замыкания батареи, но это не устраняет принципиально риски безопасности батареи.
Например, жидкие литий-ионные батареи также будут осаждать металлический литий на поверхности отрицательного электрода в условиях перезарядки, в то время как поверхность положительного электрода будет окисляться и разлагать электролит в условиях высокого потенциала, и внутри будет происходить ряд небезопасных побочных реакций. батарея.
Кроме того, большое количество тепла, выделяемого аккумулятором в условиях сильноточного заряда и разряда, не может быть потеряно во времени, что приводит к быстрому повышению температуры аккумулятора, что также создает серьезные проблемы с безопасностью для батарея.
- стабильность материала электрода,
- Состав электролита,
- производственный процесс
- условия работы самой батареи
Однако,
основной причиной проблемы безопасности жидких литий-ионных аккумуляторов является летучесть и высокая воспламеняемость самого органического жидкого электролита.
Таким образом, чтобы полностью устранить риски безопасности, связанные с батареями, необходимо исключить воспламеняемость органических растворителей.
Хотите узнать больше: загрузите нашу электронную книгу по дизайну аккумуляторов.
Lithium Battery Design Design Электронная книга Скачать (2M, 20 страниц, PDF)
6. Влияние на характеристики саморазряда батареи Скорость саморазряда литий-ионных батарей определяется:- тип и структура электродного материала,
- свойства интерфейса электрод/электролит,
- состав электролита
- производственный процесс батареи.

- Саморазряд отрицательного электрода.
Саморазряд отрицательного электрода в основном происходит из-за выпадения лития из отрицательного электрода или попадания в электролит в виде Li+.
Скорость зависит от состояния поверхности и поверхностной каталитической активности отрицательного электрода. Состояние поверхности отрицательного электрода, очевидно, зависит от электролита, поэтому оптимизация состава электролита может снизить плотность саморазряда батареи.
- Саморазряд положительного электрода:
Это относится к ионам лития в электролите, внедренным в решетку материала положительного электрода, что вызывает саморазряд положительного электрода. Его скорость зависит от кинетических факторов в положительном электроде, залитом Li+, в основном от свойств поверхности раздела положительного электрода или электролита.
Кроме того, появление примесей в электролите также является важной причиной саморазряда аккумулятора.
Это связано с тем, что потенциал окисления примесей обычно ниже, чем потенциал положительного электрода литий-ионных аккумуляторов, который легко окисляется на поверхности положительного электрода, а оксид будет восстанавливаться на отрицательном электроде, таким образом, непрерывно потребляя активные вещества материалов положительных и отрицательных электродов, вызывая саморазряд.
Поэтому к литий-ионным аккумуляторам предъявляются высокие требования к составу и чистоте электролитов.
7. Влияние на перезарядку и переразрядку аккумулятораПоскольку электролит литий-ионного аккумулятора не может обеспечить защиту от перезаряда или чрезмерного разряда при нормальной работе аккумулятора, способность аккумулятора противостоять перезаряду и чрезмерному разряду снижается. очень бедный.
При некоторых практических условиях применения: Когда несколько литий-ионных аккумуляторов используются последовательно для получения более высокого напряжения, часто возникает значительное несоответствие емкости.
Когда аккумулятор заряжен, отдельные аккумуляторы всегда будут перезаряжены,
При разрядке отдельные аккумуляторы также будут переразряжены.
Этот аспект приводит к необратимому повреждению батареи и влияет на срок службы батареи; в то же время это также создает очевидные риски для безопасности батареи.
Почему электролит литиевых батарей влияет на перезарядку и чрезмерную разрядку?Модификация и модификация электролитов является важным способом предотвращения перезарядки и разрядки аккумуляторов.
Органический жидкий электролит имеет встроенный механизм защиты от перезарядки и разрядки.
Например, в электролит добавляют некоторые наркотические вещества. В условиях перезарядки вещество окисляется на положительном электроде, а окислитель восстанавливается на поверхности отрицательного электрода
, что позволяет избежать постоянного повышения напряжения батареи.
(1) Он должен быть хорошим ионным проводником и электронным изолятором, чтобы перенос ионов (Li+) был легким, а саморазряд сводился к минимуму;
(2) Должен иметь широкое электрохимическое окно, чтобы не происходила деградация электролита в диапазоне рабочих потенциалов как катода, так и анода;
(3) Он также должен быть инертным по отношению к другим компонентам элемента, таким как сепараторы элементов, подложки электродов и материалы для упаковки элементов;
(4) Должен быть термически стабильным, для жидких электролитов точки плавления и кипения должны быть намного выше рабочих температур;
(5) Он должен иметь низкую токсичность и соответствовать другим мерам ограниченной опасности для окружающей среды;
(6) Он должен быть основан на устойчивой химии, что означает, что элементы в изобилии, а процессы синтеза являются как можно менее вредными, и
(7) он должен иметь как можно более низкую общую стоимость, материалы и производство.
Какой электролит используется в литий-ионных батареях?
Большинство электролитов, используемых в коммерческих литий-ионных батареях, представляют собой неводные растворы. И соль гексафторфосфата лития (LiPF 6 ), растворенная в органических карбонатах. Гексафторфосфат лития (LiPF6) представляет собой раствор соли лития, который является наиболее распространенным электролитом в литиевых батареях.
Из чего состоит электролит батареи?
Электролит в большинстве бытовых аккумуляторов (и многих промышленных) состоит из двух частей: воды и гидроксида калия (КОН). Когда эти два компонента объединяются друг с другом, они образуют раствор, который позволяет электричеству свободно течь между электродами внутри элемента батареи — это известно как «электролиз» или «электролитическое действие».
Безопасен ли электролит литиевой батареи?
Да.
Литиевые батареи более безопасны, чем большинство других типов батарей, поскольку они не содержат тяжелых металлов или токсичных химических веществ.



 Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.
Тонкий слой изоляционного материала, называемый «сепаратором», находится в растворе электролита между двумя сторонами батареи. Сепаратор позволяет ионам лития проходить, блокируя электроны и разделяя два электрода. Во время зарядки ионы лития перемещаются через сепаратор с положительной стороны на отрицательную. Разряжаясь, ионы движутся в противоположном направлении.