Что представляет собой электролит и насколько он опасен
Электролит в автомобильных аккумуляторах, представленных в продаже, — та среда, в которой происходят химические реакции, в результате которой происходит накопление и отдача электроэнергии для питания электрооборудования транспортного средства при выключенном двигателе.
Электролит, присутствующий в автомобильных и мотоаккумуляторах, представлен разбавленной серной кислотой. Это – агрессивная химическая среда, требующая осторожного обращения. Попадание брызг электролита на кожу или в глаза вызывает очень болезненные ощущения и ожоги. Вылечить их трудно.
Свинцово-кислотный АКБ — один из самых распространенных типов аккумуляторных батарей, использующийся как источник электроэнергии в автомобилях, мотоциклах, мопедах и прочих ТС. Необходимость купить автомобильные аккумуляторы этого типа возникает у большинства авто-мото-любителей. Вот почему с электролитом приходится иметь дело многим владельцам транспортных средств.
- Серная кислота (h3SO4) – ядовитое вещество, поэтому, работая с АКБ, обязательно надевайте специальные очки, резиновые перчатки и фартук. Они защитят от ожогов, порчи кузова машины, мотоцикла и т.д., одежды.
- На этот случай всегда имейте под рукой нейтрализующие аккумуляторную кислоту средства – раствор нашатырного спирта или соду. При попадании электролита на тело и проч. сразу же нейтрализуйте ее действие, потом смойте струей воды. При попадании в глаза промывайте их не менее четверти часа, после чего сразу же обращайтесь к врачу.
- Если Вы предпочитаете не покупку готового электролита для АКБ своего автомобиля или мототехники, а готовите самостоятельно, то советуем вливать концентрированную h3SO4 в воду тонкой струей (только в не металлическую емкость), постоянно помешивая раствор. Поступать наоборот — вливать воду в кислоту — недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны.

- При постановке свинцово-кислотных автоаккумуляторов на зарядку, не закручивайте пробки заливочных емкостей. Дайте образующимся в процессе зарядки батареи газам свободный выход иначе корпус АКБ взорвется.
- При постановке кислотных обслуживаемых аккумуляторов обязательно выкручиваются пробки заливочных отверстий для свободного выхода образующихся в процессе зарядки газов. В противном случае скопившийся в корпусе водород взорвет аккумулятор.
Выбирая автомобильный аккумулятор в Балашихе или Реутове, можно остановиться на современной необслуживаемой модели. Если же Вы предпочитаете обслуживаемую АКБ, то при работе с ней не пренебрегайте общими мерами предосторожности.
Поблизости от заряжающейся батареи нельзя допускать открытого огня, искр (проводить сварные работы, например), короткого замыкания, курить. Помещение, где происходит зарядка, должно хорошо проветриваться. Если есть необходимость в проверке токопроводящих кабелей автомобиля, то обесточьте электрическую систему и не включайте зажигание.
Какая кислота в аккумуляторе автомобиля: состав, характеристики
Длительный срок службы АКБ во многом зависит от состояния залитого электролита. Последний представляет собой кислотно-водный раствор. Чтобы контролировать его качество надо знать и какая кислота в аккумуляторе автомобиля, и её свойства. Это может пригодиться при покупке сухозаряженных источников питания, когда надо самостоятельно определяться с заливаемой жидкостью. Но особенно этот вопрос актуален для районов с экстремальными климатическими условиями.
Содержание:
- 1 Название и роль кислоты электролита
- 1.1 Основные процессы, протекающие при разряде
- 2 Электролит и его характеристики
- 2.
 1 Температура и рекомендуемая плотность
1 Температура и рекомендуемая плотность
- 2.
- 3 Изменение плотности раствора
- 3.1 Соотношение заряда и плотности электролита
- 4 Присадки
Название и роль кислоты электролита
Источник энергии фактически является стандартной батареей. Внутри её находятся анод и катод, а также аккумуляторная жидкость или электролит. Последний представлен раствором кислоты с дистиллированной водой в процентном соотношении 30 к 70, соответственно. Такая пропорция компонентов обеспечивает наиболее эффективное взаимодействие жидкости со свинцовыми пластинами.
Обычная вода содержит примеси, уменьшающие срок службы батареи. А какая кислота в аккумуляторе автомобиля обеспечит появление тока? Та, что вступает в реакции обмена с разными металлами и оксидами, которые необходимы для функционирования батареи. Самым активным из подобных веществ является триоксид серы или ангидрид с химической формулой h3SO4. Более известное и распространённое среди обывателей название — серная кислота.
Когда подключается внешняя нагрузка, тогда взаимодействие жидкости со свинцом и оксидами приводит к необходимым окислительно-восстановительным реакциям. Они противоположны при заряде и разряде батареи. Ток возникает за счёт выделения электронов из свинца положительного элемента, которые принимает оксид отрицательной пластины. А передача заряженных частиц осуществляется благодаря действию раствора, который заливается в батарею.
Основные процессы, протекающие при разряде
На контактах АКБ происходят следующие химические процессы:
- на катоде восстанавливается оксид свинца;
- тратится триоксид серы;
- появляется вода;
- на аноде образуется окись металла.
Получается, что во время реакции кислоту заменяет более лёгкая вода. В результате плотность аккумуляторной жидкости падает. При заряде процессы идут в обратном направлении. После этого под действием возникающего тока начинается электролиз, то есть распад на водород и кислород. Происходит их выделение в газообразной форме.
Электролит и его характеристики
Параметры растворов определяют потери энергии и даже условия эксплуатации машин, то есть рабочую температуру. Нормативно характеристики регулируются стандартом ГОСТ 667-73. В большей степени физико-химические свойства зависят от пропорций содержащихся компонентов. Плотность раствора определяется соотношением кислоты и воды. Именно она является самым важным свойством электролитов для аккумуляторов. Эта величина должна укладываться в пределы от 1,07 до 1,3 г/мл. Изменение концентрации кислоты поднимает или снижает порог замерзания. От неё же зависит электрическая проводимость, которая обратно пропорциональна сопротивлению АКБ. Обледенение ведёт к повреждению и полному разрыву банок в автомобильных аккумуляторах. При низких температурах плотность рабочей смеси рекомендуется повышать до 1,31 г/см³. С точки зрения электропроводности, это не самый лучший показатель. Но уменьшение может вызвать замерзание жидкости. Оптимальная величина с минимальным сопротивлением соответствует комнатной температуре и составляет 1,23 г/см³. Какую кислотность выбирать для идеального баланса между потерями энергии и соответствия конкретным климатическим условиям описано в таблице.
При низких температурах плотность рабочей смеси рекомендуется повышать до 1,31 г/см³. С точки зрения электропроводности, это не самый лучший показатель. Но уменьшение может вызвать замерзание жидкости. Оптимальная величина с минимальным сопротивлением соответствует комнатной температуре и составляет 1,23 г/см³. Какую кислотность выбирать для идеального баланса между потерями энергии и соответствия конкретным климатическим условиям описано в таблице.
Температура и рекомендуемая плотность
| Среднемесячная температура, 0С | Время года | Плотность электролита, г/см³ |
| от -50 до -30 | зима | 1,28 |
| от -50 до -30 | лето | 1,24 |
| от -30 до -15 | круглый год | 1,27 |
| от -15 до -8 | круглый год | 1,24 |
| от -8 до +4 | круглый год | 1,20 |
| от -15 до +4 | круглый год | 1,22 |
Таблица 1. Зависимость плотности электролита от температуры зимой и летом.
Зависимость плотности электролита от температуры зимой и летом.
Важно! Когда используется раствор с оптимальными для определённого времени года параметрами, тогда срок эксплуатации источника питания будет значительно продлён. Дело в том, что чрезмерно концентрированная смесь, залитая в тёплое время года, негативно, даже разрушительно влияет на автомобильный аккумулятор. Высокая плотность не только увеличивает потери энергии. Серный ангидрид до такой степени активное и едкое вещество, что он способен полностью разрушить электроды.
Изменение плотности раствора
Если снизить кислотность можно добавлением воды, то с увеличением так не получится. Плотность жидкости, залитой в аккумулятор, регулируется степенью заряженности батареи. Чем вторая величина выше, тем больше первая. Это объясняется тем, что по окончании окислительных и восстановительных реакций нередко происходит распад воды на составляющие в газообразном состоянии. То есть она теряется, а повышается концентрация кислоты в электролите. С помощью заряда избавляются от недостатка плотности. Если же и это не помогает — используют корректирующий электролит.
С помощью заряда избавляются от недостатка плотности. Если же и это не помогает — используют корректирующий электролит.
Соотношение заряда и плотности электролита
| Плотность при 25°С, г/см. куб. | Степень заряженности, % |
| 1,27 | 100 |
| 1,23 | 75 |
| 1,21 | 62,5 |
| 1,19 | 50 |
| 1,15 | 25 |
| 1,13 | 12,56 |
| 1,12 | 6 |
| 1,11 | 0 |
Таблица 2. Зависимость плотности электролита от величины заряда аккумуляторной батареи.
Присадки
Рынок предлагает огромное количество различных добавок, которые заливают в батарею для повышения качества электролита. Производители обещают улучшение запуска в морозы, увеличение срока службы, восстановление работоспособности АКБ и повышение энергоёмкости. Основное их действие — это десульфатация, но не настолько сильная, как заверяет реклама. Остальное не имеет достаточного подтверждения. Состав присадок редко раскрывают. Чаще всего это сульфаты или фосфаты металлов. Встречаются и средства из органических соединений. Причём вторые добавляют к аккумуляторной жидкости вместе с первыми. Для поддержания наилучшего состояния АКБ достаточно убирать его в период сильного похолодания в тёплое помещение или подзаряжать. Но это подойдёт, если говорить о регионах с умеренным климатом. Когда речь идёт о работе в экстремальных температурах, выгоднее может оказаться приобретение сухозаряженной батареи. Владелец сможет самостоятельно заливать электролит, максимально подходящий к условиям эксплуатации. На видео ниже показано, как из электролита получить серную и соляную кислоты. https://youtu.be/DTUom2xCh7M
Остальное не имеет достаточного подтверждения. Состав присадок редко раскрывают. Чаще всего это сульфаты или фосфаты металлов. Встречаются и средства из органических соединений. Причём вторые добавляют к аккумуляторной жидкости вместе с первыми. Для поддержания наилучшего состояния АКБ достаточно убирать его в период сильного похолодания в тёплое помещение или подзаряжать. Но это подойдёт, если говорить о регионах с умеренным климатом. Когда речь идёт о работе в экстремальных температурах, выгоднее может оказаться приобретение сухозаряженной батареи. Владелец сможет самостоятельно заливать электролит, максимально подходящий к условиям эксплуатации. На видео ниже показано, как из электролита получить серную и соляную кислоты. https://youtu.be/DTUom2xCh7M
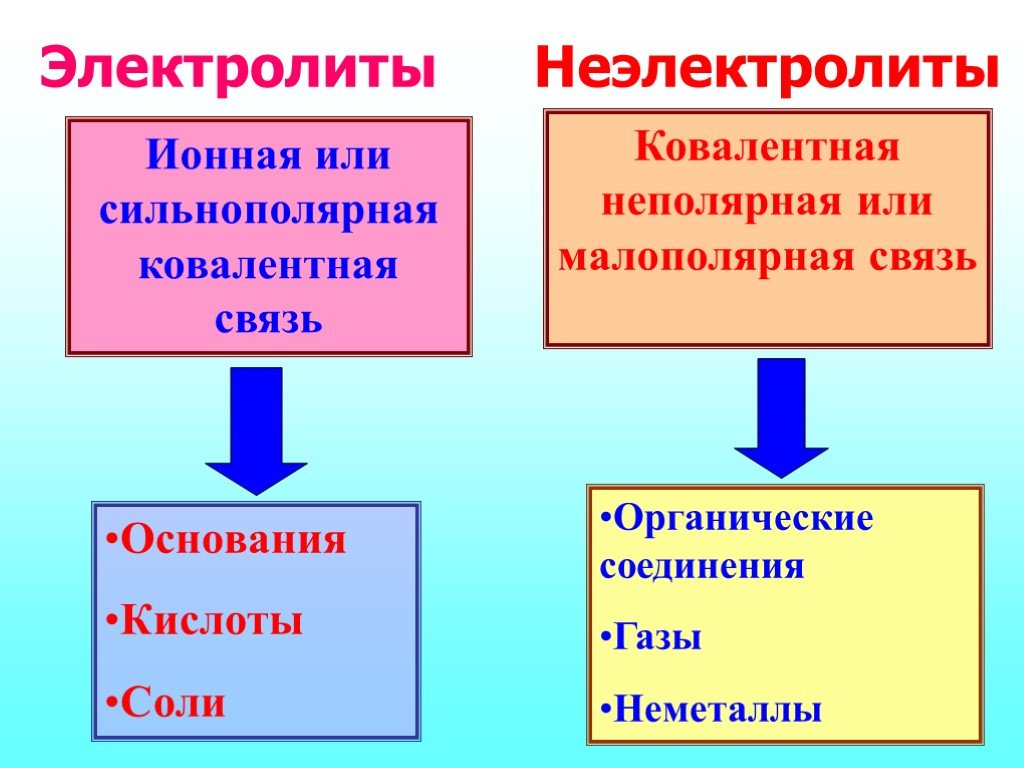
Электролиты — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31605
Развитие навыков
- Определите, что такое электролиты.

- Различают сильные и слабые электролиты.
- Объясните, что происходит при растворении электролитов в воде.
- Приведите выражение константы равновесия для ионизации.
- Объясните ионное произведение воды, автоионизацию воды и рН.
- Рассчитать процент ионизации слабых электролитов.
- Объясните реакции метатезиса.
Одним из важнейших свойств воды является ее способность растворять самые разнообразные вещества. Растворы, в которых растворяющей средой является вода, называются 9.0042 водные растворы . Для электролитов вода является наиболее важным растворителем. Этанол, аммиак и уксусная кислота являются одними из неводных растворителей, способных растворять электролиты.
Электролиты
Вещества, дающие ионы при растворении в воде, называются электролитами . Их можно разделить на кислоты, основания и соли, так как все они дают ионы при растворении в воде. Эти растворы проводят электричество благодаря подвижности положительных и отрицательных ионов, которые называются 9-_{\large{(aq)}}}\)
Поскольку \(\ce{NaCl}\) представляет собой ионное твердое вещество (s), которое состоит из катионов \(\ce{Na+}\) и анионы \(\ce{Cl-}\), молекулы \(\ce{NaCl}\) отсутствуют в \(\ce{NaCl}\) твердом или \(\ce{NaCl}\) растворе. -}\) 9+] = 7}\).
-}\) 9+] = 7}\).
Обратите внимание, что только при 298 К рН воды = 7. При более высоких температурах рН немного меньше 7, а при более низких температурах рН больше 7.
Электролиты в жидкостях организма
Наше тело жидкости – растворы электролитов и многое другое. Сочетание крови и системы кровообращения является рекой жизни , потому что она координирует все жизненные функции. Когда сердце перестает качать кровь при сердечном приступе, жизнь быстро заканчивается. Перезапуск сердца как можно скорее имеет решающее значение для поддержания жизни.
Основными электролитами, необходимыми для жидкости организма, являются катионы (кальция, калия, натрия и магния) и анионы (хлориды, карбонаты, аминоацетаты, фосфаты и йодиды). Они питательно называются макроминералами .
Электролитный баланс имеет решающее значение для многих функций организма. Вот несколько крайних примеров того, что может произойти при дисбалансе электролитов: повышенный уровень калия может привести к сердечной аритмии; снижение внеклеточного калия вызывает паралич; избыток внеклеточного натрия вызывает задержку жидкости; а пониженное содержание кальция и магния в плазме может вызывать мышечные спазмы конечностей.
При обезвоживании пациента для поддержания здоровья и хорошего самочувствия требуется тщательно приготовленный (имеющийся в продаже) раствор электролита. С точки зрения здоровья ребенка пероральный электролит необходим, когда ребенок обезвожен из-за диареи. «Использование пероральных поддерживающих растворов электролитов, которое спасло миллионы жизней во всем мире за последние 25 лет, является одним из самых важных медицинских достижений в области защиты здоровья детей в этом столетии», — объясняет Джуилус Г.К. Гепп, доктор медицинских наук, заместитель директора отделения неотложной педиатрической помощи Детского центра больницы Джона Хопкинса. Если родитель обеспечивает пероральный поддерживающий раствор электролитов в самом начале болезни, обезвоживание можно предотвратить. Функциональность растворов электролитов связана с их свойствами, и интерес к растворам электролитов выходит далеко за рамки химии. 9- \rightarrow Cu_{\large{(s)}}}\)
В сухих камерах раствор заменяют пастой, чтобы раствор не вытекал из упаковки. В этой ячейке электрод \(\ce{Zn}\) и \(\ce{Cu}\) имеет напряжение 1,10 В, если концентрации ионов соответствуют указанным.
В этой ячейке электрод \(\ce{Zn}\) и \(\ce{Cu}\) имеет напряжение 1,10 В, если концентрации ионов соответствуют указанным.
Химические реакции электролитов
При объединении растворов электролитов катионы и анионы встретятся друг с другом. Когда ионы безразличны друг к другу, реакции нет. Однако некоторые катионы и анионы могут образовывать молекулы или твердые тела, и, таким образом, катионы и анионы меняют партнеров. Они называются реакциями метатезиса, которые включают:
- Образование твердого вещества (или осаждение) реакции: катионы и анионы образуют менее растворимое твердое вещество, что приводит к появлению осадка.
- Нейтрализация реакции: \(\ce{H+}\) кислоты и \(\ce{OH-}\) основания объединяются с образованием нейтральной молекулы воды.
- Газообразование реакции: Когда в реакции образуются нейтральные газообразные молекулы, они покидают раствор, образуя газ.
Окислительно-восстановительные реакции также возможны между различными ионами. На самом деле работа батареи связана с окислительно-восстановительными реакциями. 92+}\)
На самом деле работа батареи связана с окислительно-восстановительными реакциями. 92+}\)
Подсказка: e. любой анион
Объяснять движение ионов в растворе электролитов.
- Движутся ли положительные ионы в соляном мостике?
Подсказка: да
Ионы двух типов движутся в противоположных направлениях.
Навык:
Объяснять движение ионов в растворе электролитов.
- Какой раствор следует использовать для электрода \(\ce{Cu}\) ?
- любая соль цинка
- любая соль меди
- любой хлорид
- любая соль
- кислота
- база
Подсказка: б.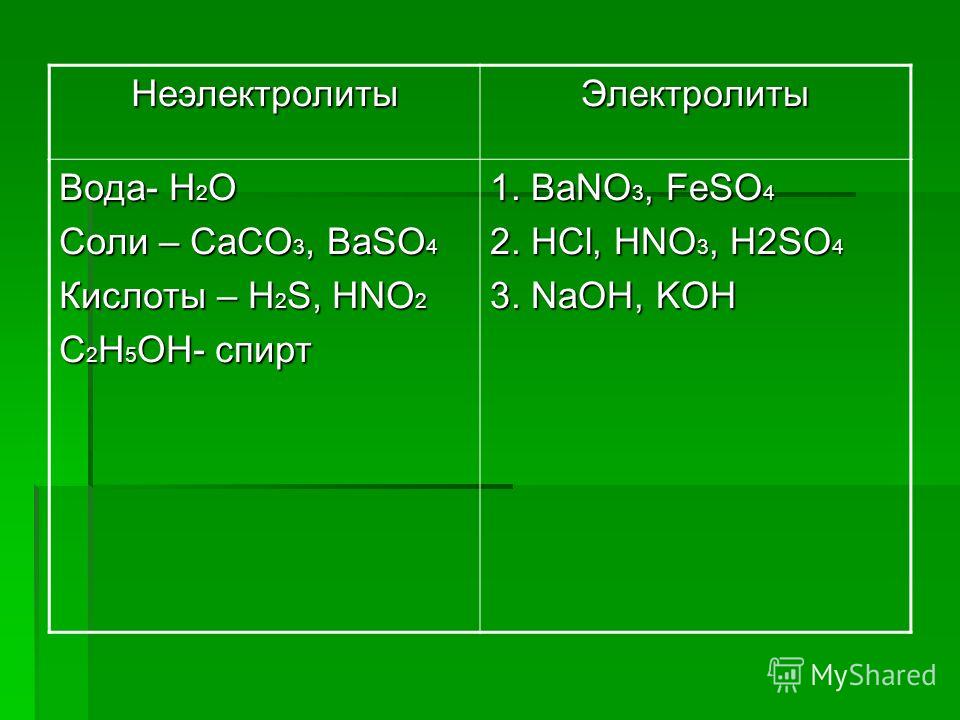 любая соль меди
любая соль меди
Любая соль может быть использована для \(\ce{Zn}\)-электрода. Но для электрода \(\ce{Cu}\) обычно используется \(\ce{CuSO4}\) или \(\ce{CuCl2}\).
Навык:
Применять химические знания для настройки батарей.
- Что из следующего вы будете использовать в качестве солевого моста?
- твердый \(\ce{NaCl}\)
- концентрированный \(\ce{NaCl}\) раствор
- \(\ce{HNO3}\) раствор
- концентрированный \(\ce{h3SO4}\) раствор
- вода деионизированная
- любая твердая соль
Подсказка: б. \(\ce{NaCl}\) раствор
Обычно используют раствор соли, но подойдут и растворы кислот и оснований. \(\ce{NaCl}\) экономичен и удобен в обращении.
- Какой раствор лучше всего проводит электричество? Все растворы имеют одинаковую концентрацию в М.

- спирт
- аммиак
- сахар
- уксусная кислота
- поваренная соль
Подсказка: e. соль поваренная
Умение:
Различать сильные и слабые электролиты.
- Какой из следующих растворов имеет самый высокий pH?
- 0,10 М \(\ce{NaCl}\) раствор
- 0,10 М \(\ce{HCl}\) раствор
- Вода при 273 К (точка замерзания воды)
- Вода при 293 К (комнатная температура)
- Вода при 373 К (точка кипения воды)
Подсказка: c. вода при низкой температуре
См. рН.
Навык:
Определение и оценка рН.
- При смешивании растворов электролитов катионы и анионы обмениваются партнерами.
 Эти реакции называются:
Эти реакции называются: - реакции горения
- окислительно-восстановительные реакции
- реакции окисления
- реакции восстановления
- реакции метатезиса
См. Редокс.
Навык:
Объяснять реакции метатезиса.
Авторы и авторство
Электролиты распространяются по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- кислота
- анионы
- водные растворы
- база
- базы
- Жидкости для тела
- Катионы
- электролит
- Электролиты
- константа равновесия
- Газообразование
- ионное твердое вещество
- Макроминералы
- нейтрализация
- соль
- соли
- Твердое образование
- сильные электролиты
- слабые электролиты
Сильные и слабые электролиты Учебное пособие
ВВЕДЕНИЕ:
Где мы используем электролиты в повседневной жизни? Предположить. Разве мы не используем соль в пищу? Это электролит. Те специальные спортивные напитки, которые предлагаются спортсменам, также являются электролитами. Моющее средство, которое мы используем для стирки одежды, снова является электролитом. Вот несколько примеров, когда электролиты играют важную роль в нашей повседневной жизни.
Разве мы не используем соль в пищу? Это электролит. Те специальные спортивные напитки, которые предлагаются спортсменам, также являются электролитами. Моющее средство, которое мы используем для стирки одежды, снова является электролитом. Вот несколько примеров, когда электролиты играют важную роль в нашей повседневной жизни.
Источник
НО ВОЗНИКАЕТ ВОПРОС: ЧТО ТАКОЕ ЭЛЕКТРОЛИТ?
Электролиты представляют собой вещества, которые превращаются в ионы (атом или молекулу с суммарным электрическим зарядом), когда они растворяются в воде и приобретают способность проводить электричество. Положительно заряженный ион называется катионом, а отрицательно заряженный ион называется анионом.
По принципу ионизации (диссоциации на составляющие ионы) в водном растворе электролиты бывают 2-х типов: сильные и слабые.
Источник
СИЛЬНЫЙ ЭЛЕКТРОЛИТ:
Сильные кислоты, основания и соли являются примерами сильных электролитов. В водном растворе эти соединения диссоциируют на ионы.
ПРИМЕРЫ:
- HCl — соляная кислота
- HBr — Бромистоводородная кислота
- HI — Йодоводородная кислота
- NaOH — Гидроксид натрия
- NaCl — Хлорид натрия
СЛАБЫЙ ЭЛЕКТРОЛИТ:
В воде слабые электролиты лишь частично распадаются на ионы. Слабые кислоты, основания и ряд других веществ являются примерами слабых электролитов. Большинство азотсодержащих веществ являются слабыми электролитами.
ПРИМЕРЫ:
- HF — Плавиковая кислота
- CH₃CO₂H — Уксусная кислота
- NH₃ — Аммиак
- H₂O — Вода
Источник
ВЫВОД:
- Электролит – это вещество, которое растворяется в воде и приобретает способность проводить электричество.
- Существует два типа электролитов — сильные и слабые электролиты.
- Сильный электролит — это электролит, почти полностью растворяющийся в воде. Примером сильного электролита является хлороводород (HCl).