Как работает аккумулятор — принцип работы АКБ простыми словами
Содержание
- Понятие аккумулятор и его устройство
- Как работает аккумулятор (АКБ) при разряде
- Работа аккумулятора при заряде
- Способы соединения аккумуляторов (как работает аккумулятор)
- Параллельное соединение (как работает аккумулятор)
- Последовательное соединение (как работает аккумулятор)
- Компоновка АКБ
- Виды аккумуляторов
- Классификация АКБ по составу активного вещества
- Виды АКБ
- Классификация батарей по типу электролита
- Как работает аккумулятор — АКБ
- Материалы АКБ
- Пластины
- Сепараторы
- Литий-ионные аккумуляторы
- Электролит
- Гелевые электролиты
- Графен-полимерные аккумуляторы
- Основные технические характеристики аккумуляторов
- Номинальная емкость аккумулятора
- Пусковой ток
- Полярность
- Устройство корпуса
- Тип крепления аккумулятора
- Заключение
Аккумулятор или сокращённо (АКБ), это основное и необходимое устройство в любом автомобиле. Каждый водитель знает, что серце его машины — это конечно же аккумулятор, и нет таких машин с двигателем внутреннего сгорания, где бы его не было. Как бы это устройство не менялось за 150 лет с момента его изобретения, принцип работы аккумуляторной батареи остался низменным. Однако, современность внесла серьёзные коррективы в технологические процессы их изготовления. В этой статье вы ознакомитесь с и используемыми материалами, из чего состоит аккумулятор и как он работает. Итак, как работает аккумулятор (АКБ)?
Каждый водитель знает, что серце его машины — это конечно же аккумулятор, и нет таких машин с двигателем внутреннего сгорания, где бы его не было. Как бы это устройство не менялось за 150 лет с момента его изобретения, принцип работы аккумуляторной батареи остался низменным. Однако, современность внесла серьёзные коррективы в технологические процессы их изготовления. В этой статье вы ознакомитесь с и используемыми материалами, из чего состоит аккумулятор и как он работает. Итак, как работает аккумулятор (АКБ)?
Понятие аккумулятор и его устройство
В общем понимании этого слова в технике под термином «Аккумулятор» подразумевается устройство, позволяющие при разных условиях эксплуатации накапливать определенный вид энергии, либо же — расходовать ее для человеческих нужд.
Хотите узнать, как построить энергосберегающий дом? Смотрите секреты строительства дома , который сам экономит
Применимы в тех ситуациях, когда необходимо собрать энергию за определенное время, после чего использовать ее для совершения больших трудоемких процессов.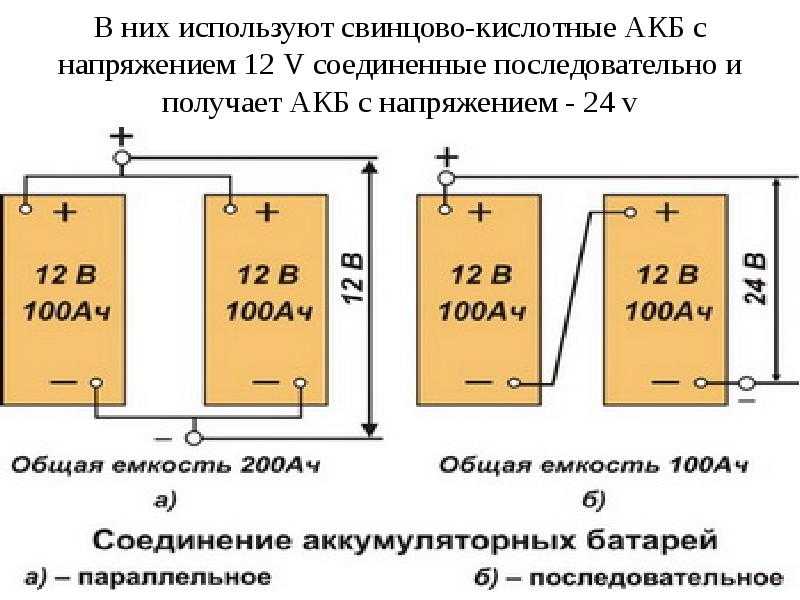 Так — гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Так — гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по такому же принципу: когда вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а после отдают его подключенным приборам для совершения дальнейшей работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
В процессе работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
Узнайте больше о самовозобновляемой и бесплатной энергии будущего. Солнечные батареи в действии.
На рисунке ниже изображена схема устройства аккумулятора. Изображен тот вид, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
Как работает аккумулятор (АКБ) при разряде
В момент, когда к электродам подключена нагрузка в виде лампочки, создается замкнутая электрическая цепь, через которую протекает ток разряда. Его формированию способствует движение электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
Заряд и разряд аккумулятораВ данном примере в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
Общее устройство и маркировка аккумуляторных батарейРабота аккумулятора при зарядеБеря за основу отключенную нагрузку на клеммы пластин, подаем постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.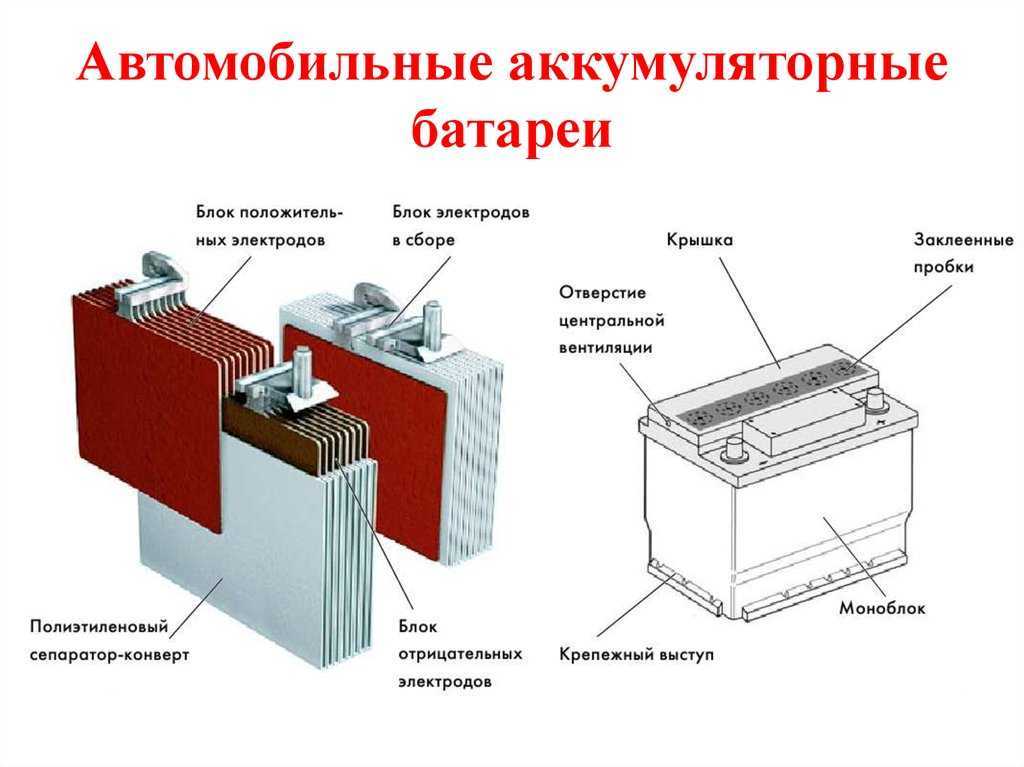
Таким образом мощность зарядного устройства всегда больше, чем та, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. Это приводит к изменениям внутренних химических процессов между электродами и электролитом. К примеру на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов (как работает аккумулятор)Параллельное соединение (как работает аккумулятор)
Величина разряда тока, зависит от многих факторов, хотя в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Чтобы зарядить такую конструкцию потребуется поднять мощность источника. Этот способ используется редко для готовых конструкций, в настоящее время куда проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
Чтобы зарядить такую конструкцию потребуется поднять мощность источника. Этот способ используется редко для готовых конструкций, в настоящее время куда проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
Последовательное соединение (как работает аккумулятор)
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. На самом деле этот диапазон гораздо шире. И многим электрическим приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, делают это зачастую в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.
Часто среди водителей транспорта, под понятием «аккумулятор» принято понимать любое устройство, независящее от количества его составных элементов — банок. Это не является правильным. Собранная из нескольких последовательно подключенных банок конструкция считается уже батареей, за которой закрепилось сокращенное название «АКБ». Ее внутреннее устройство показано на рисунке.
Это не является правильным. Собранная из нескольких последовательно подключенных банок конструкция считается уже батареей, за которой закрепилось сокращенное название «АКБ». Ее внутреннее устройство показано на рисунке.
Любая банка состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Благодаря соединению пластин в блоки увеличивается их рабочая площадь. Это снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
Компоновка АКБ
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
Компоновка кислотной аккумуляторной батареи (АКБ)Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами. Они обычно имеют конусную форму, для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». При этом есть одно правило: во избежании ошибок при подключении, диаметр положительной клеммы немного больше, чем у отрицательной.
Они обычно имеют конусную форму, для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». При этом есть одно правило: во избежании ошибок при подключении, диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки помещена заливная горловина, чтобы контролировать уровень электролита либо доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, предохраняющая внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Для того, чтобы предотвратить бурное выделение газов из электролита, который возможен при интенсивной езде, в пробках делаются отверстия для предотвращения повышения давления внутри банки. И через эти отверстия выходят кислород и водород, а также пары электролита. Такие ситуации, связанные с чрезмерными токами заряда, желательно избегать.
На том же рисунке выше показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, что сопровождается изменением химического состава активной массы электродов с выделением или поглощением в электролит (серную кислоту) воды.
Этим явлением можно объяснить повышение удельной плотности электролита при заряде, а так же снижение при разряде батареи. Иными словами, величина плотности дает возможность оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
В состав электролита кислотных батарей входит дистиллированная вода. Она же при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Виды аккумуляторов
Классификация АКБ по составу активного вещества
Свинцовые пластины, используемые в старых аккумуляторах перестали устраивать потребителей. Таким образом, возникала необходимость по улучшению качества работы АКБ. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, характерной чертой которых является более редкий процесс долива воды.
Таким образом, возникала необходимость по улучшению качества работы АКБ. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, характерной чертой которых является более редкий процесс долива воды.
При использовании металлического кальция для покрытия пластин появились кальциевые энергосберегающие источники. В предыдущих моделях потери воды из-за электролиза на 12 вольт нуждались в постоянном доливе, а кальций позволил повысить этот порог до 16 вольт. Так появилась возможность в производстве необслуживаемых аккумуляторов и использовать герметичный, неразборной корпус.
Виды АКБ
- Сурьмянистые батареи. Этот вид относится к классике из-за повышенного состава сурьмы, которая ускоряет процесс электролиза.
- АКБ со свинцом. В малосурьмянистых АКБ материалом для пластин служит свинец с небольшой примесью сурьмы.
 В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ. - Калициевые источники. При производстве кальциевых источников свинцовые пластины легированы до 0,1% кальцием. Они могут иметь различные заряды, как отрицательный, так и положительный.
- Гибридные источники энергии вытесняют кальциевые. При их производстве, две объединенные основные технологии имеют конструктивные отличия: одна, когда пластины формируются из сплава свинца и сурьмы, положительные электроды, а другая – когда пластины формируются из сплава свинца и кальция, отрицательные электроды.
- EFB является улучшенной жидкозаполненной батареей. Свинцовые пластины в ЕФБ аккумуляторах в два раза толще, чем у обычных, вследствие чего увеличивается их ёмкость. Каждая платина закрыта в пакет из специальной ткани, который наполнен жидким сернокислотным электролитом.
- В гелевых аккумуляторах применяется гелеобразный электролит. Суть такой технологии в том, что она позволяет снизить текучесть электролита, который содержит агрессивную серную кислоту.

- В литиевых АКБ используется жидкий электролит, представляющий собой раствор фторсодержащих солей лития в смеси эфиров угольной кислоты.
- AGM имеет отличительную особенность в электролите, где с помощью специальной технологии между пластинами вставляются стекловолоконные микропористые прокладки.
- Во всех щелочных батареях применяется растворенная в воде щёлочь.
Классификация батарей по типу электролита
Электролиты бывают кислотными и щелочными.
Щелочные растворы применяются в заправке аккумуляторных батарей. Щелочные аккумуляторные жидкости этот такие жидкости, которые проявляют большую активность по отношению к металлам и кислотам. При реакциях с кислотами образуются соль и вода. Растворы щелочей подвергаются гидролизу. Химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электрической энергии в аккумуляторе.
Кислотные смеси с дистиллированной водой применяются в основном в автомобильных аккумуляторах. Составы этого типа легко можно приобрести в специализированных магазинах либо, при желании, приготовить самостоятельно на дому. На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке его приготовление так же возможно при соблюдении обязательных пропорций и правил техники безопасности. Для этого нужно смешать кислоту с дистиллированной водой.
Составы этого типа легко можно приобрести в специализированных магазинах либо, при желании, приготовить самостоятельно на дому. На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке его приготовление так же возможно при соблюдении обязательных пропорций и правил техники безопасности. Для этого нужно смешать кислоту с дистиллированной водой.
Как работает аккумулятор — АКБ
Как работает аккумулятор (АКБ)Принцип работы аккумулятора основан на электрохимической реакции окисления свинца в растворе серной кислоты и воды.
При разрядке батареи на положительной пластине происходит окисление металлического свинца, в то время, как на отрицательной пластине восстанавливается уже диоксид свинца.
При зарядке происходит обратный процесс, количество диоксида свинца на отрицательной пластине уменьшается, а на положительной пластине увеличивается количество металла.
Так же при разрядке АКБ уменьшается количество серной кислоты в электролите и увеличивается количество воды. А при зарядке происходит обратный процесс.
А при зарядке происходит обратный процесс.
Материалы АКБ
Пластины
На данный момент наиболее качественные батареи потерпели небольшие изменения. И связаны эти изменения с материалом пластин. Теперь пластины делают не из чистого свинца, а из его сплава с серебром. При этом удалось снизить массу батареи на треть, а срок её службы увеличить на 20 %.
Кроме этого, изменилась сама технология их изготовления. Если первые пластины производились путём их литья, то сегодня их делают из тонкого свинцового листа, путём штамповки. Такой метод дешевле и при этом пластины получаются прочнее и тоньше.
Сепараторы
Одной из причин выхода АКБ из строя является короткое замыкание положительных и отрицательных пластин.
Когда из пластин осыпается активная зона внизу банок происходит замыкание. Чтобы этого не случилось на помощь приходят сепараторы, которые делают в виде конвертов, запаянных снизу, под пластинами. Таким образом, когда активная зона осыпается она остаётся внутри конверта и не замыкает.
Литий-ионные аккумуляторы
Эти батареи получили широкое распостранение благодаря мобильным телефонам и иным гаджетам. Сегодня же, существуют разработки и для автомобилей. Однако, невзирая на все свои достоинства, в автотехнике данный вид АКБ не прижился из-за ряда принципиальных недостатков.
Литий-ионные аккумуляторы- Они резко теряют свою мощность из-за низкой температуры.
- Для зарядки таких батарей требуется строгое соответствие зарядному току, а это требует переделки электронной части генераторов.
- И самое главное, данные АКБ имеют стоимость в 15 раз дороже обычного кислотного аккумулятора.
Как было указано выше, электролит представляет собой раствор серной кислоты и воды. Под действием низких температур, известно, что вода замерзает, однако с электролитом этого не происходит.
Но тем не менее она заметно загустевает и теряет свои свойства, из-за чего ёмкость батареи заметно снижается. Что бы избежать этого, сегодня, в электролит добавляют разнообразные присадки.
Гелевые электролиты
Их по праву можно считать вершиной эволюции кислотных батарей. Такие АКБ называются попросту, гелевыми. В этих устройствах электролит модифицирован настолько, что представляет собой нечто наподобие желе.
Такая модификация, в комплексе с другими вышеописанными инновациями дала поистине волшебные результаты. В итоге батареи стали практически вечными, невосприимчивыми к переворачиванию, практически не теряющими свои свойства зимой и при этом на много легче по массе.
Графен-полимерные аккумуляторы
Это, пожалуй, самые перспективные батареи для использования, как в автомобилях, оснащённых ДВС, так и электрической силовой установкой. В производстве этих АКБ использованы нанотехнологии.
Графен-полимерные аккумуляторыПринцип работы этих поистине чудесных аккумуляторов заключается в следующем: их ёмкость, практически в три раза больше литий-ионных и при этом имеет меньшую стоимость, поскольку в их производстве не используется дорогостоящий литий. Кроме этого они не теряют своих свойств под действием низких температур.
Кроме этого они не теряют своих свойств под действием низких температур.
Основные технические характеристики аккумуляторов
Технические характеристики аккумуляторовНоминальная емкость аккумулятора
Номинальная емкость элемента – способность накапливать и отдавать электроэнергию постоянного тока, определяет время автономной работы ИБП. Емкость электрического аккумулятора показывает время питания подключенной к нему нагрузки.
Важно! Полностью емкость не характеризует энергию аккумулятора, то есть энергию, которая может быть накоплена в полностью заряженном аккумуляторе. Чем больше напряжение аккумулятора, тем больше накопленная в нем энергия.
Емкость всегда указывается на корпусе АКБ, а также на упаковке. Именно по этому критерию, большинство пользователей выбирают нужную модель.
Пусковой ток
Это величину, характеризующая параметр тока, который протекает в стартере автомобиля в момент пуска силового узла. Пусковой или стартерный ток возникает в тот момент, когда в замке зажигания поворачивается ключ и начинает проворачиваться стартер. Единица измерения величины – Ампер. Тот же ток холодной прокрутки является показателем поведения аккумулятора в морозную погоду и сможет запускать двигатель при минусовых показателях. Определяется мощностью тока, которую батарея может выдать в течение первых 30 секунд при температуре -18°С. При высоких показателях пускового тока увеличиваются шансы завести машину при минусовой температуре.
Пусковой или стартерный ток возникает в тот момент, когда в замке зажигания поворачивается ключ и начинает проворачиваться стартер. Единица измерения величины – Ампер. Тот же ток холодной прокрутки является показателем поведения аккумулятора в морозную погоду и сможет запускать двигатель при минусовых показателях. Определяется мощностью тока, которую батарея может выдать в течение первых 30 секунд при температуре -18°С. При высоких показателях пускового тока увеличиваются шансы завести машину при минусовой температуре.
Полярность
Порядок расположения на крышке аккумулятора присоединительных клемм, которые являются токовыводящими соединительными элементами, называется полярностью. Имеет два полюса – положительный и отрицательный и варианты расположения – прямое и обратное.
Прямая полярность – отечественная разработка. Дла ее определения нужно повернуть аккумулятор таким образом, чтобы этикетка была перед глазами. При расположении плюсовой клеммы слева, а минусовой справа, можно утверждать, что АКБ с прямой полярностью. На иномарках устанавливаются аккумуляторные батареи обратной полярности.
На иномарках устанавливаются аккумуляторные батареи обратной полярности.
Устройство корпуса
У большинства аккумуляторов корпус состоит из ударопрочного полипропилена. Он характеризуется как легкий материал, не вступающий в химическую реакцию с агрессивным электролитом АКБ. Полипропилен имеет весьма хорошую стойкость к перепадам температур, возникающих под капотом автомобиля, где нагрев может достигать до +60 ̊С, а при морозах до -30°С. Корпус большинства АКБ состоит из ручки для переноса, пробок, индикатора заряда, клемм для подключения к электросети. Вес АКБ емкостью 55Ач около 16,5 кг. Известными типами аккумуляторов, обладающих спросом являются: американский, европейский, азиатский и российский типы корпусов.
Европейский тип корпуса характерен тем, что АКБ клеммы находятся в углублении, их верхний край не выступает над плоскостью крышки. В некоторых случаях клеммы дополнительно защищаются от внешнего воздействия специальными крышечками. Азиатский тип корпуса – это коробка, на которой клеммы расположились на верхней крышке. Верхний край клемм является самой высокой точкой аккумулятора.
Азиатский тип корпуса – это коробка, на которой клеммы расположились на верхней крышке. Верхний край клемм является самой высокой точкой аккумулятора.
Российский стандарт АКБ
| Обозначение | Описание букв |
| А | АКБ имеет общую крышку для всего корпуса |
| З | Корпус батареи залит и она является полностью заряженной изначально |
| Э | Корпус-моноблок АКБ выполнен из эбонита |
| Т | Корпус-моноблок АБК выполнен из термопластика |
| М | В корпусе использованы сепараторы типа минпласта из ПВХ |
| П | В конструкции использованы полиэтиленовые сепараторы-конверты |
Тип крепления аккумулятора
Особое внимание при выборе АКБ следует уделять типу крепления АКБ, при котором батарея может крепиться снизу или сверху. С помощью специальной монтажной рамки, которая охватывает аккумулятор, элемент крепится вверху. Крепление аккумулятора происходит с помощью планки и двух шпилек. Чаще всего такой вид установки и фиксации аккумуляторной батареи встречается на автомобилях китайского или корейского производства.
С помощью специальной монтажной рамки, которая охватывает аккумулятор, элемент крепится вверху. Крепление аккумулятора происходит с помощью планки и двух шпилек. Чаще всего такой вид установки и фиксации аккумуляторной батареи встречается на автомобилях китайского или корейского производства.
Нижнее крепление применимо на европейских автомобилях. На нижней части корпуса АКБ находится выступ. За этот выступ аккумулятор прижимается к платформе с помощью пластины и винта.
Выступ для фиксации АКБЗаключение
Теперь вы знаете, как работает аккумулятор. Его роль в работе приборов трудно оспорить. Данный источник энергии применяться почти во всех отраслях. Что доказывает его значимость и необходимость знаний о принципе работы АКБ. А также ее внутреннем содержимом. Аккумуляторы широко используются в автомобилях, разнообразных электроприборах, кондиционерах, мультимедийных центрах. Там, где, генераторы не всегда справляются с обеспечением их энергией. И тогда в «игру» вступает АКБ, которая кроме подпитки энергией еще и выполняет основную функцию, обеспечивая электроэнергией стартер двигателя. Водителю необходимо знать, как устроен аккумулятор. Ведь в нужное время придется устранять сбои в работе источника энергии. К тому же, важно иметь представление о назначении и видах аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю.
Водителю необходимо знать, как устроен аккумулятор. Ведь в нужное время придется устранять сбои в работе источника энергии. К тому же, важно иметь представление о назначении и видах аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю.
автомобильные и литий-ионные, устройство и принцип работы — сообщение
Современное производство, да и всю нашу жизнь невозможно представить без аккумуляторов и батареек. Они необходимы для работы автомобилей, сотовых телефонов, ноутбуков и даже детских игрушек. А при аварийных отключениях электроснабжения они обеспечивают бесперебойную работу различного оборудования. Сегодня в докладе мы познакомим вас с устройством и работой аккумуляторных батарей и литий-ионных аккумуляторов.
Общие сведения об аккумуляторных батареях
Аккумуляторы — устройства, которые являются химическими источниками тока. Они способны накапливать электрическую энергию и отдавать ее по мере необходимости.
Т.е. заряженный аккумулятор является источником электроэнергии. Для зарядки его следует подключить к постороннему источнику питания. При этом происходит процесс превращения электрической энергии источника тока в химическую энергию аккумулятора.
При подключении его к внешней цепи происходит его разрядка, в процессе которой его химическая энергия превращается в электрическую.
Автомобильный аккумулятор
Система электроснабжения автомобиля обязательно включает аккумуляторную батарею. Она предназначена для запуска двигателя, питания некоторых устройств (сигнализации, дворников, кондиционера и т.д.) Его значение столь велико, что часто его называют «сердцем автомобиля».
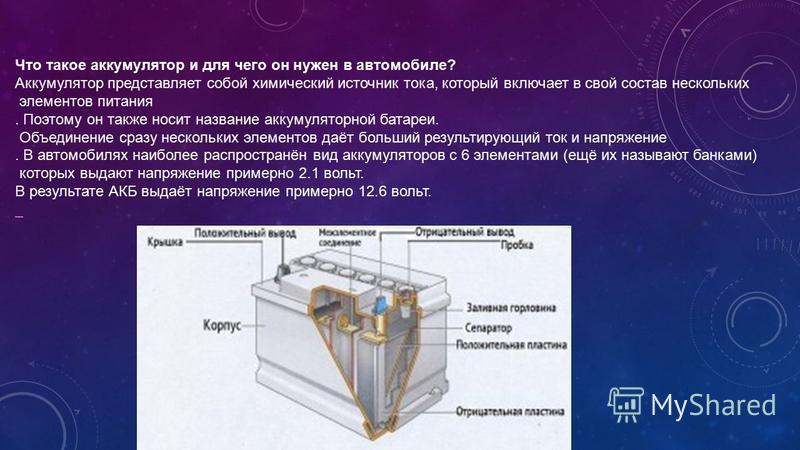
Как же устроен аккумулятор? Немного упростив детали, его конструкцию можно представить как систему решетчатых свинцовых пластин, находящихся в проводящей жидкости-электролите. Этот химический раствор состоит из 65% воды и 35% серной кислоты. Обычно в аккумуляторе 6 элементов, каждый из которых дает напряжение 2 V. Всего на клеммы аккумуляторной батареи поступает напряжение 12 V. При этом напряжении энергии аккумулятора достаточно для того, чтобы заработал стартер и завёлся двигатель.
Всего на клеммы аккумуляторной батареи поступает напряжение 12 V. При этом напряжении энергии аккумулятора достаточно для того, чтобы заработал стартер и завёлся двигатель.
В каждом элементе есть положительная и отрицательная пластина. Т. е. на одной — избыток электронов, а на другой их недостаток. Положительные пластины покрыты двуокисью свинца, а отрицательные губчатым свинцом. Когда аккумулятор подключают к потребителю, между покрытием пластин и электролитом начинаются химические реакции, порождающие электрический ток. Именно по электролиту происходит движение электронов от отрицательной пластины к положительной.
В результате этого процесса на пластинах выделяется сульфат свинца, а электролит при этом истощается. И аккумулятору нужно вновь зарядиться. Заряжающую функцию выполняет генератор переменного тока автомобиля. Когда автомобиль движется, работающий двигатель и приводит в действие генератор, подзаряжающий аккумулятор. Зарядка производится в процессе обратной химической реакции. Выходящие из генератора электроны, восстанавливают покрытие свинцовых пластин и плотность электролита. Аккумулятор вновь готов к работе. Если же аккумулятор не успевает полностью восстановить свой заряд от генератора, его подключат к специальному зарядному устройству.
Выходящие из генератора электроны, восстанавливают покрытие свинцовых пластин и плотность электролита. Аккумулятор вновь готов к работе. Если же аккумулятор не успевает полностью восстановить свой заряд от генератора, его подключат к специальному зарядному устройству.
Срок службы аккумулятора зависит от многих факторов: манеры езды водителя, насколько регулярно и правильно проводится его зарядка и обслуживание т.д.
Вообще стандартный ресурс работы аккумулятора 4 года. За этот период постепенно усиливается сульфатизация пластин, и они перестают принимать зарядный ток. Эта маленькая электростанция может и не подавать вида, что ей требуется замена. А просто в один прекрасный момент водитель не сможет завести двигатель.
Преимущества литий-ионных аккумуляторов
Самый популярный вид аккумулятора, применяемый в электронной бытовой технике (сотовых телефонах, ноутбуках и т. д.) — это литий-ионный аккумулятор. Его популярность легко объяснима. Это устройство выгодно отличается от своих собратьев:
- более быстрой зарядкой;
- большей мощностью;
- меньшим весом;
- более долгим сроком службы;
- низким саморазрядом.

В подтверждение этих достоинств приведём такие цифры — число рабочих циклов у них достигает 1000, что в 2 раза больше чем у других подобных устройств; а напряжение на отдельном элементе достигает 3,6 В, тогда как у других видов аккумуляторов не превышает и 2В.
Важным его достоинством является «эффект памяти», позволяющий ставить устройство на подзарядку в любой момент, независимо от имеющегося уровня зарядки. Это особенно важно, если предстоит его непрерывная и длительная эксплуатация.
Устройство и принцип работы
Литий-ионные аккумуляторы могут иметь либо цилиндрическую, либо плоскую форму. Его электроды разделены слоем сепаратора и электролита. Для изготовления катода используют литий, анод выполняется из пористого углерода. Пропиленовый сепаратор разделят разноименно заряженные электроды. Носителями заряда являются ионы электролита. В процессе разряда их поток направлен от анода к катоду. При зарядке — от катода к аноду. Контакты от катодов и анодов подсоединены к наружным клеммам. Причём к алюминиевому корпусу устройства подключен положительный электрод. Для безопасной эксплуатации предусмотрена защита, предохраняющая устройство от перезаряда.
Контакты от катодов и анодов подсоединены к наружным клеммам. Причём к алюминиевому корпусу устройства подключен положительный электрод. Для безопасной эксплуатации предусмотрена защита, предохраняющая устройство от перезаряда.
Срок их службы зависит от количества зарядов и разрядов. Если предполагается их длительное хранение без использования, лучше всего это сделать при половинном заряде аккумулятора
К недостаткам литий-ионных аккумуляторов можно отнести их относительно высокую стоимость.
Автор: Драчёва Светлана Семёновна
Если это сообщение тебе пригодилось, буда рада видеть тебя в группе ВКонтакте. А ещё — спасибо, если ты нажмёшь на одну из кнопочек «лайков»:
Curious Kids: как работают батарейки?
Как работают батареи? – Доминик, 7 лет, Индиана, США.
Батарея — это устройство, которое может вырабатывать электричество в результате реакции определенных химических веществ.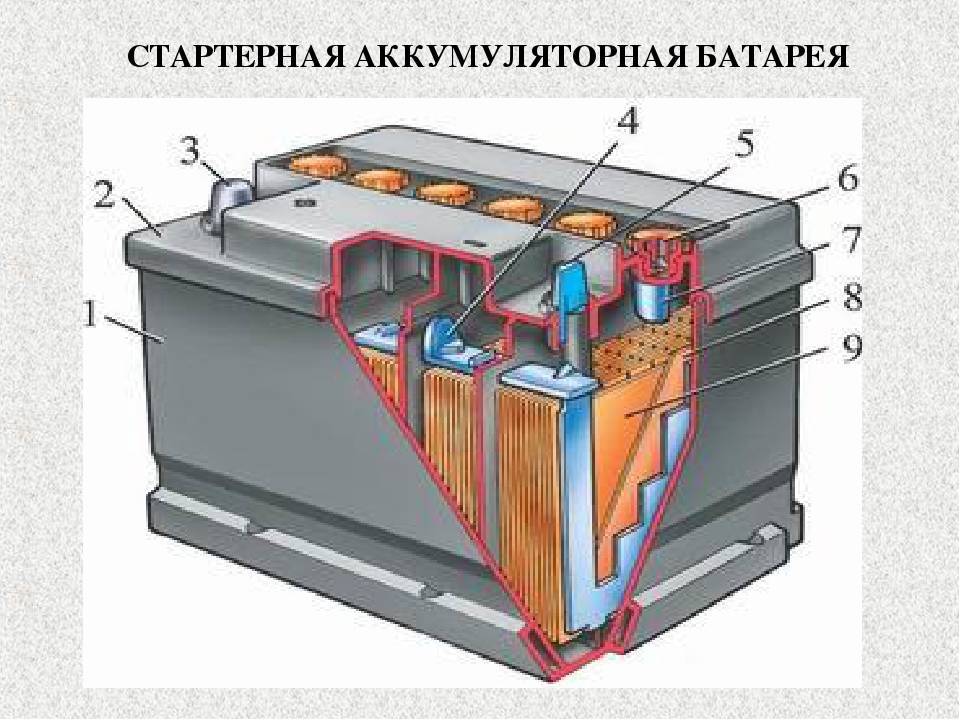 В батареях может использоваться множество различных химикатов — это зависит от того, как сделана батарея или для чего вы ее используете.
В батареях может использоваться множество различных химикатов — это зависит от того, как сделана батарея или для чего вы ее используете.
Аккумуляторы, используемые в смартфонах или электромобилях, называются «ионно-литиевыми батареями». Но увидеть их действительно редко, потому что обычно они не нуждаются в замене и надежно спрятаны внутри.
Скорее всего, вы увидите щелочные батарейки, которые используются в таких вещах, как часы, фонарики, пульты дистанционного управления и множество других предметов в доме. Строго говоря, их следует называть «щелочными элементами», так как батарея представляет собой набор элементов, соединенных вместе.
Любопытные дети — это серия игр от The Conversation, которая дает детям возможность получить ответы на свои вопросы о мире от экспертов. Если у вас есть вопрос, на который вы хотели бы получить ответ от эксперта, отправьте его на [email protected]. Мы не сможем ответить на все вопросы, но постараемся.
Производство электричества
Щелочная ячейка. Роджер Кларк., автор предоставил Внутри металлического корпуса щелочного элемента находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.Это может показаться сложным, но способ, которым клетка вырабатывает электричество, на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», для создания электрического тока.
Когда ячейка подключена к электрической цепи, например, к электрической лампочке, цинк внутри вступает в реакцию с диоксидом марганца и теряет электроны.
Электроны собираются металлическим стержнем внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательная клемма) по проводам к лампочке (заставляя ее загореться), а затем обратно в верхнюю часть ячейки. клетка (положительный полюс).
Эта реакция производит около 1,5 вольт электричества. Поскольку не многие устройства могут работать от 1,5 вольт, очень часто используются два или четыре элемента вместе, чтобы обеспечить большую мощность. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Поскольку не многие устройства могут работать от 1,5 вольт, очень часто используются два или четыре элемента вместе, чтобы обеспечить большую мощность. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Когда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическую реакцию, происходящую в щелочных элементах, нельзя легко обратить вспять, это означает, что элемент нельзя перезарядить.
Но помните, что большинство элементов и батарей могут быть переработаны, поэтому избавляйтесь от них осторожно.
Обращение реакции
Во всех типах элементов и батарей для производства электричества происходит одинаковая химическая реакция.
Но в некоторых типах элементов или батарей химические вещества отличаются, и реакция может быть обратной.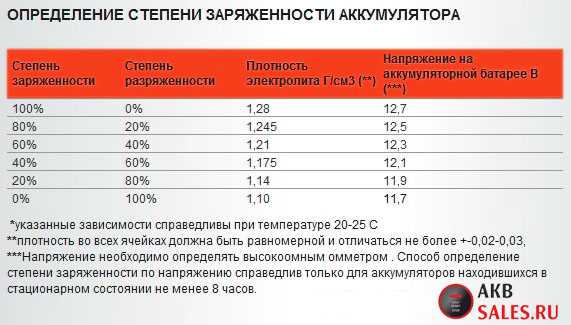
Раньше было намного дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а перезаряжаемые элементы дешевеют, мы, вероятно, будем использовать неперезаряжаемые элементы в будущем все реже и реже.
Дети могут получить ответы на свои вопросы от экспертов – просто отправьте их в Curious Kids вместе с именем ребенка, возрастом и городом. Вы можете:
- электронная почта любопытных детей@theconversation.com
- твитните нам @ConversationUK с #curiouskids
- Напишите нам в Instagram @theconversationdotcom
Вот еще несколько статей Curious Kids, написанных учеными-экспертами:
Когда рыбы испытывают жажду, они пьют морскую воду? – Торбен, 9 лет, Сассекс, Великобритания.

Почему у некоторых животных глаза разного цвета? – Джордж, 10 лет, Хедерсетт, Великобритания.
Как высоко я могу прыгнуть на Луне? – Майлз, 5 лет, Лондон, Великобритания.
Как работают батареи? | Ваше подробное руководство
Алессандро Вольта случайно создал первую батарею в 1800 году. Он пытался доказать коллеге-ученому, что нет необходимости использовать ткани животных для производства электрического тока. Вольта успешно выиграл свои дебаты, а затем и некоторые другие. Непредвиденное изобретение электрохимического элемента принесло Вольте много почестей. При этом он оставался очень скромным человеком.
После его смерти лицо Вольты появилось на марках, а также на банкноте в 10 000 итальянских лир, вышедшей из обращения в 2002 году. Имя Вольта живет, поскольку другие отмечают его работу, называя в его честь вольт — единицу, которую мы используем для измерения силы. электрических токов.
Но что открыл Вольта, что заставило батарею работать? В этой статье мы углубимся в ответы на часто задаваемые вопросы, в том числе: как работают батареи, из чего они сделаны, какие типы батарей существуют сегодня и какие проблемы у нас возникают с батареями?
Как работают батареи?Батарейки — это одна из тех вещей, которые большинство из нас считает само собой разумеющимися. Они просто обычная часть повседневной жизни, которые по большей части остаются незамеченными, пока накапливают энергию и выполняют свою магию. Подумайте о фонариках, сотовых телефонах, пультах дистанционного управления, слуховых аппаратах, автомобильных аккумуляторах и даже электромобилях.
Но вы когда-нибудь останавливались, чтобы действительно попробовать и понять, как на самом деле работают эти незаменимые продукты, которые обеспечивают нас портативной, мгновенной энергией? Батареи — это автономные блоки питания, которые накапливают химическую энергию и преобразуют ее в электрическую энергию. Этот процесс известен как электрохимия. Чтобы более подробно объяснить процесс работы батарей, давайте подробно рассмотрим, из чего сделаны батареи.
Этот процесс известен как электрохимия. Чтобы более подробно объяснить процесс работы батарей, давайте подробно рассмотрим, из чего сделаны батареи.
источник
Батарея обычно состоит из группы гальванических элементов. Есть два разных типа: гальванические (также называемые гальваническими) и электролитические.
- Гальванические или гальванические элементы: Они получают энергию в результате спонтанных окислительно-восстановительных реакций. В этих клетках химическая энергия превращается в электрическую энергию.
- Электролитические элементы: Они получают энергию от внешнего источника электронов, такого как источник переменного тока (AC) или источник постоянного тока (DC).
 В этих клетках электрическая энергия превращается в химическую энергию.
В этих клетках электрическая энергия превращается в химическую энергию.
Давайте рассмотрим пример двух типов ячеек. Когда что-то с перезаряжаемой батареей — например, ваш мобильный телефон или планшет — находится в зарядном устройстве, батарея работает как электролитическая ячейка. Однако, пока вы используете свое электронное устройство, батарея работает как гальванический элемент.
Для производства электроэнергии стандартному аккумуляторному элементу требуются следующие три элемента:
- Анод : это отрицательный электрод или отрицательная клемма батареи и место окисления. Это также положительный электрод в электролитической ячейке. Мы обычно используем такие металлы, как литий и цинк, в качестве анода в виде пасты, находящейся внутри детали, называемой сепаратором. Мы используем сепаратор для предотвращения коротких замыканий, разделяя отрицательный и положительный электроды.

- Катод : это положительный электрод или положительная клемма аккумулятора. Это также отрицательный электрод в электролитической ячейке. Катод состоит из серебристых матовых колец из оксидов металлов, таких как графит и диоксид марганца.
- Электролит : Это химическое вещество, разделяющее анод и катод. Это химический катализатор в виде липкой пасты или жидкости, который используется между электродами, чтобы сделать батарею проводящей. Это достигается за счет обеспечения механизма переноса ионов между анодом и катодом ячейки. Здесь химическая энергия батареи превращается в электрическую энергию. Гидроксид калия, натрий и хлорид являются основными электролитами.
Два разных металла (анод и катод) прикреплены к батарее на противоположных концах друг от друга.
Положительный заряд возникает в металле, который получает большее количество электронов. Затем на противоположной стороне образуется отрицательный заряд. Затем, когда провод или внешняя цепь соединяет два конца батареи друг с другом, поток электронов движется по проводу, уравновешивая электрический заряд и создавая электрический ток.
Последним шагом является введение того, что мы называем электрической нагрузкой. Это все, что требует электричества для работы. Возьмем в качестве примера фонарик. Когда вы вставляете батарейки в фонарик и включаете его, вы создаете электрическую цепь. Эта схема соединяет лампочку с проводом, позволяя электрической энергии течь через провод и лампочку, когда электроны проходят через отрицательный конец батареи, через провод, лампочку и обратно к положительному концу батареи.
источник
За прошедшие годы накопители энергии прошли долгий путь. Сегодня два основных места, где мы храним энергию, — это батареи и конденсаторы. И хотя они очень похожи, они не одинаковы. Давайте посмотрим на сходства и различия между ними.
В чем сходство между батареями и конденсаторами?Вот основные сходства между батареями и конденсаторами:
- Накопленная энергия создает электрический потенциал, известный как напряжение.
- Электрический потенциал генерирует поток электронов, называемый электрическим током.

- Электрический ток может создавать электрическую энергию для питания компонентов в цепи.
Инженеры будут выбирать, использовать ли батарею или конденсатор для своего продукта, исходя из конструкции схемы и ее функции. Иногда они идут с комбинацией двух. Однако это не означает, что они полностью взаимозаменяемы.
Почтовый индекс
В чем разница между батареями и конденсаторами?Вот основные различия между батареями и конденсаторами:
- При сравнении батареи и конденсатора одинакового объема батарея имеет в тысячи раз большую емкость для хранения энергии, чем конденсатор. Аккумуляторы
- надежны и обеспечивают бесперебойную подачу энергии.
- Конденсаторы часто могут обеспечить всплески энергии быстрее, чем батареи.
- Конденсаторы хранят электрическое поле энергии, что делает их перезаряжаемыми.
 Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться.
Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться. - Аккумуляторы имеют тенденцию терять способность удерживать заряд, чего не происходит с конденсаторами.
- Простые конденсаторы обычно изготавливаются из нетоксичных материалов, поэтому их безопасно выбрасывать.
Переменный ток (AC) представляет собой поток электронов, который регулярно, много раз в секунду меняет направление. Большинство наших бытовых приборов работают от сети переменного тока. Например, большинство наших микроволновых печей, кофейников, посудомоечных машин, телевизоров и даже наших систем отопления, вентиляции и кондиционирования работают на переменном токе. Однако, поскольку электроны батареи текут только в одном направлении, батареи генерируют постоянный ток (DC). Многие портативные устройства, такие как фонарики, сотовые телефоны и mp3-плееры, работают от постоянного тока, обеспечиваемого батареями.
источник
Не все батареи одинаковы. Различные типы батарей изготавливаются из других химических веществ и работают с различными химическими реакциями. Давайте рассмотрим семь наиболее распространенных типов батарей.
1. Щелочная батареяDuracell® и Energizer® — две популярные марки щелочных батарей. Это наши стандартные батареи AA, AAA, C, D и 9-вольтовые. Электроды в этих батареях — оксид марганца и цинк. Электролит представляет собой щелочную пасту из гидроксида калия или натрия.
2. Свинцово-кислотный аккумуляторСвинцово-кислотные аккумуляторы — это то, что мы используем для автомобильных аккумуляторов и фотогальванических солнечных энергосистем. Электроды в этих батареях — свинец и оксид свинца, а электролит — сильная кислота.
3. Литиевая батарея Фотокамеры с лампами-вспышками используют литиевые батареи, но в остальном большинство литиевых батарей, с которыми вы сталкиваетесь, имеют форму монеты или кнопки для таких вещей, как часы и другие небольшие устройства с низким энергопотреблением. Хотя они не дают большой мощности, вы можете сложить литиевые батареи, чтобы получить более высокое напряжение. Все литиевые батареи используют металлический литий в качестве анода и не подлежат перезарядке. По этой причине их также называют первичными литий-металлическими батареями. Катод может быть разным, но в наиболее распространенных литий-металлических батареях обычно используется диоксид марганца.
Хотя они не дают большой мощности, вы можете сложить литиевые батареи, чтобы получить более высокое напряжение. Все литиевые батареи используют металлический литий в качестве анода и не подлежат перезарядке. По этой причине их также называют первичными литий-металлическими батареями. Катод может быть разным, но в наиболее распространенных литий-металлических батареях обычно используется диоксид марганца.
Сотовые телефоны и другое портативное электронное оборудование обычно питаются от перезаряжаемого литий-ионного аккумулятора. Кроме того, литий-ионные батареи стали популярными для использования в электромобилях и крупных интеллектуальных сетях. В качестве анода в литий-ионных батареях используются литий-углеродные соединения. В качестве катода используются оксиды лития-металла.
5. Никель-кадмиевые или никель-кадмиевые аккумуляторы Мы находим никель-кадмиевые аккумуляторы в электроинструментах, а также во многих небольших бытовых приборах. Электроды в этих батареях — гидроксид никеля и кадмия, а электролит — гидроксид калия.
Электроды в этих батареях — гидроксид никеля и кадмия, а электролит — гидроксид калия.
Никель-металлогидридные батареи также являются перезаряжаемыми батареями и используются в устройствах с высоким коэффициентом разрядки, таких как цифровые камеры и игровые контроллеры. В этих батареях используются положительные электроды из оксигидроксида никеля, а в отрицательных электродах используется сплав, поглощающий водород.
7. Сухая угольно-цинковая батарея или стандартная угольная батареяЕсли вы покупаете продукт, в который включены батарейки, велика вероятность того, что в нем есть угольно-цинковые батареи из-за их низкой стоимости. Как правило, в электродах используется металлический цинк и углеродный стержень, окруженный диоксидом марганца. Электролит изготовлен из пасты хлорида аммония.
Какие проблемы с батареями?источник
Нет идеальных продуктов.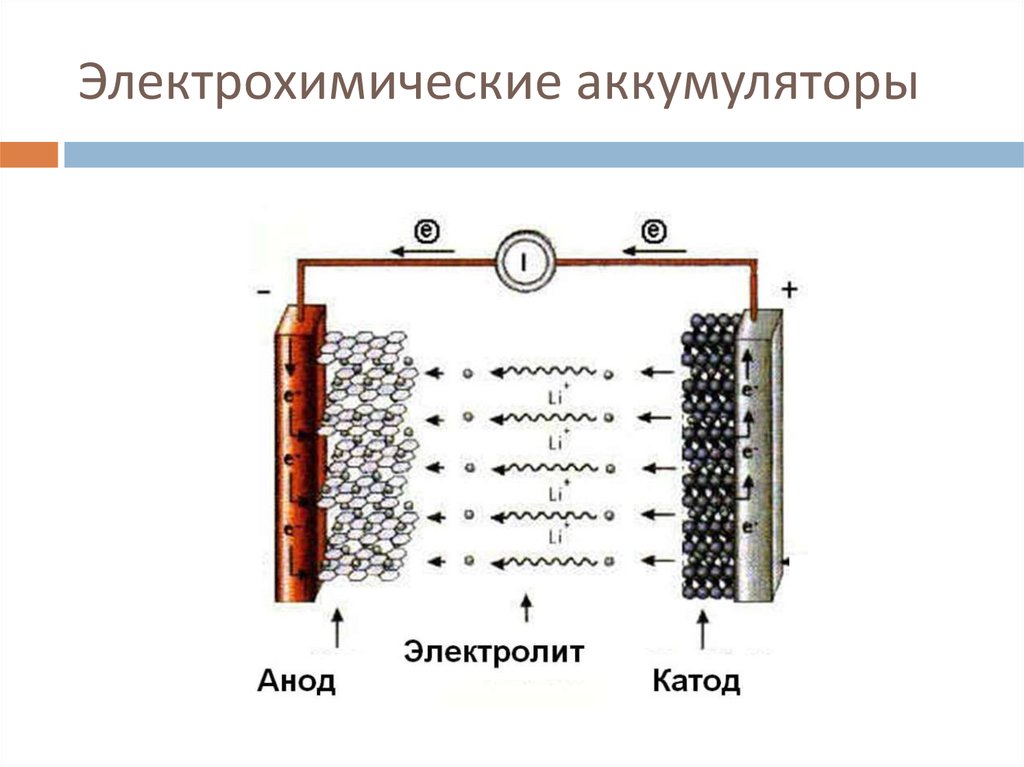 Всегда будет случайный бракованный кусок. Тем не менее, некоторые продукты имеют больше проблем, чем другие. Вот некоторые из основных проблем, с которыми обычно сталкиваются потребители при использовании батарей:
Всегда будет случайный бракованный кусок. Тем не менее, некоторые продукты имеют больше проблем, чем другие. Вот некоторые из основных проблем, с которыми обычно сталкиваются потребители при использовании батарей:
- Батареи могут загореться или даже взорваться : Хотя это случается нечасто, если батарея неисправна и ее электроды соприкасаются друг с другом, батарея может произойти короткое замыкание, что приведет к сильному нагреву, возгоранию или взрыву.
- Аккумуляторы нельзя мочить : После того, как вода попала в аккумулятор, удалить ее практически невозможно, так как предохранительный клапан предотвращает утечку жидкости из аккумуляторов. Вода в аккумуляторе может привести к его неисправности. Быстро и правильно утилизируйте намокшие батареи.

- Батареи могут замерзнуть : На улице должно быть чертовски холодно, но если вы живете в районе с суровыми и холодными зимами, будьте осторожны. Батарея может замерзнуть примерно на 10 градусов ниже Фаренгейта, если она заряжена только наполовину.
- Аккумуляторы вредны для окружающей среды : Аккумуляторы, которые не утилизируются должным образом, могут привести к накоплению и коррозии, в результате чего содержащиеся в них химические вещества загрязнят нашу землю и воду. Эти химические вещества аккумуляторов не только вредны для наших экосистем, но и попадают в нашу питьевую воду и воздух, которым мы дышим. Не говоря уже о том, что литиевые батареи потенциально могут вызывать пожары на свалках и способствовать глобальному потеплению.
 Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов:
Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов:
- https://earth911.com
- https://www.call2recycle.org
Теперь, когда мы ответили на важный вопрос «как работают батареи», пришло время немного поразвлечься с вашими новыми знаниями. Попробуйте прогуляться по дому и посмотреть, сколько различных типов батарей вы используете. Затем, чтобы получить больше полезной информации о часто используемых бытовых товарах, ознакомьтесь с нашей статьей о лампочках, чтобы узнать, как вы можете сэкономить большие деньги.

 В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.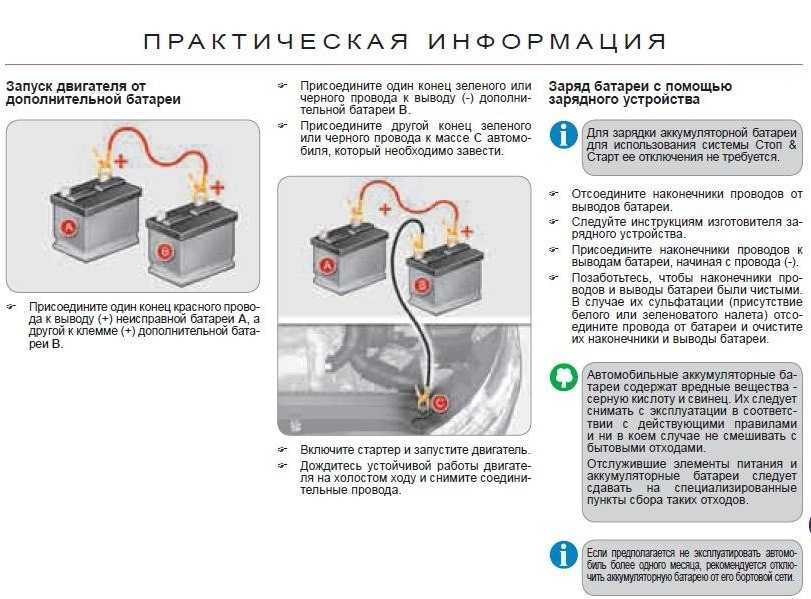


 В этих клетках электрическая энергия превращается в химическую энергию.
В этих клетках электрическая энергия превращается в химическую энергию. 
 Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться.
Напротив, батареи хранят свою энергию в химическом поле, которое часто не может перезаряжаться.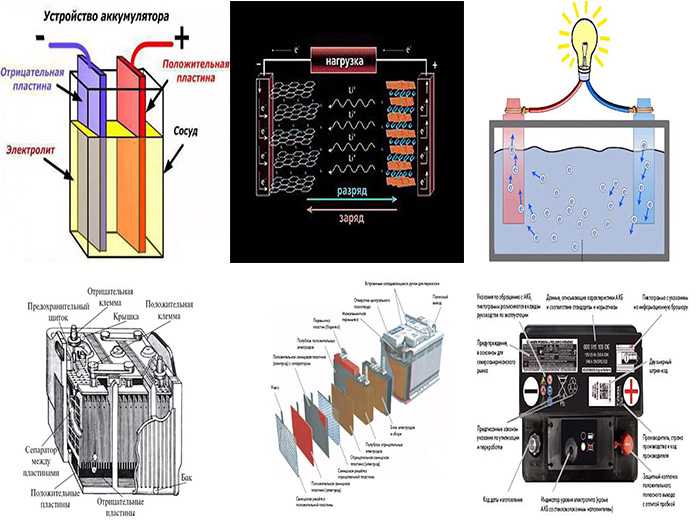
 Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов:
Хорошей новостью является то, что батареи подлежат вторичной переработке. И это очень просто. У Energizer® есть сайт, который поможет вам найти места рядом с вами для переработки батарей. Вы также можете попробовать один из этих веб-сайтов: