Как приготовить электролит для аккумулятора?
Автомобильные свинцово-кислотные стартерные аккумуляторные батареи заправляются электролитом, который является раствором серной кислоты h3SO4, плотностью 1,83 г/см3. От качества электролита, то есть от его плотности и чистоты используемых составляющих, напрямую зависит качество работы аккумулятора и срок его службы. При приготовлении электролита необходимо использовать только дистиллированную воду и чистую аккумуляторную серную кислоту. Даже самые незначительные примеси в электролите негативно скажутся на работе аккумулятора и сократят срок его службы.
Как известно, автомобильные аккумуляторы поступают в продажу сухозаряженными, то есть без электролита, или уже заправленными на заводе электролитом, и готовыми к эксплуатации. Главное преимущество сухозаряженных аккумуляторов в том, что их можно длительное время хранить, и после заправки такой аккумулятор не потеряет своих качеств. В свою очередь, заправленные электролитом аккумуляторы хранить можно меньше, но, такие батареи уже готовы к эксплуатации, что очень удобно.
Очень часто люди знают как подобрать и купить аккумулятор который уже готов к работе, но иногда, все же, автомобилистам приходится самостоятельно приготавливать электролит для заправки АКБ, или для его долива в банки аккумулятора. Для этой цели нужно в первую очередь подготовить соответствующую посуду. Вся посуда, используемая для приготовления электролита должна быть чистой и кислотоупорной, лучше всего для этой цели подходит стеклянная или пластиковая посуда. Вначале в емкость наливают дистиллированную воду, а затем, очень осторожно, тонкой струйкой в воду доливают серную кислоту, одновременно размешивая раствор стеклянной палочкой, или палочкой из иного кислотоупорного материала. Кислота должна равномерно перемешаться с водой по всему объему.
Кислоту нужно добавлять небольшими порциями, и периодически контролировать плотность раствора, замеряя её ареометром. Добавление кислоты прекращают, после того, как электролит достигнет необходимой плотности. В зависимости от сезона года и климатической зоны, в которой будет использоваться аккумулятор, плотность электролита может отличаться. В среднем она составляет от 1,21 до 1,31 г/см3. В районах с низкой температурой плотность электролита должна быть выше, а в местности, где температура выше, плотность электролита должна быть ниже. Например, в районах, где температура зимой не опускается ниже -30 градусов, плотность электролита должна быть 1,25 г/см3.
Добавление кислоты прекращают, после того, как электролит достигнет необходимой плотности. В зависимости от сезона года и климатической зоны, в которой будет использоваться аккумулятор, плотность электролита может отличаться. В среднем она составляет от 1,21 до 1,31 г/см3. В районах с низкой температурой плотность электролита должна быть выше, а в местности, где температура выше, плотность электролита должна быть ниже. Например, в районах, где температура зимой не опускается ниже -30 градусов, плотность электролита должна быть 1,25 г/см3.
Для получения электролита нужной плотности, удобно пользоваться таблицей, составленной из того расчета, что используемая аккумуляторная кислота имеет плотность 1,83 г/см3. Так, для приготовления электролита плотностью 1,23 г/см3 нужно добавить на литр дистиллированной воды 280 г кислоты, для приготовления электролита плотностью 1,25 г/см3 соответственно 310 г кислоты на литр воды, для электролита плотностью 1,27 г/см3 — 345 г кислоты на литр воды, и для электролита плотностью 1,29 г/см3 — 385 г кислоты на литр воды.
При работе с кислотой соблюдайте меры предосторожности, используйте рабочие перчатки хб с прорезиненной основой, и надевайте защитные очки. Не вливайте воду в кислоту, так как при этом возможно разбрызгивание раствора в результате бурной реакции. В случае попадания кислоты или электролита на кожу, осторожно, с помощью заранее приготовленной ваты, снимите кислоту или электролит с тела, промойте этот участок кожи 5% -м раствором обычной пищевой соды, после чего обратитесь за медицинской помощью.
- < Назад
- Вперёд >
Техника безопасности при работе с электролитом
Используемые для приготовления электролита серная кислота и едкие щёлочи являются химически активными веществами, разрушающе действующими на кожу человека и ткани животного и растительного происхождения.
При приготовлении электролита для заливки щелочных аккумуляторов из твердых едкого натра и едкого кали их предварительно надо измельчить. Брать куски едких щелочей надо обязательно только щипцами или железной ложкой. При измельчении куски щелочи необходимо закрывать тканью, чтобы осколки не разлетались в стороны. Руки должны предохраняться резиновыми перчатками, а глаза очками. Очки также должны защищать глаза при наблюдении за зарядом щелочных аккумуляторов во избежание попадания в них каплей электролита. Попадание щелочи в глаз приводит к тяжелым заболеваниям вплоть до полной потери зрения. При попадании на кожу щёлочь вызывает ее химический ожог, степень которого зависит от концентрации и температуры раствора щелочи. Электролит разрушает шерстяные ткани и кожаную обувь. На бумажные ткани щелочи действуют менее сильно. Объективный анализ воздуха в аккумуляторном помещении на концентрацию в нем щелочей производится гигрометрическим способом по анализ проб воздуха в лабораторных условиях.
Брать куски едких щелочей надо обязательно только щипцами или железной ложкой. При измельчении куски щелочи необходимо закрывать тканью, чтобы осколки не разлетались в стороны. Руки должны предохраняться резиновыми перчатками, а глаза очками. Очки также должны защищать глаза при наблюдении за зарядом щелочных аккумуляторов во избежание попадания в них каплей электролита. Попадание щелочи в глаз приводит к тяжелым заболеваниям вплоть до полной потери зрения. При попадании на кожу щёлочь вызывает ее химический ожог, степень которого зависит от концентрации и температуры раствора щелочи. Электролит разрушает шерстяные ткани и кожаную обувь. На бумажные ткани щелочи действуют менее сильно. Объективный анализ воздуха в аккумуляторном помещении на концентрацию в нем щелочей производится гигрометрическим способом по анализ проб воздуха в лабораторных условиях.
При попадании твердых щелочей или их растворов на кожу или в глаза необходимо немедленно промыть их большим количеством воды для уменьшения концентрации и нейтрализовать раствором слабой, например борной, кислоты.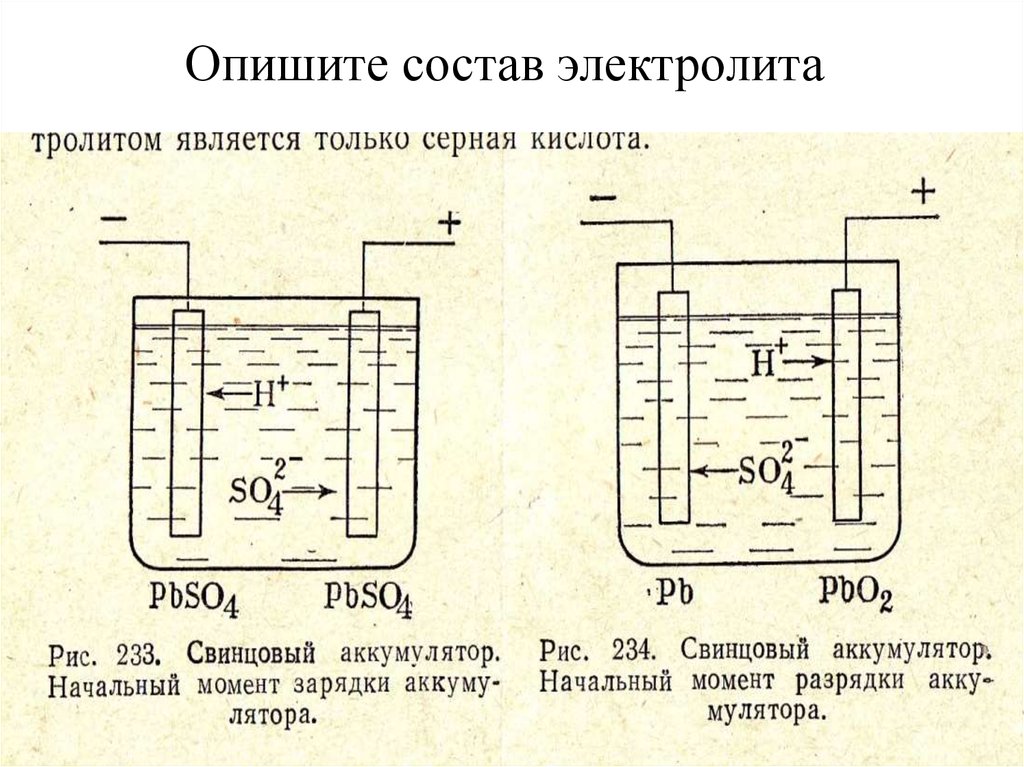 Нельзя промывать глаза водой из кранов с большим давлением, чтобы сильной струей воды не повредить глаза.
Нельзя промывать глаза водой из кранов с большим давлением, чтобы сильной струей воды не повредить глаза.
Серная кислота и ее растворы разрушающе действует на кожу и слизистые оболочки. Для предохранения кожных покровов и одежды от действия серной кислоты необходимо пользоваться резиновыми перчатками, сапогами и шерстяными или резиновыми фартуками. При работе с кислотой, электролитом и наблюдением за заряжающимися аккумуляторами глаза должны быть защищены очками.
Химические ожоги от воздействия серной кислоты на кожу трудно поддаются лечению. Степень поражения кожи зависит не только от концентрации раствора, но и от продолжительности воздействия. Поэтому при поражении серной кислотой ее необходимо как можно быстрее смыть большим количеством воды. Для обеспечении этого в местах, где приготовляется электролит, должны быть оборудованы краны с шлангами и специальными насадками в виде раструбов для распыления воды. Можно также нейтрализовать кислоту щелочными, например 10 %-ным содовым, раствором. После нейтрализации раствором соды пораженный участок кожи необходимо промыть водой.
После нейтрализации раствором соды пораженный участок кожи необходимо промыть водой.
При попадании сернокислого тумана в дыхательные пути он раздражает слизистые оболочки глотки и носа, вызывая кашель и затрудненное дыхание. У работающих длительное время в кислотных аккумуляторных отделениях болезненные реакции на кислотную атмосферу притупляются. Кроме того, чувствительность к присутствию в воздухе капелек серной кислоты у работающих различна. Потому предельно допустимая концентрация содержания серной кислоты в воздухе, должна контролироваться объективными способами. Технически она производится просасыванием проверяемого воздуха через фильтр из синтетической ткани, устойчивой к воздействию кислоты и щелочи. Затем ткань отмывается в дистиллированной воде. Количество осадка в результате реакции полученного раствора с хлоридом бария позволяет судить о концентрации сернокислого тумана в анализируемом воздухе.
При концентрации сернокислого тумана больше предельно допустимого может произойти отравление организма, сопровождающегося рвотой и кровавой мокротой при кашле, развивающимися воспалениями бронхов и легких. При появлении признаков отравления немедленно надо вывести пострадавшего из помещения на свежий воздух, дать кислород, обеспечить вдыхание паров содового раствора, спирта или эфира. В тяжелых случаях необходимо делать искусственное дыхание до прибытия врачебной помощи.
При появлении признаков отравления немедленно надо вывести пострадавшего из помещения на свежий воздух, дать кислород, обеспечить вдыхание паров содового раствора, спирта или эфира. В тяжелых случаях необходимо делать искусственное дыхание до прибытия врачебной помощи.
С целью снижения концентрации серной кислоты в воздухе при приготовлении электролита необходимо использовать предварительно разбавленную кислоту до плотности 1400 кг/м3, а не пользоваться концентрированной кислотой. При каждом разбавлении кислоты надо вливать ее в дистиллированную воду тонкой струей при непрерывном или периодическом перемешивании раствора стеклянной палочкой или веслом. Категорически запрещается лить воду в серную кислоту! Вода, имеющая меньшую плотность, чем кислота, остается на поверхности раствора. Так как разбавление кислоты сопровождается большим выделением тепла, то в месте соприкосновения струи воды с поверхностью кислоты происходит резкое повышение температуры, что приводит к разбрызгиванию электролита. В электролит аккумуляторов можно добавлять дистиллированную воду.
В электролит аккумуляторов можно добавлять дистиллированную воду.
Так как серная кислота хранится и перевозится в стеклянных бутылях с притертыми пробками, обращаться с ними следует с особой осторожностью. Нельзя поднимать бутыли за горловину. Перевозка бутылей к месту приготовления электролита должна осуществляться специальной тележкой. Перед транспортировкой обязательно требуется проверить прочность корзины или деревянной обрешетки, в которой должна стоять бутыль с кислотой. Выливать кислоту из бутылей необходимо только с помощью специальных приспособлений для плавного опрокидывания. Вручную переливание серной кислоты из бутылей запрещается!
В аккумуляторных отделениях все сосуды и емкости с электролитом, дистиллированной водой и растворами нейтрализующих веществ должны быть снабжены соответствующими надписями, указывающими на их содержимое. Нельзя совместно хранить кислоту и щелочи и их растворы. Бутыли с кислотой и порожние должны храниться в отдельном помещении при аккумуляторном отделении. Хранение их в подвалах недопустимо. При организации хранения кислоты или щелочи на открытых площадках последние должны быть оборудованы навесами от воздействия осадков и солнечных лучей.
Хранение их в подвалах недопустимо. При организации хранения кислоты или щелочи на открытых площадках последние должны быть оборудованы навесами от воздействия осадков и солнечных лучей.
Во всех случаях поражения щелочами или кислотой необходимо вызвать врача или обеспечить доставку пострадавшего в медицинский пункт!
Как приготовить раствор электролита для батареи
Информация
Сообщение от Джеймс Кор
Хотя у нас есть передовые технологии, которые потенциально могут удовлетворить почти все наши потребности в энергии, для их полного внедрения потребуется некоторое время. Вот почему свинцово-кислотные аккумуляторы до сих пор широко используются. Однако эта широкая зависимость принесла с собой несколько проблем.
Как сделать раствор электролита для батареи
Проблема цепочки поставок — одно из самых серьезных препятствий, с которыми мы сталкиваемся сегодня. После пандемии было много стресса, связанного с доставкой вещей туда, где они нужны, как раз вовремя.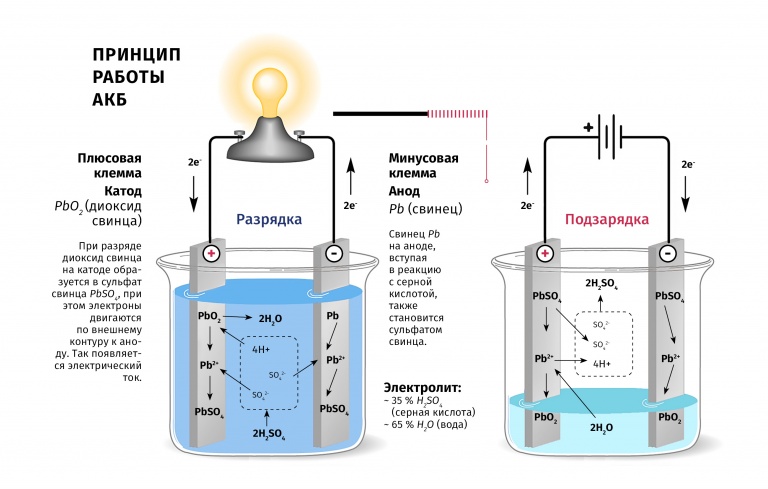 Проблема только усугубилась серьезными конфликтами и разразившимися финансовыми кризисами. Таким образом, у вас может возникнуть соблазн обновить или собрать автомобильные или инверторные батареи дома, как только местный электрик откажет вам.
Проблема только усугубилась серьезными конфликтами и разразившимися финансовыми кризисами. Таким образом, у вас может возникнуть соблазн обновить или собрать автомобильные или инверторные батареи дома, как только местный электрик откажет вам.
Из этого руководства вы узнаете, как приготовить раствор электролита для батареи в домашних условиях.
Содержание
Что такое электролит?
Что такое электролит? Электролит – это жидкость, пропускающая через себя ток и ионы. Вы можете думать об этом как о жидкостном транзисторе. Он имеет определенные ионы и заряды, которые реагируют с электродами или любыми другими компонентами, когда через него проходит ток. В некоторых случаях, например, в топливных элементах, электролит может даже изменять свое состояние.
Благодаря своим уникальным свойствам электролиты находят применение в различных областях. Вы можете видеть, как они используются в качестве консервантов для снижения скорости окисления в продуктах питания и в медицинских процедурах, чтобы обеспечить ваш организм необходимыми питательными веществами, не вступая в реакцию с непреднамеренными органами. Тем не менее, наиболее часто электролиты используются в батареях.
Зачем батареям нужен электролит?
Аккумулятор представляет собой сложное устройство, в котором используются различные неподвижные части для хранения и подачи электроэнергии в виде постоянного тока. Он имеет два электрода, один положительный и один отрицательный, которые создают разность потенциалов. Перенос заряда происходит с помощью проводов снаружи и электролита внутри.
Перенос заряда происходит с помощью проводов снаружи и электролита внутри.
Для свинцово-кислотных аккумуляторов, в которых интенсивно используется серная кислота, электролит поставляет необходимые ионы, которые реагируют со свинцом с образованием сульфата свинца. Водород соединяется с оксидом свинца, образуя воду, а ионы свинца оседают на отрицательном электроде. Этот процесс реверсируется во время процесса зарядки.
Можно ли сделать электролиты дома?
Могу ли я сделать электролиты домаДа, технически вы можете делать электролиты дома. На самом деле, у вас, вероятно, может быть что-то лежащее без дела, даже не подозревая об этом. Но следует знать, что процесс создания электролита довольно опасен. Таким образом, было бы полезно принять несколько мер безопасности, прежде чем вы начнете собирать или ремонтировать свинцово-кислотные аккумуляторы самостоятельно.
Как приготовить раствор электролита для батареи
Раствор электролита для батареи обычно представляет собой сильную кислоту, растворенную в чистой воде. Вода стабилизирует активность ионов водорода. Без воды любой аккумулятор может взорваться даже при небольшой величине тока. Вы можете использовать серную кислоту, если у вас есть свинцовые электроды. Никелевые электроды лучше всего подходят для азотной кислоты. Безопасный состав – 80 частей воды на каждые 20 частей чистой кислоты.
В дополнение к вышеуказанным химикатам вам потребуется следующее оборудование для надлежащего проведения процесса.
- Толстые изоляционные контейнеры (не менее 3)
- Кислотостойкие перчатки
- Очки
- Захват
- Мультиметр
- Ареометр
- Чертежные трубы (желательно прозрачные)
- Аптечка с пищевой содой для лечения кислотных ожогов
Приготовление раствора электролита
После того, как вы собрали все необходимое оборудование, пришло время приступить к приготовлению раствора электролита. Помните, что это может быть короткий процесс, но вы должны не торопиться, чтобы пройти каждый шаг как можно безопаснее.
Помните, что это может быть короткий процесс, но вы должны не торопиться, чтобы пройти каждый шаг как можно безопаснее.
- Налейте воду в изолированный контейнер. Обязательно измерьте объем и оставьте немного в другом контейнере, если вам нужно разбавить раствор. Рекомендуется использовать чистую воду, чтобы исключить вероятность нежелательных реакций в аккумуляторе.
- Используйте захват, чтобы взять контейнер с кислотой и осторожно вылить его в воду. Если вы заметили на поверхности чрезмерное количество пузырьков, сделайте паузу на несколько секунд, чтобы они рассеялись, и вылейте остальное.
- Раствор электролита теперь должен иметь высокую температуру. Закройте его крышкой, чтобы внутрь не попали загрязнения, но дайте горячему воздуху выйти.
Приготовление раствора электролита
- Когда раствор остынет, проверьте его крепость с помощью ареометра и добавьте жидкости по мере необходимости.
- Используйте волочильную трубу и поместите один конец на дно емкости с кислотой.
 Другой конец входит в гнездо для батареи.
Другой конец входит в гнездо для батареи. - Наклоняйте емкость под постепенно увеличивающимся углом, чтобы кислота могла стечь в аккумулятор. Не наполняйте его до краев. Если вы заметили, что заполнены примерно на три четверти, прекратите наливать и повторите процесс для других ячеек.
- Когда уровень кислоты в контейнере станет достаточно низким, вы можете снять трубку и залить ее прямо в аккумулятор.
Ну вот! Теперь у вас есть полностью восстановленная батарея. Тем не менее, вы должны проверить напряжение на клеммах с помощью мультиметра, чтобы определить, что батарея в порядке.
Меры безопасности
Примите некоторые меры предосторожности, чтобы снизить риск для себя и окружающих.
- Утилизируйте остатки кислоты после разбавления и нейтрализации сильным основанием. Пищевая сода, карбонат кальция и отбеливатель — вот несколько подходящих вариантов.
- Всегда надевайте защитную одежду, такую как перчатки и защитные очки.

- Обеспечьте изготовление электролита в изолированном и открытом пространстве.
- Имейте под рукой аптечку с пищевой содой, чтобы нейтрализовать ожоги кислотой.
- При наклоне контейнера используйте захват, чтобы держаться на некотором расстоянии от электролита. Кислота может вылиться без предупреждения для окружающих, особенно если вы торопитесь на стадии заливки.
- Аккуратно пользуйтесь ареометром. Погружайте в кислоту только достаточную часть, чтобы получить точные показания.
Резюме
Изготовление электролита в домашних условиях — это своего рода научный проект, который может сэкономить вам сотни долларов в ближайшие месяцы. Хотя достать кислоту может быть проще, это летучее химическое вещество, которое может причинить серьезный вред, поэтому лучше обращаться с ним осторожно. Мы надеемся, что это руководство помогло вам приготовить раствор электролита для аккумулятора.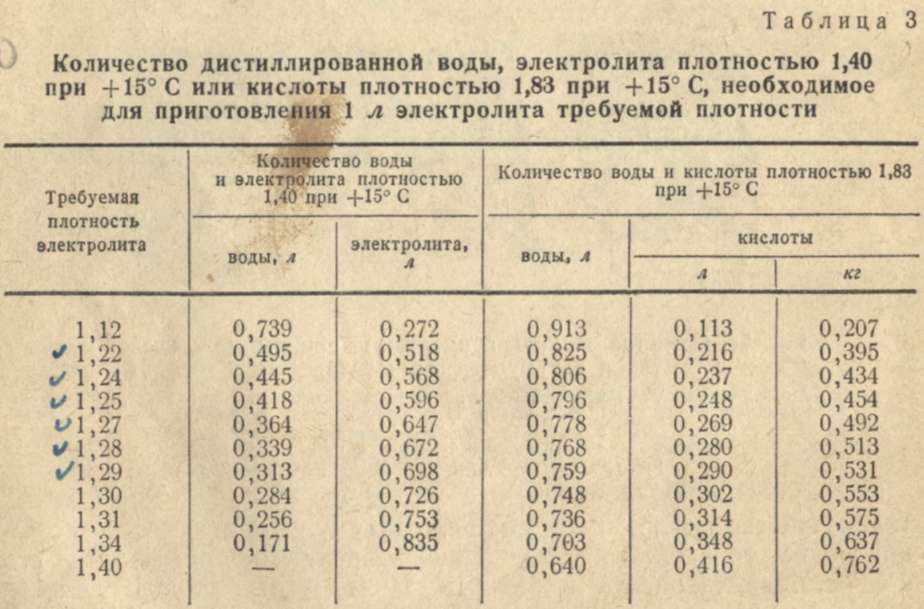
Как сделать раствор электролита для аккумуляторов: подготовка и раствор-battery-knowledge
Аккумуляторный электролит — это крепкая жидкость, специально предназначенная для аккумуляторов. Эти жидкости в основном содержатся в автомобильных аккумуляторах и даже в других типах аккумуляторов. Иногда его также называют аккумуляторной кислотой, потому что он очень кислотный и является самым мощным источником энергии в аккумуляторе.
Раствор электролита состоит из двух основных веществ. Этими веществами являются вода и серная кислота. Итак, это смесь воды и серной кислоты.
Уровень электролита в каждой батарее слишком низкий. После этого люди пробуют разные вещи, чтобы восстановить электролитный баланс батареи. Самая распространенная альтернатива, о которой мы слышим, — это смесь соленой воды и пищевой соды. Однако вы никогда не должны использовать эти альтернативы в своей батарее.
Иногда люди добавляют в него простую воду, когда в их батареях заканчивается электролит. Когда уровень электролита низкий, это означает, что уровень жидкости упал выше свинцовых пластин.
Сравнение свинцовых пластин, погруженных в раствор электролита в свинцово-кислотных батареях, проходит процесс с электролитом для накопления энергии. Если электролит пролили и вовремя не позаботились об этом, начинается процесс, называемый сульфатацией.
Сульфатация может сократить срок службы батареи. Если ваша батарея подвергается сульфатации, вам необходимо десульфатировать ее перед использованием. Поэтому всякий раз, когда возникает необходимость в растворе электролита для аккумулятора, позаботьтесь об этом вовремя.
3.2V 20A Низкотемпературная ячейка батареи LiFePO4 -40℃ 3C разрядная емкость≥70% Температура зарядки: -20~45℃ Температура разрядки: -40~+55℃ пройти тест на иглоукалывание Максимальная скорость разряда -40℃:3C
ПОДРОБНЕЕ
Как приготовить раствор электролита?
Теперь давайте посмотрим, как сделать раствор электролита для аккумуляторов. Как мы уже говорили ранее, раствор электролита состоит из серной кислоты и воды. Таким образом, иногда, когда батарея заряжается, часть воды испаряется из-за тепла. Это приводит к снижению уровня электролита в аккумуляторе.
Как мы уже говорили ранее, раствор электролита состоит из серной кислоты и воды. Таким образом, иногда, когда батарея заряжается, часть воды испаряется из-за тепла. Это приводит к снижению уровня электролита в аккумуляторе.
Вот что вы можете сделать в таких ситуациях.
●Возьмите стакан, наполовину наполненный водой. Теперь нет необходимости использовать специальную воду; дистиллированная вода не помешала бы.
●Выбрать кислоту непросто. CuCO# или CuCl2 являются хорошими электролитами для использования. Оба они являются предпочтительными решениями проблемы. Поэтому всегда выбирайте сильную кислоту.
●Теперь для серной кислоты вы также можете выбрать ее, если в батарее все еще есть электролит.
●Смешайте раствор и добавьте его в батарею.
Низкотемпературная высокая плотность энергии Прочная полимерная батарея для ноутбука Спецификация батареи: 11,1 В 7800 мАч -40℃ 0.2C пропускная способность ≥80% Пыленепроницаемость, устойчивость к падению, антикоррозийная защита, защита от электромагнитных помех
ПОДРОБНЕЕ
Примечание:
Никогда больше не заполняйте аккумулятор обычной водой. Это может привести к повреждению аккумулятора. Дистиллированная вода является наиболее рекомендуемой. Вы можете получить дистиллированную воду в любом хозяйственном магазине. Это очень распространено.
Это может привести к повреждению аккумулятора. Дистиллированная вода является наиболее рекомендуемой. Вы можете получить дистиллированную воду в любом хозяйственном магазине. Это очень распространено.
Является ли аккумуляторная жидкость сильной кислотой?
Любая кислота в аккумуляторе сильная. Кислота относится к химическому веществу, используемому в ячейке или батарее. Хотя в большинстве случаев кислота, используемая в свинцово-кислотном аккумуляторе, является наиболее распространенной. Мы даже используем эти батареи в наших автомобилях.
В результате большинство кислот, используемых в свинцово-кислотных батареях, представляют собой серную кислоту, смешанную с водой. Более 40–50% кислоты в аккумуляторе составляет серная кислота.
Электрохимическая реакция происходит в батарее из-за сильной кислоты в ней. Прочность этих аккумуляторов в основном составляет около 50%. Серная кислота очень агрессивна. Вы можете получить представление о том, насколько сильна эта кислота. Несколько капель серной кислоты на коже могут полностью повредить клетки. Даже вы можете полностью ослепнуть.
Несколько капель серной кислоты на коже могут полностью повредить клетки. Даже вы можете полностью ослепнуть.
Также существует вероятность воспламенения аккумулятора при высокой температуре. Но когда дело доходит до энергии, эти кислоты отвечают за правильную работу батареи, чтобы дать энергию любому гаджету, который мы используем.
Общая безопасность важна, но без этих сильных кислот батарея была бы бесполезна.
Как сделать аккумуляторную кислоту из солей Эпсома?
Если вы обнаружите, что ваша батарея не работает должным образом, вы можете кое-что сделать, чтобы восстановить ее энергию. Иногда батарейки не вечны, но их восстановление — отличная идея. Вы можете восстановить его с помощью соли Эпсома и аккумуляторной кислоты.
Приготовление правильной кислоты с использованием солей Эпсома повышает заряд батареи. Теперь помните, что не кладите соль Эпсома прямо в батарею, потому что это вещество невозможно растворить напрямую.
Вот как можно приготовить подходящую аккумуляторную кислоту с английской солью.
●Возьмите две чашки и наполните их английской солью.
● Обе чашки должны содержать по 250 граммов английской соли.
●Теперь возьмите 16 унций чистой воды и вскипятите ее до 150 градусов.
●Когда вода закипит, проверьте, точно ли она нагрелась до 250 градусов.
●После этого добавьте две чашки английской соли и перемешайте.
●Теперь продолжайте перемешивать, пока температура полностью не станет нормальной.
●Когда это будет сделано, аккумуляторная кислота с английской солью будет готова.
●Вот как можно сделать аккумуляторную кислоту из английской воды.
Заключительные точки зрения
Сохранение разряженных батарей и восстановление их работоспособности — прекрасный способ использовать свой интеллект. Теперь есть много способов сделать это. Большинство из них упомянуто выше. В батареях единственное, что делает батарею менее мощной, — это аккумуляторная кислота или электролит.
