Что такое аккумуляторная батарея — устройство, состав и принцип работы АКБ
Содержание
- Определение АКБ и его функция в автомобиле
- Устройство аккумуляторной батареи и принцип ее работы
- По каким технологиям изготавливают
- Технология GEL
- Технология AGM
- Технология EFB
Основным источником электроэнергии в автомобиле является генератор – от него питаются все потребители при работающем двигателе. Но мотор сначала надо запустить. Для этого в машине установлена аккумуляторная батарея.
Определение АКБ и его функция в автомобиле
Аккумуляторная батарея (АКБ) – электрохимический возобновляемый источник электрической энергии. Он может снабжать потребителей до исчерпания заряда, после чего может быть перезаряжен. Количество циклов заряд-разряд ограничено, оно определяет жизненный ресурс батареи.
В автомобиле основное назначение АКБ — запуск двигателя. От аккумулятора запитывается стартерный двигатель, который приводит во вращение вал мотора, а также бензонасос (если он с электроприводом) и другие необходимые для старта узлы. После окончания последовательности пусковых операций на номинальный режим выйдет генератор, и вся нагрузка бортсети (включая возобновление потраченной на пуск энергии АКБ) перейдет на него.
После окончания последовательности пусковых операций на номинальный режим выйдет генератор, и вся нагрузка бортсети (включая возобновление потраченной на пуск энергии АКБ) перейдет на него.
Также аккумулятор может запитать потребителей, если двигатель не запущен. В штатном режиме это может быть аварийное светосигнальное оборудование, охранная сигнализация, в темное время суток – габаритные фонари и т.п. В нештатной ситуации могут быть обеспечены питанием и другие потребители — автозвук, световое оборудование при ремонте и диагностике и т.п. Надо лишь помнить, что время пользования до следующего заряда ограничено.
Устройство аккумуляторной батареи и принцип ее работы
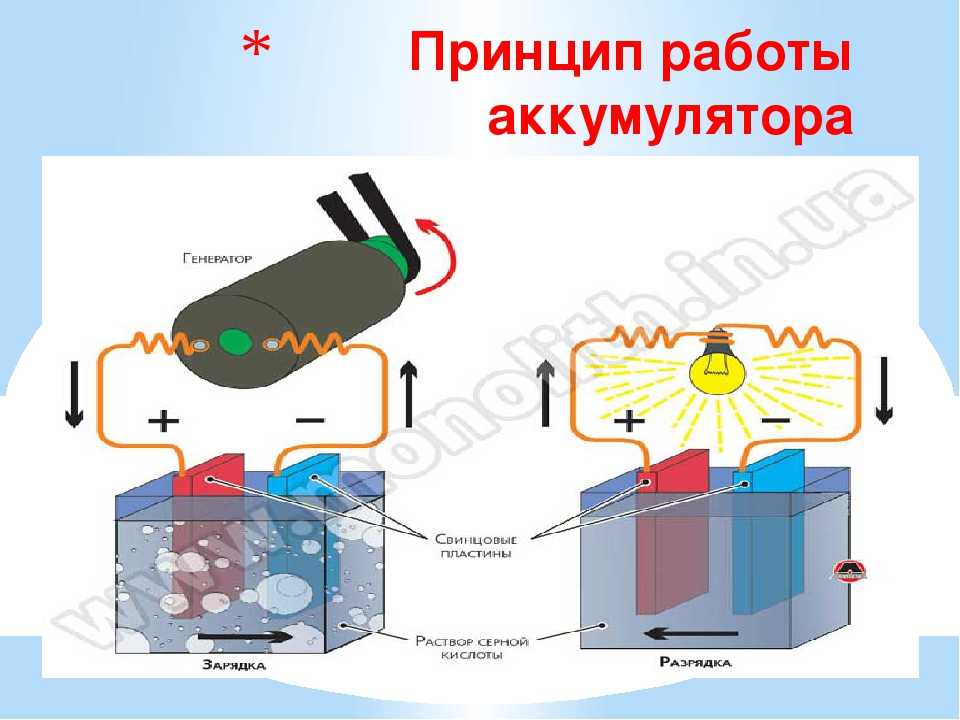
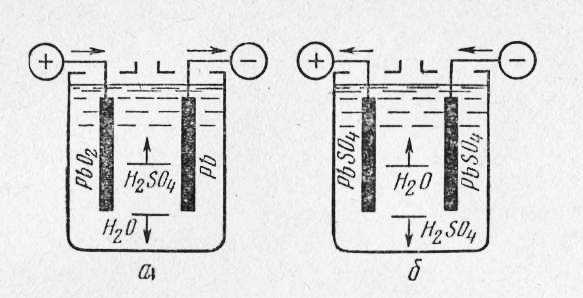
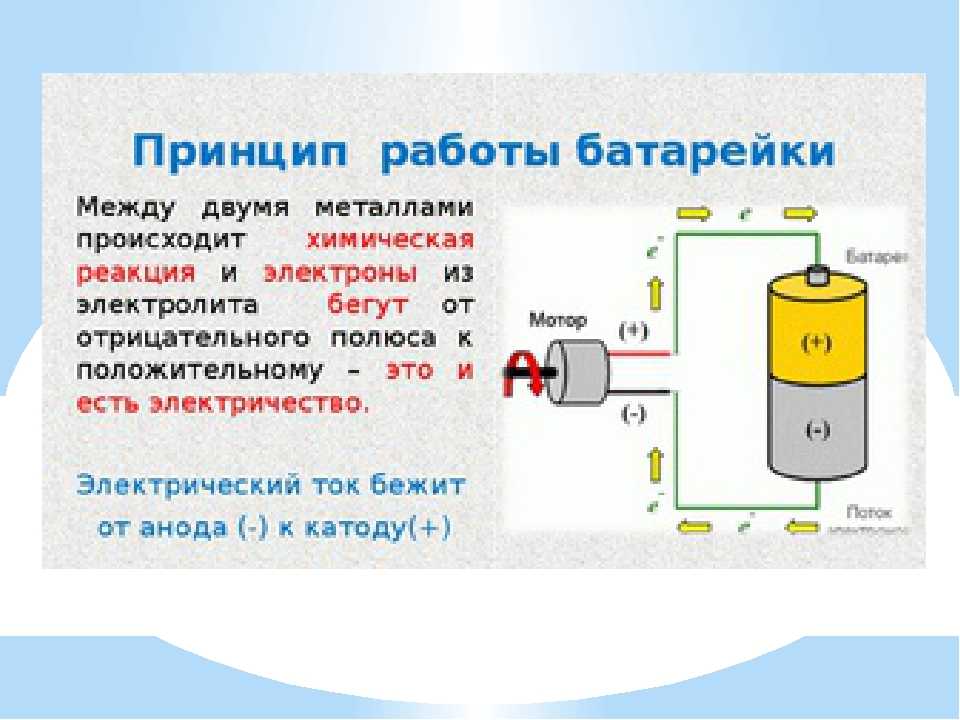
Самый простой аккумулятор состоит из двух электродов – положительного из оксида свинца, отрицательного из свинца. Оба электрода помещены в раствор серной кислоты. При подключении потребителя начинают протекать химические реакции.
Устройство простого свинцово-кислотного аккумулятора.Всего их при заряде-разряде несколько десятков, но для понимания работы АКБ наиболее важны следующие:
- при разряде на аноде (плюсовом электроде) диоксид свинца при взаимодействии с серной кислотой восстанавливается до сульфата свинца с образованием воды;
- при этом на катоде (минусовом электроде) свинец окисляется с образованием сульфата свинца (PbSO4).
В итоге происходит два важных для эксплуатации явления:
- Содержание серной кислоты в электролите падает (уменьшается плотность электролита).
- На пластинах выпадает плохо растворимый в кислоте осадок сульфата свинца.
При заряде реакции идут в обратном направлении:
- на катоде в результате реакции из сульфата свинца образуется свинец и кислотный остаток серной кислоты, катод заряжается отрицательным потенциалом;
- на аноде сульфат свинца с водой образуют серную кислоту и чистый свинец, заряжая электрод положительно.
Итогом реакций становится:
- Растворение сульфата свинца.
- Увеличение содержания серной кислоты и повышение плотности электролита.
- Появление электродвижущей силы (ЭДС), достигающей 2,1 вольта.
Если процессы протекают строго симметрично, то выпадающий осадок PbSO4 полностью растворяется. На практике такого не бывает, полное равновесие соблюсти сложно. Поэтому пластины постепенно покрываются слоем сульфата, маскирующим полезную площадь. В итоге емкость АКБ снижается. Этот процесс называется сульфатацией.
В итоге емкость АКБ снижается. Этот процесс называется сульфатацией.
В практических конструкциях изначально свинцовые решетчатые пластины заполняют намазкой из смеси оксида свинца и свинцового сурика (с химической точки зрения — соединение свинца и кислорода). При первом заряде происходит формовка пластин. Во время реакции с серной кислотой на одном аноде образуется оксид свинца в губчатом виде, на другом – металлический свинец (также в пористой форме). Емкость аккумулятора зависит от площади пластин, поэтому практическое устройство элемента аккумуляторной батареи выглядит как пакет из анодных и катодных пластин, набранных поочередно и соедиенных параллельно.
Устройство элемента аккумуляторной батареи.По каким технологиям изготавливают
Стремление улучшить работу свинцово-кислотных аккумуляторов привело к созданию новых технологий производства элементов. В первую очередь, это замена легирующей добавки. Вместо сурьмы сейчас широко применяется кальций. Его добавка придает свинцовым пластинам повышенную прочность, в результате появилась возможность сделать их более тонкими без потери жесткости конструкции. В электрохимических реакциях кальций не участвует. Кальциевые батареи имеют и другое достоинство – пониженная склонность к газообразованию при зарядке. Такой аккумулятор не склонен к «кипению». Это кардинально снижает расход воды во время эксплуатации. Также за последние годы популярность завоевали батареи в необслуживаемом исполнении.
В первую очередь, это замена легирующей добавки. Вместо сурьмы сейчас широко применяется кальций. Его добавка придает свинцовым пластинам повышенную прочность, в результате появилась возможность сделать их более тонкими без потери жесткости конструкции. В электрохимических реакциях кальций не участвует. Кальциевые батареи имеют и другое достоинство – пониженная склонность к газообразованию при зарядке. Такой аккумулятор не склонен к «кипению». Это кардинально снижает расход воды во время эксплуатации. Также за последние годы популярность завоевали батареи в необслуживаемом исполнении.
Тематическое видео: Революционная твердотельная батарея от Toyota
Технология GEL
В этих аккумуляторах электролит загущен до состояния геля специальными добавками. Главное достоинство батареи – необслуживаемое исполнение и практическая невозможность пролива электролита. Даже при небольших повреждениях корпуса гель не вытечет. Также созданы условия для рекомбинации газов в толще электролита. Водород и кислород, даже если они образуются при зарядке, не улетучиваются, а реагируют в толще геля с образованием воды. Малая часть газов, не поучаствовавшая в рекомбинации, улетучивается в пространство над электролитом. Когда давление достигает определенного предела, оно сбрасывается в атмосферу через специальный клапан. Другим плюсом является возможность эксплуатации почти в любом положении. Электрохимические реакции в таком элементе не отличаются от реакций в обычном аккумуляторе, принцип работы гелевой батареи абсолютно такой же, поэтому ЭДС одного элемента составляет те же 2,1 вольта.
Главное достоинство батареи – необслуживаемое исполнение и практическая невозможность пролива электролита. Даже при небольших повреждениях корпуса гель не вытечет. Также созданы условия для рекомбинации газов в толще электролита. Водород и кислород, даже если они образуются при зарядке, не улетучиваются, а реагируют в толще геля с образованием воды. Малая часть газов, не поучаствовавшая в рекомбинации, улетучивается в пространство над электролитом. Когда давление достигает определенного предела, оно сбрасывается в атмосферу через специальный клапан. Другим плюсом является возможность эксплуатации почти в любом положении. Электрохимические реакции в таком элементе не отличаются от реакций в обычном аккумуляторе, принцип работы гелевой батареи абсолютно такой же, поэтому ЭДС одного элемента составляет те же 2,1 вольта.
Читайте также
Типы автомобильных аккумуляторов и их обозначение
Главный минус АКБ с загущенным электролитом – пониженная динамика электрохимических реакций.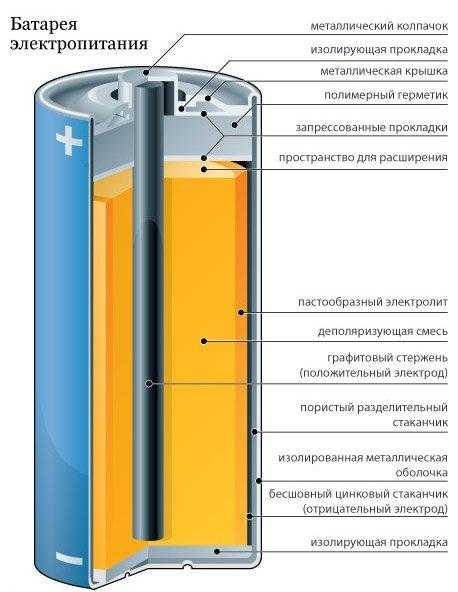 Результатом этого становится пониженная токоотдача, которая не позволяет применять гелевые АКБ в качестве автомобильных стартерных. Зато такие батареи используют в качестве тяговых аккумуляторов, буферных элементов и в качестве источников питания, не требующих сервиса, на удаленных объектах (устройства телемеханики, ретрансляторы связи и т.п).
Результатом этого становится пониженная токоотдача, которая не позволяет применять гелевые АКБ в качестве автомобильных стартерных. Зато такие батареи используют в качестве тяговых аккумуляторов, буферных элементов и в качестве источников питания, не требующих сервиса, на удаленных объектах (устройства телемеханики, ретрансляторы связи и т.п).
Более подробно в статье: Гелевый аккумулятор для автомобиля — плюсы и минусы
Технология AGM
Эта технология позволяет в полной мере использовать преимущества пластин, легированных кальцием. Тонкие пластины собирают в компактный пакет, а чтобы избежать короткого замыкания, между ними прокладывают сепаратор-разделитель, как показано на рисунке в разрезе.
Устройство батареи АГМ.Он изготовлен из волокнистого материала (обычно, стекловолокна). Пространство между волокнами заполнено электролитом, который удерживается внутри сепаратора капиллярными силами, поэтому свободной жидкости в такой батарее тоже нет. Часть межволоконного пространства оставлена незаполненным – небольшое количество газов, которое все же образуется во время эксплуатации, рекомбинирует в этих пустотах.
Часть межволоконного пространства оставлена незаполненным – небольшое количество газов, которое все же образуется во время эксплуатации, рекомбинирует в этих пустотах.
Технология EFB
Строение аккумуляторов, изготовленных по данной технологии, является промежуточным между традиционными батареями и AGM. Пластины (обычно, каждая положительная) такой АКБ помещены в сетчатый сепаратор, который позволяет расположить электроды более компактно без риска короткого замыкания. Внутри корпуса находится электролит в свободном виде, но часть его абсорбируется сеткой разделителя, которая позволяет держать пластины постоянно смоченными раствором серной кислоты.
Кроме того, сепаратор снижает вымывание обмазки пластин и удерживает ее от осыпания, что положительно сказывается на сроке службы АКБ, увеличивая количество возможных циклов. Такие батареи обладают многими достоинствами аккумуляторов AGM, но их производство значительно дешевле.
Устройство аккумулятора EFB.Несмотря на развитие литий-ионных технологий, кислотно-свинцовые батареи еще долго будут занимать свои ниши в сфере автономных источников питания. Предпосылками к этому служат их дешевизна, конструкция, отработанная десятилетиями, относительно долгий срок службы при эксплуатации в соответствующих условиях.
Предпосылками к этому служат их дешевизна, конструкция, отработанная десятилетиями, относительно долгий срок службы при эксплуатации в соответствующих условиях.
принцип работы, из чего состоит, назначение и схема акб
Автор Aluarius На чтение 10 мин. Просмотров 18.1k. Опубликовано
Содержание
- 1 Что такое аккумулятор
- 2 Устройство и принцип работы аккумулятора
- 2.1 Схема строения
- 3 Виды аккумуляторов
- 3.1 Классификация акб по составу активного вещества
- 3.2 Классификация батарей по типу электролита
- 4 Основные технические характеристики аккумуляторов
- 4.1 Номинальная емкость аккумулятора
- 4.2 Пусковой ток
- 4.3 Полярность
- 4.4 Исполнение корпуса
- 4.5 Тип и размер клемм
- 4.6 Тип крепления
- 5 Назначение аккумуляторных батарей
- 5.
 1 В каких сферах используется
1 В каких сферах используется
- 5.
Принципиально устройство аккумулятора больше чем за 150 лет с момента его изобретения не изменилось, хотя современность внесла серьёзные новшества в технологические процессы их изготовления и используемые материалы, из чего состоит аккумулятор.
Что такое аккумулятор
Аккумулятор – автономный источник электричества, который накапливает, сохраняет и отдает энергию. Аккумуляторная батарея – важный элемент электрооборудования транспортного средства. Назначение акб определяется в запуске двигателя и обеспечении подачи электричества в бортовую сеть. Все электроприборы, когда выключен мотор, и не работает генератор, работают от батареи. Накопитель помогает в пробке, когда энергии генератора не хватает.
Устройство и принцип работы аккумулятора
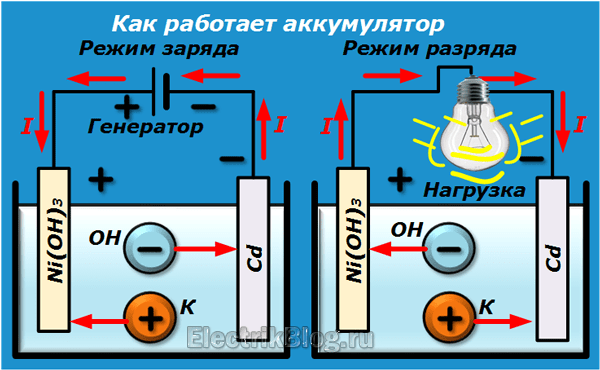
Для того, чтобы разобраться, как работает аккумулятор, необходимо знать устройство акб, что внутри аккумулятора обеспечивает работу прибора. Основной принцип работы аккумулятора заключается в разности потенциалов при погружении двух пластин в электролит. В 12-ти вольтовой батарее объединены шесть аккумуляторов, каждый из которых вырабатывает 2 вольта. Все они объединены совместным корпусом, который образует единое целое конструкции.
Основной принцип работы аккумулятора заключается в разности потенциалов при погружении двух пластин в электролит. В 12-ти вольтовой батарее объединены шесть аккумуляторов, каждый из которых вырабатывает 2 вольта. Все они объединены совместным корпусом, который образует единое целое конструкции.
При работе этой конструкции, пластинки из-за действия серной кислоты выделяют сульфат свинца, в результате чего образуется электрический ток. Также выделяется вода, и поэтому концентрация электролита становится менее плотной. Во время зарядки АКБ процесс осуществляется в обратном порядке, свинец снова обретает металлическую форму, электролит становится более концентрированным. Принцип работы аккумулятора основан на методе двойной сульфатации, который позволяет полностью восстанавливать первоначальные свойства батареи. Срок службы аккумулятора зависит от качества используемых материалов, из чего состоит акб.
Схема строения
Схема строения
Виды аккумуляторов
Классификация акб по составу активного вещества
Свинцовые пластины, используемые в старых аккумуляторах перестали устраивать потребителей. Возникала необходимость по улучшению качества работы акб. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, потому что в них уже намного реже требовался долив воды.
Возникала необходимость по улучшению качества работы акб. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, потому что в них уже намного реже требовался долив воды.
При использовании металлического кальция для покрытия пластин появились кальциевые энергосберегающие источники. В предыдущих моделях потери воды из-за электролиза на 12 вольт требовали постоянного долива, а кальций позволил повысить этот порог до 16 вольт. Так появилась возможность в производстве необслуживаемых аккумуляторов использовать герметичный, неразборной корпус.
- Сурьмянистые батареи относятся к классике из-за повышенного состава сурьмы, которая ускоряет процесс электролиза.
- В малосурьмянистых акб материалом для пластин служит свинец с небольшой примесью сурьмы. В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
- При производстве кальциевых источников свинцовые пластины легированы до 0,1% кальцием. Они могут иметь различные заряды, как отрицательный, так и положительный.
- Гибридные источники энергии вытесняют кальциевые. Конструктивные отличия состоят в том, что при их производстве объединили две технологии: одна, когда пластины формируются из сплава свинца и сурьмы, положительные электроды, а другая – когда пластины формируются из сплава свинца и кальция, отрицательные электроды.
- EFB является улучшенной жидкозаполненной батареей. Свинцовые пластины в ЕФБ аккумуляторах в два раза толще, чем у обычных, вследствие чего увеличивается их ёмкость. Каждая из пластин закрыта в пакет из специальной ткани, который наполнен жидким сернокислотным электролитом.
- В гелевых аккумуляторах применяется гелеобразный электролит. Такая технология позволила снизить текучесть электролита, в котором содержится агрессивная серная кислота.
- В литиевых акб используется жидкий электролит, представляющий собой раствор фторсодержащих солей лития в смеси эфиров угольной кислоты.
- Отличительной особенностью AGM является то, что в электролит с помощью специальной технологии между пластинами вставляются стекловолоконные микропористые прокладки.
- Во всех щелочных батареях применяется растворенная в воде щёлочь.
Классификация батарей по типу электролита
Электролиты бывают кислотными, щелочными. Щелочные растворы используются в заправке аккумуляторных батарей. Щелочные аккумуляторные жидкости представляют собой сильные основания, которые проявляют большую активность по отношению к металлам и кислотам. При реакциях с кислотами образуются соль и вода. Растворы щелочей подвергаются гидролизу. Химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электрической энергии в аккумуляторе.
Кислотные смеси с дистиллированной водой применяются в основном в автомобильных аккумуляторах. Такие составы можно приобрести в специализированных магазинах или же приготовить самостоятельно в домашних условиях. На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке также возможно довольно точно при соблюдении обязательных пропорций и правил техники безопасности смешать кислоту с дистиллированной водой.
На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке также возможно довольно точно при соблюдении обязательных пропорций и правил техники безопасности смешать кислоту с дистиллированной водой.
Важно! вода при минусовых температурах превращается в лед. Всегда при морозе нужно применять меры, необходимые для предотвращения замерзания аккумулятора.
Основные технические характеристики аккумуляторов
Номинальная емкость аккумулятора
Номинальная емкость элемента – способность накапливать и отдавать электроэнергию постоянного тока, определяет время автономной работы ИБП. Емкость электрического аккумулятора показывает время питания подключенной к нему нагрузки.
Важно! Емкость не характеризует полностью энергию аккумулятора, т.е. энергию, которая может быть накоплена в полностью заряженном аккумуляторе. Чем больше напряжение аккумулятора, тем больше накопленная в нем энергия.
Емкость всегда указывается на корпусе АКБ, а также на упаковке, ведь именно по этому критерию большинство пользователей выбирают нужную модель.
Пусковой ток
Величину, характеризующую параметр тока, протекающего в стартере автомобиля в момент пуска силового узла, принято считать пусковым током. Пусковой ток или стартерный возникает в момент, когда в замке зажигания поворачивается ключ и начинает проворачиваться стартер. Единица измерения величины – Ампер. Он же ток холодной прокрутки является показателем, как аккумулятор поведет себя в морозную погоду и сможет запустить двигатель при минусовых показателях. Определяется мощностью тока, которую батарея может выдать в течение первых 30 секунд при температуре -18°С. При высоких показателях пускового тока увеличиваются шансы завести машину при минусовой температуре.
Полярность
Порядок расположения на крышке аккумулятора присоединительных клемм, которые являются токовыводящими соединительными элементами, называется полярностью. Полюса всего два – положительный и отрицательный, вариантов расположения – прямое и обратное.
Полюса всего два – положительный и отрицательный, вариантов расположения – прямое и обратное.
Прямая полярность – отечественная разработка. Чтобы ее определить, нужно повернуть аккумулятор таким образом, чтобы этикетка была перед глазами. При расположении плюсовой клеммы слева, а минусовой справа, можно утверждать, что акб с прямой полярностью. На иномарках устанавливаются аккумуляторные батареи обратной полярности.
Прямая, обратная полярностьИсполнение корпуса
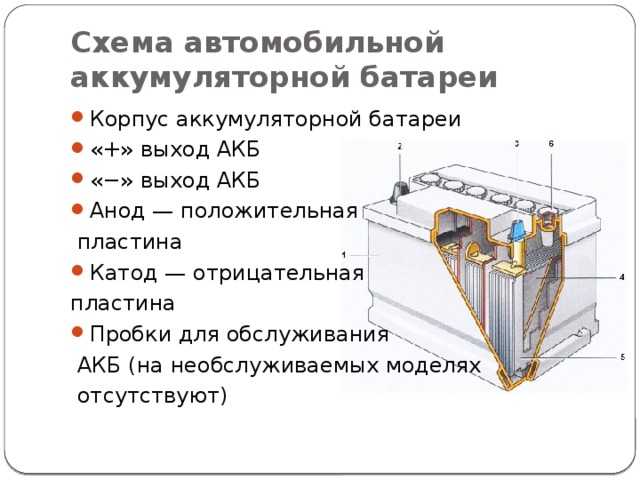
Корпус большинства аккумуляторов состоит из ударопрочного полипропилена, который характеризуется как материал легкий, не вступающий в химическую реакцию с агрессивным электролитом АКБ. Полипропилен довольно стоек к перепадам температур, возникающих под капотом автомобиля, нагрев может достигать до +60 ̊С, а при морозах до -30°С. Корпус большинства АКБ состоит из ручки для переноса, пробок, индикатора заряда, клемм для подключения к электросети. Вес АКБ емкостью 55Ач около 16,5 кг. Традиционно появились американский, европейский, азиатский и российский типы корпусов.
Европейские корпусы и американские имеют идентичные габариты. Например, у батарей емкостью 60 Ач общая высота от 17,5 до 19 сантиметров. У азиатских этот показатель немного выше, до 22 сантиметров за счет верхнего расположения электродов. Именно поэтому важно корректно анализировать возможности посадочного места под капотом, чтобы надежно закрепить АКБ прижимной планкой и избежать замыкания при случайном касании токоотводами металлических частей кузова.
У АКБ с европейским типом корпуса клеммы находятся в углублении, их верхний край не выступает над плоскостью крышки. Иногда клеммы дополнительно защищены от внешнего воздействия специальными крышечками. Азиатский тип корпуса – это коробка, на которой клеммы расположились на верхней крышке, верхний край клемм является самой высокой точкой аккумулятора. Какую клемму снимать с аккумулятора первой читайте здесь.
Важно! При приобретении акб нужно знать, что европейские производители указывают габаритные размеры аккумулятора по корпусу.
На азиатских корпусах могут указывать высоту батареи с учетом клемм или без них.
Российский стандарт акб
| Обозначение | Описание букв |
| А | АКБ имеет общую крышку для всего корпуса |
| З | Корпус батареи залит и она является полностью заряженной изначально |
| Э | Корпус-моноблок АКБ выполнен из эбонита |
| Т | Корпус-моноблок АБК выполнен из термопластика |
| М | В корпусе использованы сепараторы типа минпласта из ПВХ |
| П | В конструкции использованы полиэтиленовые сепараторы-конверты |
Европейские корпусы и американские имеют идентичные габариты
Тип и размер клемм
Распространены аккумуляторы с клеммами трех разных стандартов: тип Euro – Type 1, и Asia –Type 3, «под болт» – американский стандарт. В типе Euro плюсовая клемма имеет диаметр 19,5 мм, минусовая клемма – 17,9 мм.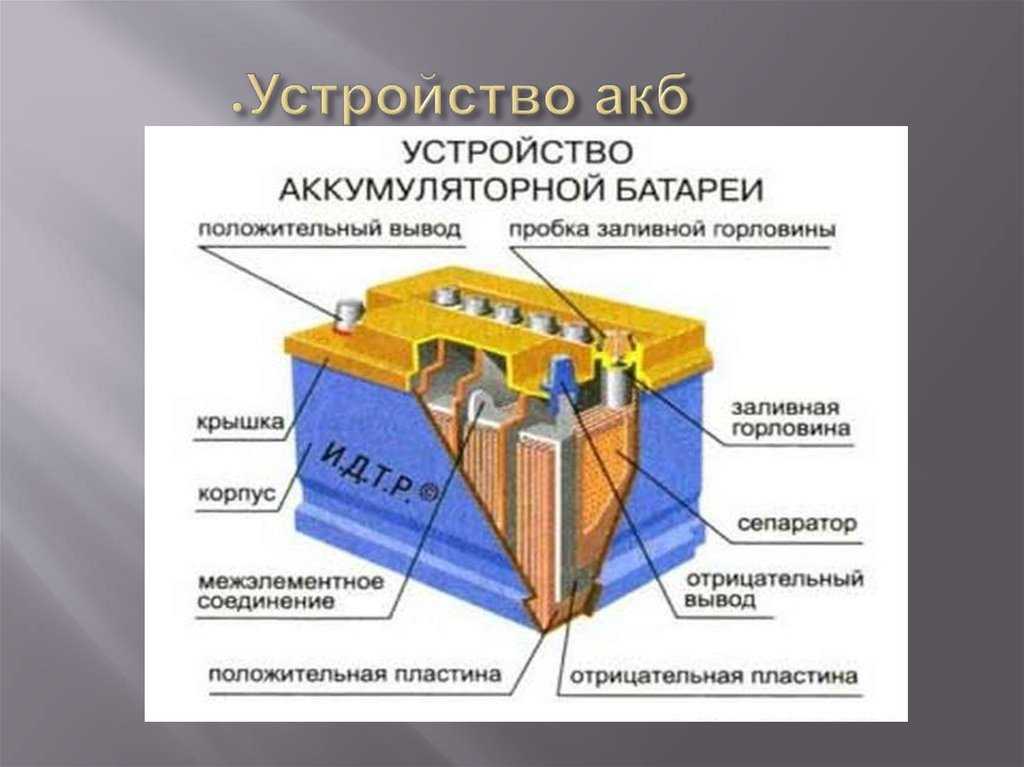 В типе Asia клемма плюс имеет диаметр 12,7 мм, клемма минусовая – 11,1 мм. Клеммы «под болт» находятся на боковой стенке аккумулятора и сверху. Болт, соединённый с проводом, продевается в отверстие клеммы и фиксируется гайкой.
В типе Asia клемма плюс имеет диаметр 12,7 мм, клемма минусовая – 11,1 мм. Клеммы «под болт» находятся на боковой стенке аккумулятора и сверху. Болт, соединённый с проводом, продевается в отверстие клеммы и фиксируется гайкой.
Тип крепления
При выборе акб особое внимание следует обращать на тип крепления АКБ, при котором батарея может крепиться снизу или сверху. Вверху крепится элемент с помощью специальной монтажной рамки, которая охватывает аккумулятор. Крепление аккумулятора происходит с помощью планки и двух шпилек. Чаще такой вид установки и фиксации аккумуляторной батареи встречается на автомобилях китайского или корейского производства.
Тип крепления встречается на «азиатах»
Нижнее крепление применимо на европейских автомобилях. На нижней части корпуса акб находится выступ, за который аккумулятор прижимается к платформе с помощью пластины и винта.
Нижнее креплениеНазначение аккумуляторных батарей
Автомобильная аккумуляторная батарея выступает как источником электрического тока, необходимого для пуска двигателя, так и резервным источником питания, в случае, если энергии, вырабатываемой генератором, оказывается мало для электроснабжения авто. Аккумуляторная батарея действует как стабилизатор напряжения, так как она выполняет роль накопителя электроэнергии, отдающего во время пуска двигателя за короткое время большой ток, и пополняемого постепенно генератором автомобиля в процессе подзарядки.
Аккумуляторная батарея действует как стабилизатор напряжения, так как она выполняет роль накопителя электроэнергии, отдающего во время пуска двигателя за короткое время большой ток, и пополняемого постепенно генератором автомобиля в процессе подзарядки.
Важно! Перед проверкой системы электроснабжения и электрического пуска, необходимо убедиться в том, что аккумуляторная батарея находится в заряженном состоянии и готова к эксплуатации.
В каких сферах используется
Аккумуляторные батареи используются как дополнительный или основной источник питания. Надежность, простота в использовании позволяет применять батареи в различных областях:
- автомобильная промышленность;
- освещение в аварийном состоянии;
- переносное электрооборудование;
- медицинское оборудование;
- игрушки;
- сигнализация в разных сферах применения;
- телекоммуникационное оборудование.
Применение батареи в игрушках
Роль акб в работе приборов не оспорима.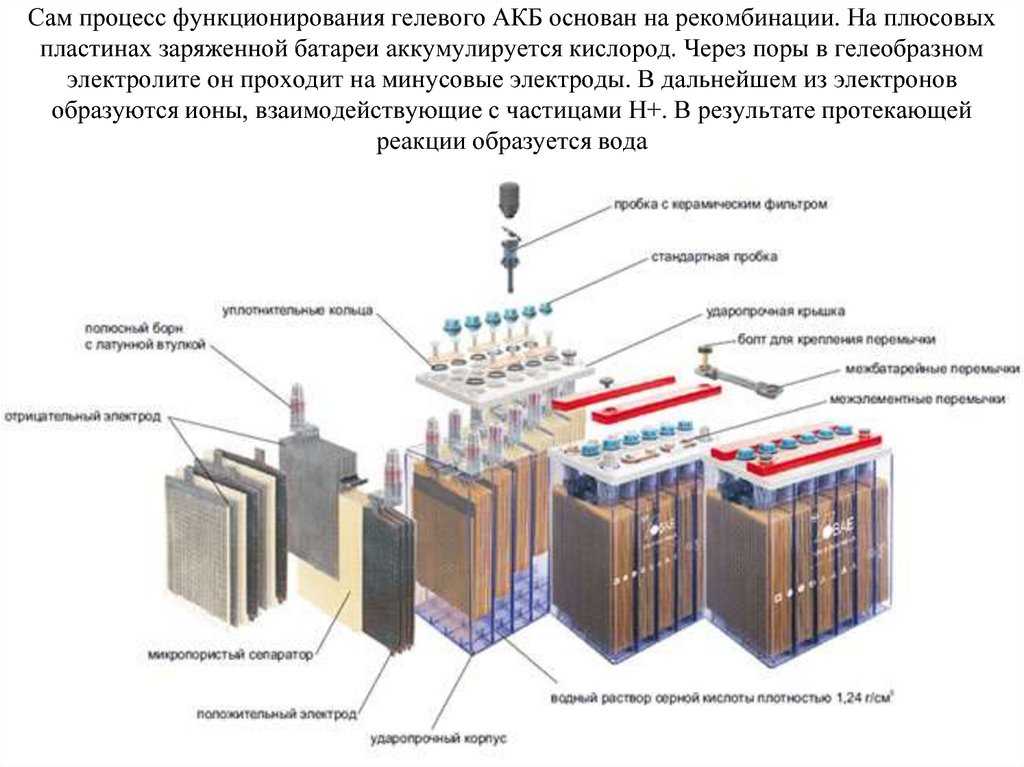 Применение источника энергии практически во всех отраслях доказывает значимость и необходимость знаний о внутреннем содержимом батарей. С использованием в автомобилях широкого разнообразия электроприборов, кондиционеров, мультимедийных центров, генераторы не всегда справляются с обеспечением их энергией. В этом случае подпитка энергией поступает от АКБ, который кроме этого выполняет основную функцию, обеспечивает электроэнергией стартер двигателя. Водителю необходимо знать, как устроен аккумулятор, чтобы выявить сбои в работе источника энергии, назначение аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю. О способах и рекомендациях как проверить аккумулятор читай тут.
Применение источника энергии практически во всех отраслях доказывает значимость и необходимость знаний о внутреннем содержимом батарей. С использованием в автомобилях широкого разнообразия электроприборов, кондиционеров, мультимедийных центров, генераторы не всегда справляются с обеспечением их энергией. В этом случае подпитка энергией поступает от АКБ, который кроме этого выполняет основную функцию, обеспечивает электроэнергией стартер двигателя. Водителю необходимо знать, как устроен аккумулятор, чтобы выявить сбои в работе источника энергии, назначение аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю. О способах и рекомендациях как проверить аккумулятор читай тут.
Как работают батареи? | Live Science
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Батарея работает, замыкая цепь внутри электрического устройства. (Изображение предоставлено: Mrs_ya | Shutterstock)
(Изображение предоставлено: Mrs_ya | Shutterstock)Батарейки повсюду. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на широкое распространение в повседневной жизни людей, батареи часто остаются незамеченными. Подумайте об этом: вы действительно знаете, как работает батарея? Не могли бы вы объяснить это кому-то другому?
Вот краткое изложение научных данных об источниках энергии для питания смартфонов, электромобилей, кардиостимуляторов и многого другого. [Викторина: электрические и газовые транспортные средства]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора компании Sakti3 из Мичигана. запуск аккумуляторной технологии.
В каждой батарее два электрода. Оба сделаны из проводящих материалов, но выполняют разные роли. Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разрядки.
Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разрядки.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, вызывая химические реакции, которые позволяют батарее генерировать электрический ток. [Взгляд изнутри на то, как работают батареи (инфографика)]
Типичные батареи питаются за счет химической реакции. [Посмотреть полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике) Последняя часть батареи, сепаратор, довольно проста. Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Как это работает
Чтобы представить, как работает батарейка, представьте, что вы вставляете щелочные батарейки типа двойных АА в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Химическая энергия, хранящаяся в батарее, преобразуется в электрическую энергию, которая уходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но уже на противоположном конце от исходного.
Все части батареи работают вместе, чтобы фонарик загорелся. Электроды в батарее содержат атомы некоторых проводящих материалов. Например, в щелочной батарее анод обычно сделан из цинка, а диоксид марганца выступает в качестве катода. А электролит между и внутри этих электродов содержит ионы.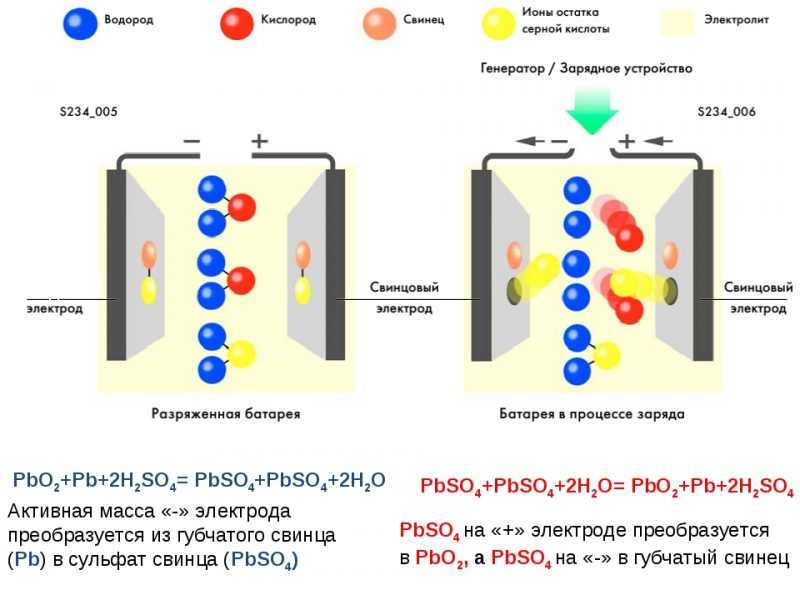 Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, происходящих в электродах, известна под общим названием окислительно-восстановительные (окислительно-восстановительные) реакции. В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к высвобождению электронов из атомов электрода, сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, когда расходуются электроны (которые отрицательно заряжены). Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду.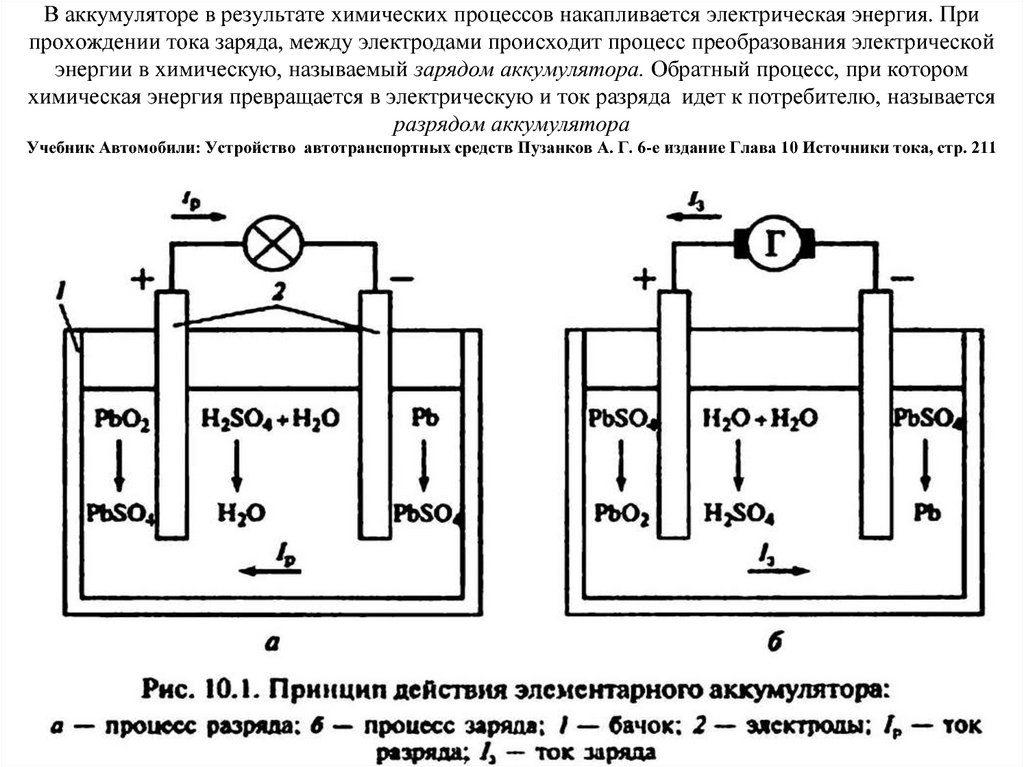 Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Когда вы щелкаете выключателем фонарика, все меняется. Теперь у электронов есть путь к катоду. Но сначала они должны пройти через основание лампы вашего фонаря. Цепь замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи на катоде.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, например, в фонарике, реакции, питающие батарею, со временем перестанут происходить, а это означает, что электроны, обеспечивающие заряд батареи, больше не будут создавать электрический ток. Когда это происходит, батарея разряжается или «разряжается», сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставляют батарею производить энергию, необратимы, объяснил Састри. Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, можно обратить вспять, подав в батарею электрическую энергию.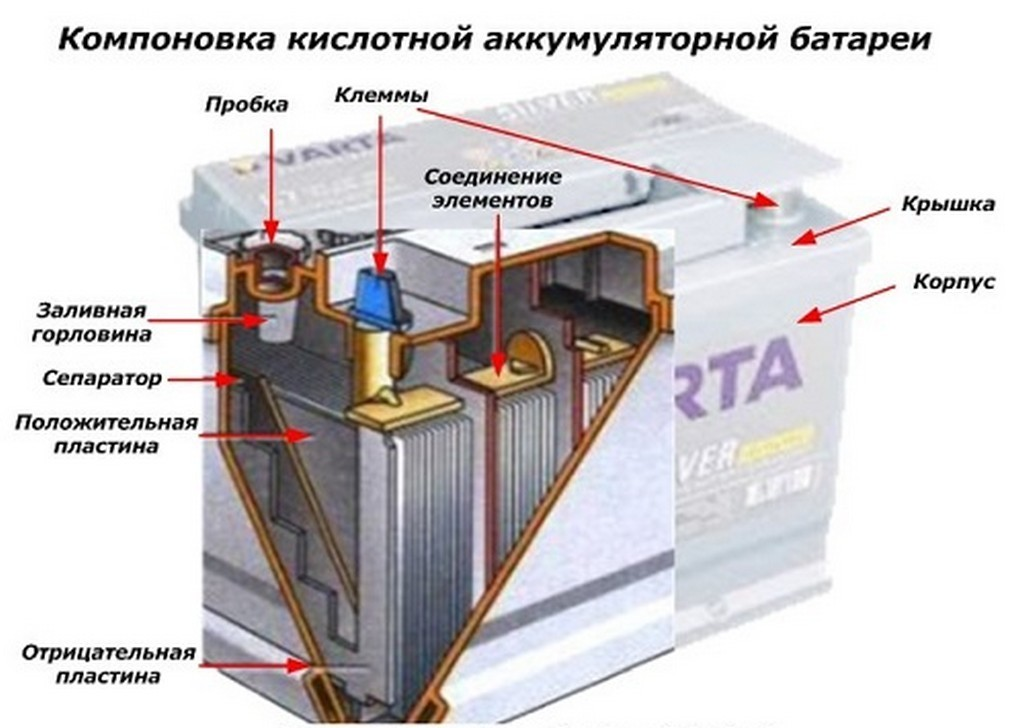 Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Одними из наиболее распространенных в настоящее время вторичных батарей являются литий-ионные (Li-ion) батареи, которые питают большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе. Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и беспроводные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются для питания автомобилей и других транспортных средств для запуска, освещения и зажигания.
Все эти перезаряжаемые батареи работают по одному и тому же принципу, сказал Састри: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, а анод и катод возвращаются в исходное состояние. [10 ведущих прорывных технологий]
[10 ведущих прорывных технологий]
Батарейный жаргон
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при обсуждении аккумуляторов:
Напряжение : Когда речь идет о батареях, напряжение — также известное как номинальное напряжение элемента — описывает величину электрической силы или давления, при котором свободные электроны перемещаются от положительного конца батареи к отрицательному, объяснил Састри. . В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (большая электрическая сила). Батарейки в фонарике обычно имеют напряжение 1,5 вольта. Однако, если фонарик использует две последовательно соединенные батареи, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные аккумуляторы, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольта.
Литий-кобальт-оксидные батареи — наиболее распространенный тип литий-ионных батарей, используемых в бытовой электронике, — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер, или ампер, является мерой электрического тока или количества электронов, протекающих по цепи в течение определенного периода времени.
Емкость : Емкость или емкость элемента измеряется в ампер-часах, что представляет собой количество часов, в течение которых батарея может обеспечивать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райс. Факультет электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно подавать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и считается разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей удельная мощность важна, потому что она говорит вам, как быстро автомобиль может разгоняться от 0 до 60 миль в час (97 км/ч). Инженеры постоянно пытаются придумать способы сделать батареи меньше, не уменьшая их плотность мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна обеспечить батарея, разделенная на объем или массу батареи, сказал Састри. Это число соответствует вещам, которые оказывают большое влияние на пользователей, например, сколько времени вам нужно, чтобы зарядить свой мобильный телефон, или как далеко вы можете проехать на своем электромобиле, прежде чем остановиться, чтобы подключить его.
Подпишитесь на Элизабет Палермо @ techEpalermo . Подпишитесь на Live Science @livescience , Facebook & Google+ .
Дополнительные ресурсы
- Ассоциация стандартов IEEE: Стандарты батарей
- Агентство по охране окружающей среды: Сохранение ресурсов — Батареи
- All-Battery.com: Таблица размеров (открывается в новой вкладке)
Элизабет — бывший помощник редактора Live Science, а в настоящее время — директор по развитию аудитории в Торговой палате. Она получила степень бакалавра искусств в Университете Джорджа Вашингтона. Элизабет путешествовала по Америке, изучая политические системы и культуры коренных народов, а также обучая английскому языку учащихся всех возрастов.
Что такое электролит в батарее? (Принцип работы и типы аккумуляторов)
От высокотехнологичного электромобиля до дешевой игрушечной машинки с дистанционным управлением питание аккумуляторов стало неотъемлемой частью нашей повседневной жизни. На протяжении многих лет мир использовал дорогие источники энергии для выполнения повседневных задач.
Однако, после достаточного количества разработок, батареи оказались эффективным изобретением в качестве источника и хранения электроэнергии. Внутренний электролит в аккумуляторе является одним из основных компонентов, которые делают все волшебство.
Внутренний электролит в аккумуляторе является одним из основных компонентов, которые делают все волшебство.
В сегодняшнем посте мы обсудим, что такое электролит в аккумуляторе и как его сделать в домашних условиях.
Содержание
- Что такое электролит в батарее?
- Как электролиты работают в батарее?
- Из чего состоит электролит батареи?
- Распространенные типы батарей с их электролитами
- Как приготовить раствор электролита для батареи?
- Резюме
Что такое электролит в батарее?
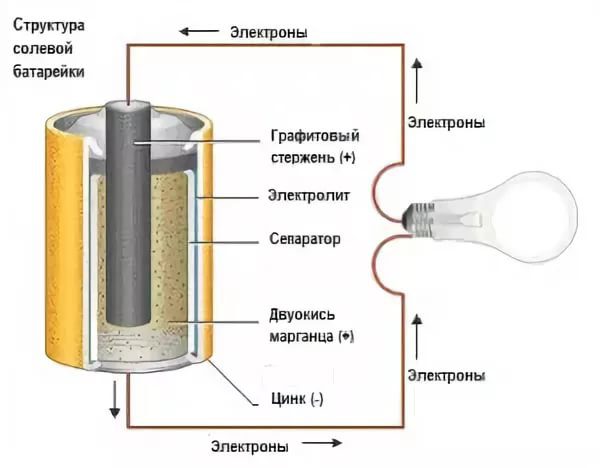
Электролит в батарее представляет собой вещество, которое дает ионы (электрически заряженные атомы, которые приобрели или потеряли электроны) при растворении в воде или жидкостях. Благодаря движению положительных и отрицательных ионов раствор проводит электрический ток, который течет между двумя электродами — анодом и катодом.
Электролит батареи может быть жидким или твердым, в зависимости от типа батареи. Однако потенциальными электролитами могут быть любые среды, содержащие ионы.
Однако потенциальными электролитами могут быть любые среды, содержащие ионы.
Электролиты можно разделить на сильные и слабые химические соединения. Сильные электролиты — это те, которые почти или полностью ионизируются в растворе, а слабые — частично.
Как электролиты работают в батарее?
Чтобы понять, как работает электролит батареи, нам сначала нужно изучить основные компоненты батареи — анод, катод и электролит (который разделяет две клеммы). Поскольку мы уже обсуждали электролит выше, давайте рассмотрим анод и катод.
Анод – это отрицательная клемма или восстановительный электрод, который окисляет и высвобождает электроны во внешнюю цепь во время электрохимической реакции.
С другой стороны, катод – это положительный вывод или окислительный электрод. Он восстанавливается в ходе электрохимической реакции, приобретая электроны, выделяемые анодом во внешнюю цепь.
Электролит обеспечивает среду для перемещения электрического заряда в виде ионов между двумя клеммами. Катионы с положительным зарядом движутся к катоду, а анионы с отрицательным зарядом — к аноду. Кроме того, электролит приводит подходящее химическое вещество, необходимое для реакции, в контакт с клеммами, что преобразует накопленную энергию в пригодную для использования электрическую энергию.
Катионы с положительным зарядом движутся к катоду, а анионы с отрицательным зарядом — к аноду. Кроме того, электролит приводит подходящее химическое вещество, необходимое для реакции, в контакт с клеммами, что преобразует накопленную энергию в пригодную для использования электрическую энергию.
Полезная электрическая энергия встречается с подключенным устройством, будь то лампочка или пылесос, и питает его.
Из чего состоит электролит батареи?
Электролит батареи состоит из растворимых солей, кислот или оснований. Однако точный характер электролита зависит от типа батареи и требуемой величины тока.
Например, в обычных щелочных бытовых батареях используется гидроксид калия, который является сильным электролитом и поэтому обладает высокой электропроводностью. С другой стороны, свинцово-кислотный аккумулятор в автомобилях использует серную кислоту в качестве электролита и вызывает требуемую реакцию.
Давайте рассмотрим некоторые типы аккумуляторов с подходящими для них электролитами.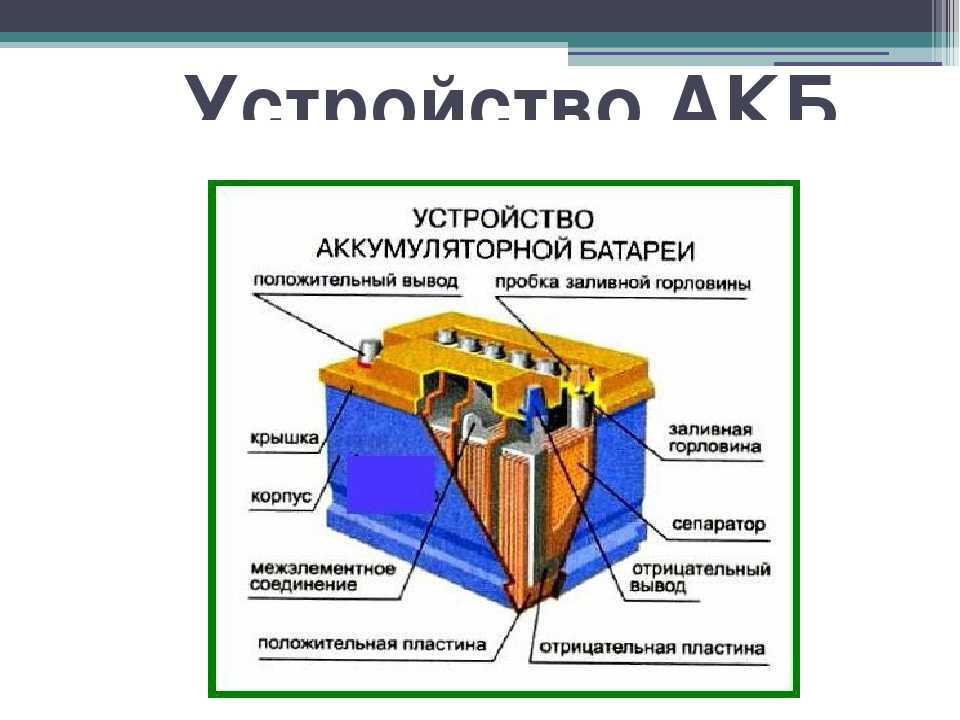
Распространенные типы аккумуляторов с их электролитами
1. Свинцово-кислотные
Свинцово-кислотные аккумуляторы — это перезаряжаемые аккумуляторы, в которых для химических реакций используется кислый электролит (серная кислота) и металлический свинец (Pb). Серная кислота — очень коррозионное вещество, растворимое в воде. Он бесцветный, с легким желто-зеленым оттенком. Однако он обесцвечивается до коричневатого оттенка из-за ржавчины в результате анодной коррозии, возникающей при растворении анода в электролите.
Для контролируемой химической реакции металлический свинец погружается в серную кислоту, в результате чего батарея вырабатывает электричество. Этот химический процесс извлечения тока из свинцово-кислотного аккумулятора известен как разрядка.
Более того, когда аккумулятору необходимо перезарядиться, реагенты (ранее использовавшиеся для выработки электроэнергии) могут быть регенерированы за счет внешнего пропускания тока через аккумулятор.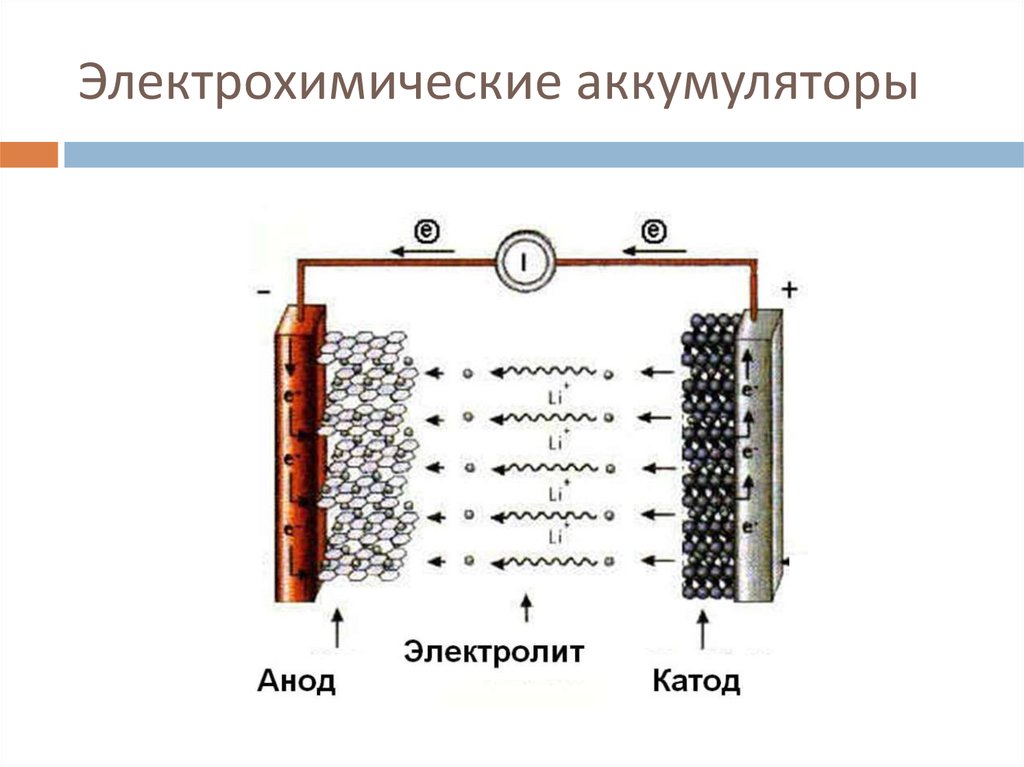 Этот процесс известен как перезарядка.
Этот процесс известен как перезарядка.
Свинцово-кислотный аккумулятор имеет большой вес, но вырабатывает высокое напряжение. Он оснащен ячейками 2 В, что означает, что он имеет четное количество вольт. Наиболее распространенные свинцово-кислотные батареи имеют напряжение 2 В, 6 В, 12 В и 24 В.
Поэтому он обычно используется в машинах, ИБП (источниках бесперебойного питания) и системах, которые требуют высокой мощности для работы и не имеют значения веса батареи.
2. Никель-кадмиевые (NiCd)
Электролит, используемый в никель-кадмиевых (NiCd) батареях, представляет собой тридцатипроцентный раствор гидроксида калия (КОН) в дистиллированной воде. При комнатной температуре его удельный вес остается между 1,240 и 1,300.
По сравнению со свинцово-кислотными батареями никель-кадмиевые батареи дороже, но имеют более высокую плотность энергии, что означает, что они могут хранить больше энергии на единицу веса. Он также служит дольше, чем свинцово-кислотные аккумуляторы, поскольку у него больше жизненных циклов, около 2000-2500.
3. Никель-металл-гидридный (NiMH)
Никель-металл-гидридный (NiMH) аккумулятор использует тот же электролит, что и NiCd, а именно гидроксид калия. Гидроксид калия, также известный как едкий калий, представляет собой неорганическое соединение и сильное основание, широко используемое в большинстве мягких и жидких мыл. Электролит бесцветен и имеет множество промышленных применений.
Батарея содержит электроды, изготовленные из уникальных металлов, таких как никель, кобальт, марганец и алюминий, которые также присутствуют в литий-ионных батареях. Однако батарея NiMH более хрупкая, чем литий-ионная и никель-кадмиевая.
4. Литий-ионные (Li-ion)
В литий-ионных (Li-ion) батареях используются электролиты, состоящие из солей лития, таких как гексафторфосфат лития (LiPF6) в органическом растворителе. Литий-ионные аккумуляторы работают как с гелевым или сухим полимером, так и с жидким электролитом.
Элементы литий-ионных аккумуляторов легкие и обладают высокой плотностью энергии, что дает им преимущество перед любыми аккумуляторными элементами.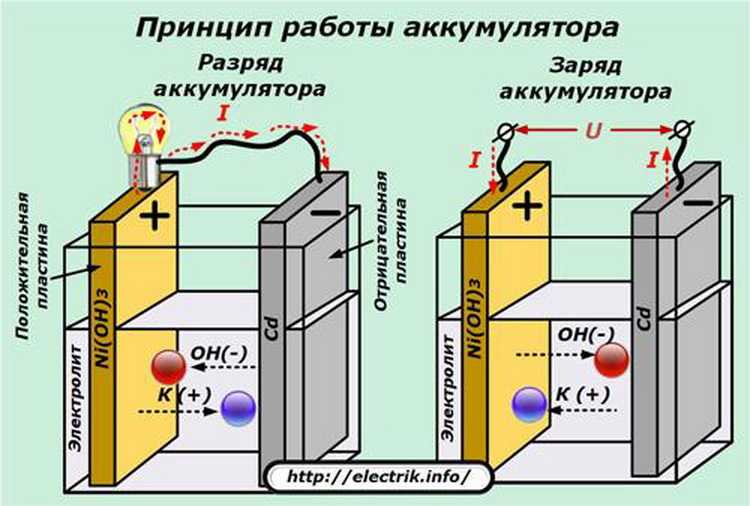 Они способны генерировать мощность 3,6 В, что делает их полезными в широком диапазоне приложений, таких как транспортные средства, силовое оборудование и портативные устройства, такие как ноутбуки и сотовые телефоны.
Они способны генерировать мощность 3,6 В, что делает их полезными в широком диапазоне приложений, таких как транспортные средства, силовое оборудование и портативные устройства, такие как ноутбуки и сотовые телефоны.
Как сделать раствор электролита для аккумулятора?
Когда в вашей жидкостной батарее заканчивается топливо (электролит), вы можете сделать его дома, а не покупать.
Хотя для приготовления раствора электролита требуются некоторые школьные знания химии, вы все же можете сделать его, следуя этому руководству. Однако действовать нужно осторожно, так как процесс приготовления электролита опасен.
Прежде чем начать, решите, какой химический раствор вы хотите использовать для приготовления электролита. Обычно для аккумуляторов больше всего подходят сильные кислоты, растворенные в чистой смеси воды. Вода помогает стабилизировать активность ионов водорода. Вы можете использовать серную кислоту, если у вас есть свинцовые электроды, и азотную кислоту для никелевых электродов.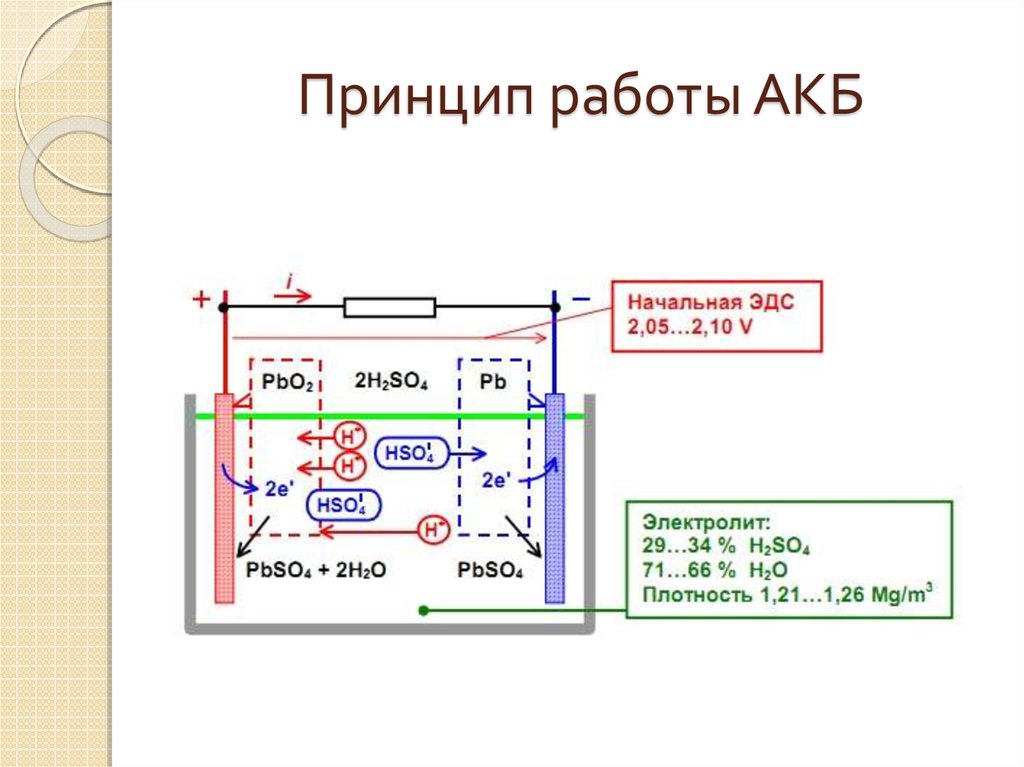
Примечание. Без состава чистой воды небольшой ток может взорвать аккумулятор.
Инструменты, которые вам понадобятся
Помимо перечисленных выше химикатов, для эффективного выполнения процесса вам потребуется следующее оборудование.
- Не менее трех толстых изоляционных контейнеров
- Кислотостойкие перчатки
- Очки
- Захват
- Мультиметр
- Ареометр
- Чертежные трубы (желательно прозрачные)
- Аптечка с пищевой содой для лечения кислотных ожогов
Шаги
Все собралось? Если да, то следуйте следующим шагам!
- Возьмите изолированный контейнер и наполните его водой. Обязательно измерьте объем, прежде чем наливать его. Вы также можете оставить немного воды в другом контейнере, если вам нужно разбавить раствор. В любом случае используйте чистую воду, чтобы исключить риск загрязнения, которое может вызвать нежелательные химические реакции.

- Затем осторожно возьмите контейнер с кислотой с помощью захвата и вылейте его в воду. Если на поверхности появляются чрезмерные пузырьки, приостановите процесс на несколько секунд и дайте им рассеяться. Вы можете вылить остальную кислоту, как только исчезнут пузырьки.
- В этот момент раствор электролита должен иметь высокую температуру. Таким образом, вы можете накрыть его, чтобы позволить любым загрязнениям иметь место. Однако убедитесь, что горячий воздух выходит.
- Когда раствор в контейнере остынет, используйте ареометр, чтобы проверить его крепость и добавить жидкости по мере необходимости.
- Достигнув необходимой прочности, аккуратно залейте кислотный раствор в гнезда батареи. Для этого вы можете использовать волочильные трубы, один конец которых находится на дне контейнера, а другой — в батарейном отсеке.
- Надев кислотостойкие перчатки, наклоните контейнер под постепенно увеличивающимся углом, чтобы кислотный раствор попал в гнездо для батареи.
 Заполните каждый аккумуляторный отсек примерно на три четверти.
Заполните каждый аккумуляторный отсек примерно на три четверти. - Когда слоты заполнены, снимите трубу и закройте слоты. Вот и все! Ваша батарея готова генерировать энергию.
Наконец, используйте мультиметр, чтобы проверить, какое напряжение выдает ваша батарея на клеммах. Будем надеяться, что батарея в порядке!
Резюме
Электролит в батарее представляет собой раствор, который позволяет заряженным ионам и току проходить через катодные и анодные клеммы. Электролит имеет определенные химические характеристики, которые реагируют с электродами, и реакция преобразует накопленную энергию в пригодную для использования электрическую энергию.
Электролиты обычно состоят из растворов сильных кислот, таких как серная и азотная кислота, но обычно электролит может состоять из растворимых солей, кислот и оснований.