признаки неисправности, Приора, Шевроле Нива, Калина 8 клапанов, ВАЗ 2107, 2110,2114
Одна из самых распространённых поломок в автомобиле – неисправность датчика массового расхода воздуха (ДМРВ). Какие сигналы поломки на разных моделях автомобилей и как самостоятельно ее диагностировать, расскажем ниже.
Содержание:
Что такое ДМРВ и какие должен иметь показатели
ДМРВ – специальное устройство для определения объема воздуха, который направляется в цилиндры двигателя автомобиля. Это достаточно простой анализатор с понятным принципом функционирования. Если датчик исправен, он гарантирует нормальную работу системы двигателя с правильным формированием смеси топлива и газа. Проблема с устройством может привести к взрыву топливной смеси в камере сгорания – это нарушит работу КШМ и может заклинить двигатель и вывести его из строя.
Датчик имеет довольно хрупкую конструкцию и может получить повреждения даже при чистке поверхности спецсоставами. Устройство функционирует в сложных условиях, так что может довольно часто ломаться из-за механических воздействий или термического влияния. Датчик не подлежит ремонту и поэтому его необходимо оперативно заменить при поломке.
Датчик не подлежит ремонту и поэтому его необходимо оперативно заменить при поломке.
Исправный датчик должен выдавать определенные значения АЦП. При моторе в нерабочем состоянии показатель не должен превышать 0,996 V. Более высокие цифры (1,016 и 1,025 V) еще приемлемы, но если они выше 1,035 В, оборудование выходит из строя.
Признаки неисправности ДМРВ
Поломка датчика ДМРВ практически всегда явная, не заметить ее сложно. Если автомобиль оборудован современной системой отслеживания, она укажет на поломку конкретного анализатора. Но бывают ситуации, когда неисправность нужно диагностировать своими силами – здесь помогут определенные признаки.
Прежде чем заменять ДМРВ, важно исключить вероятность засора воздушного фильтра, поскольку хорошая работа анализатора зависит от его состояния. Выход из строя ДМРВ сопряжен со следующими особенностями:
Выход из строя ДМРВ сопряжен со следующими особенностями:
- низкий уровень сигнала устройства;
- сложный запуск непрогретого мотора, замедленный разгон, падение мощности, ДВС часто глохнет;
- неоправданно высокие показатели расхода топлива;
- нестабильная работа двигателя на холостых оборотах;
- мотор глохнет при смене скоростного режима;
- необычно низкие либо высокие обороты.
К другим симптомам «смерти» датчика относят повреждение проводки, ошибки в электронике автомобиля.
Если датчик показывает низкий уровень сигнала, вероятнее всего такие проблемы:
- обрыв или появление окислов в цепи датчика;
- неправильное подключение сигнальных проводов.
Для определения неисправности в датчике всегда лучше провести полноценную диагностику авто, поскольку поломки могут случаться в связи с проблемами в другом устройстве. О неисправности с анализатором могут говорить следующие коды ошибок:
- P0100 – поломка электроцепи подключения датчика.
 Необходимо осмотреть и протестировать электропроводку на предмет повреждений.
Необходимо осмотреть и протестировать электропроводку на предмет повреждений. - P0102 – низкий сигнал, фиксируемый на входе электролинии ДМРВ. В этом случае нелишним будет проверить изоляцию кабеля.
- P0103 – высокий сигнал электролинии ДМРВ, фиксируемый на входе. Если провода в порядке, нужен визуальный осмотр устройства и чистка (или замена).
Расскажем об особенностях диагностики для популярных моделей авто. Признаки неисправности справедливы для автомобилей Priora, Chevrolet Niva, Lada Kalina, ВАЗ 2107, ВАЗ 2110, ВАЗ 2114.
В случае проблем датчик ДМРВ будет долго выдавать информацию с погрешностью до 20%. Определить можно по таким симптомам:
- холодный мотор глохнет сразу после старта;
- увеличенный расход бензина;
- мотор неровно работает при спокойном движении;
- даже от небольшого перегруза теряется тяга;
- в холостом ходу могут на короткое время зависнуть обороты в зоне 1500;
- при заливании бензина АИ-92 мощность резко снижается;
- при минусовых температурах двигатель сложнее завести;
- косвенно – наличие черного дыма из выхлопной трубы;
- в 50% ситуаций загорится лампочка Check Engine.

Как самостоятельно диагностировать неисправность ДМРВ
Существует несколько удобных и практичных способов диагностики датчика ДМРВ на неисправности самостоятельно. Расскажем о некоторых из них.
- Отключите оборудование от разъема и заведите мотор. Без датчика контроллеры сработают так, что дадут сигнал о переходе в режим аварийной работы. Приготовление воздушно-топливной смеси зависит от состояния дроссельной заслонки. Если теперь машина лучше едет и не глохнет, значит, причина кроется в поломке датчика.
- Если изменена стандартная прошивка, контроллер может не среагировать на случай аварийной ситуации или среагировать некорректно. Тогда нужно засунуть под упор заслонки дросселя пластинку толщиной до 1 мм. При этом должны вырасти обороты. Если работа мотора не нарушается, проблема в прошивке.
- Установите 100% исправную деталь и попробуйте завести двигатель. Если после смены оборудования работа двигателя улучшилась и он не глохнет, датчик требует замены.

- Визуальный осмотр тоже будет нелишним. Нужно скрутить хомут, который удерживает гофру воздухосборника, и снять его. Осмотрите поверхности внутри датчика и сам воздухосборник. В естественном состоянии в приборе не должно наблюдаться масляных следов или конденсата, поверхности чистые и сухие. Грязь часто становится причиной поломок, поскольку попадает на восприимчивые к ней элементы устройства. В ДМРВ может появиться масло – значит, в картере слишком высок его уровень или забит маслоотбойник. Для чистки поверхностей используйте спецсредства.
- Можно проверить датчик посредством мультиметра. Для этого нужно включить тестер в режим постоянного напряжения и выставить предельное измерение в 2 В. Распиновка датчика на различных авто неизменна, меняться может только цвет провода. Как правило, вход для сигнала расходометра – желтый провод, находится ближе к лобовому стеклу, серо-белый провод на выходе напряжения датчиков, розово-черный ведет к главному реле, а зеленый нужен для заземления.

Чтобы проверить, включите зажигание, но без запуска машины. Щуп мультиметра красного цвета подсоедините к желтому проводу, а черный – на массу, т. е. к зеленому. Новое устройство на выходе показывает напряжение от 0,996 до 1,01 В.
При эксплуатации устройства напряжение будет плавно увеличиваться и можно опередить износ расходометра по следующим цифрам:
- 1,01-1,02 В – отличное состояние;
- от 1,02 до 1,03 В – хорошее;
- 1,03-1,04 В – ресурс устройства заканчивается;
- 1,04-1,05 – датчик значительно изжил себя;
- более 1,05 – датчик нужно менять.
Для проверки датчиков частотного типа можно воспользоваться мотортестером (осциллографом).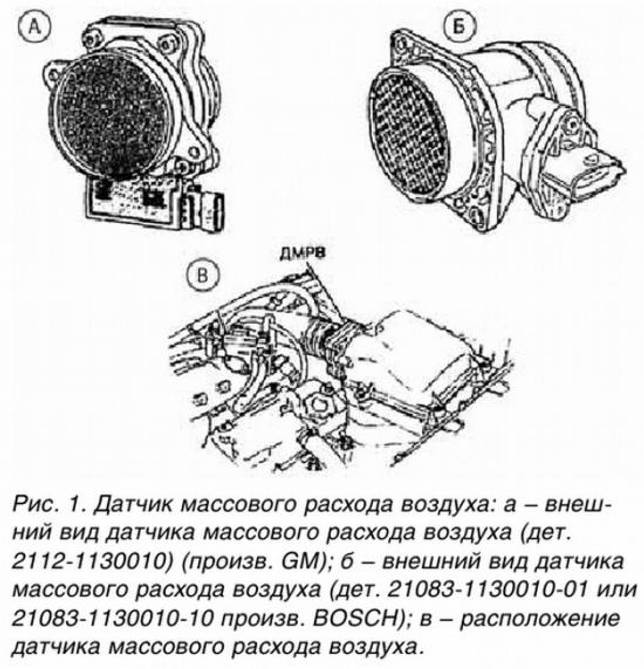 Его надо подключить к датчику и запустить двигатель. Следует обратить внимание на параметры:
Его надо подключить к датчику и запустить двигатель. Следует обратить внимание на параметры:
- времени переходных процессов при активации зажигания;
- показаний закачки воздуха на ходу вхолостую и при одномоментном увеличении оборотов двигателя;
- напряжение в сети датчика.
Что делать, когда датчик ДМРВ неисправен
Первым делом можно почистить прибор. Если на датчике есть грязь, промойте его с помощью WD-40:
- Сначала снимите с прибора патрубок, затем демонтируйте его.
- Внутри вы найдете сеточку и несколько датчиков-проволок. Распылите на них средство и очистите, затем высушите.
- Процедуру надо повторить, если грязь осталась.
В 80% случаях работа прибора восстанавливается после чистки. Если это не помогло, деталь заменяют.
Замена ДМРВ
Чтобы заменить ДМРВ своими руками, подготовьте ключ № 10 и крестовую отвертку. Процедура проста:
- Зажигание выключить, поднять капот.

- Отсоединить минусовую клемму на АКБ.
- Скрутить хомут гофры ДМРВ и снять ее.
- Открутить болты, скрепляющие устройство, и воздушный фильтр – тут понадобится ключ № 10.
- Снять анализатор.
- Новый датчик установить в соответствующей последовательности.
Чтобы увеличить срок службы устройства, необходимо регулярно его очищать, не забывая об очистке воздушного фильтра. Регулярная замена уплотнителей поршневой группы тоже не помешает.
Перед тем как заменить датчик, проверьте возможные неисправности сети и выполните диагностику и чистку других устройств.
Качественное очищение и ремонт помогут избежать замены датчика, но, если это не удалось, заменить его самостоятельно очень просто. В любом случае, сделать это лучше раньше, чем позже.
В любом случае, сделать это лучше раньше, чем позже.
Как вам статья?
Датчик ДМРВ ВАЗ-2112 16 клапанов признаки неисправности: проверка
ДМВР – это датчик массового расхода воздуха, или как его называют в народе – расходомер.
На видео показаны симптомы неисправного датчика ДМРВ на Ваз. Специально был установлен нерабочий ДМРВ:
Содержание
- 1 Признаки неисправности ДМВР
- 1.1 Как проверить датчик ДМРВ?
- 1.1.1 Показания напряжения исправного и неисправного датчика
- 1.
 2 Альтернативный способ проверки
2 Альтернативный способ проверки
- 1.1 Как проверить датчик ДМРВ?
- 2 Выводы
Признаки неисправности ДМВР
Устройство датчика массового расхода воздуха
Признаки неисправности датчика массового расхода воздуха могут быть прямые или косвенные. Рассмотрим, все возможные варианты:- Загорание на приборной панели Check Engine. В большинстве случаев, индикатор ЧЕК загорается по причине выхода из строя одного из датчиков, поэтому необходимо подключиться к ЭБУ, чтобы точно определить неисправность.
- Падение мощности является только косвенным признаком, поскольку этой неисправности может быть и другая причина.
- Увеличенный расход топлива. Конечно, все можно списать на бензонасос, но ДМВР необходимо также проверить. О нормативных показателях расхода топлива здесь.
- Снижение динамики разгона. Неверное количество воздушной смеси, которое попадает в камеры сгорания, дает плохую зажигательную смесь, что в свою очередь, не дает автомобилю нормально разгоняться и приводит к рывкам при резком нажатии на педаль газа.

- Плохой пуск или его невозможность. Богатая или бедная топливная смесь не может нормально детонировать, что повлечет за собой именно такие проблемы. А также возможно не прогорание топлива и хлопки в глушителе.
- Плавающие обороты на холостом ходу. Разное количество попадающего воздуха в топливную смесь даст эффект, когда обороты будут, то понижаться, то повышаться.
Для точного определения неисправности датчика ДМВР необходимо провести ему диагностику.
Как проверить датчик ДМРВ?
Датчик массового расхода воздуха проверяется при помощи мультиметра
Датчик массового расхода воздуха проверяется достаточно легко. Для диагностики понадобится мультиметр.
- Отключаем фишки от питания датчика и вставляем щупы измерительного прибора.
Подключаем щупы измерительного прибора: красным к жёлтому, а чёрным к зеленому (на массу датчика).
- Теперь датчик перешел в аварийный режим, и воздух дозируется по последним показателям.
 Если при пуске двигателя питание не замыкается, то проблема в ДМВР.
Если при пуске двигателя питание не замыкается, то проблема в ДМВР.
Показания напряжения исправного и неисправного датчика
- 1.01-1.02 — показания нового датчика, всё в норме.
- 1.02-1.03 — есть износ, но параметры в пределах нормы.
- 1.03-1.04 — параметры рабочие, но уже есть износ.
- 1.04-1.05 — критические параметры, готовьтесь к замене, если есть деньги, то меняем. Возможно уменьшится расход топлива.
- 1.05 и выше — не рабочий датчик ДМРВ.
Замер при помощи скрепок — может быть погрешность у прибора. По показаниям видно что датчик «приказал долго жить»
Альтернативный способ проверки
Второй способ проверить работоспособность датчика массового расхода воздуха – это отключить от него питание и проехать несколько километров. Если работа двигателя улучшилась, то проблема именно в ДМРВ.
Выводы
Определить неисправность датчика массового расхода воздуха ВАЗ-2112 16 клапанов достаточно легко. Для этого необходимо знать прямые и косвенные причины, которые способствуют диагностике, а также провести проверку самыми элементарными способами.
Для этого необходимо знать прямые и косвенные причины, которые способствуют диагностике, а также провести проверку самыми элементарными способами.
Миопатия GNE — Национальная организация редких заболеваний
Благодарность
NORD выражает благодарность Кармен Бертони, доктору медицинских наук, бывшему доценту кафедры неврологии Калифорнийского университета в Лос-Анджелесе; генеральный директор NMD BioConsulting; Научный директор Фонда нервно-мышечных заболеваний за помощь в подготовке этого отчета.
Синонимы
- наследственная миопатия с тельцами включения
- ХИБМ
- ч-IBM
- IBM2
- миопатия с тельцами включения, аутосомно-рецессивная
- миопатия с тельцами включения, четырехглавая мышца бедра
- КСМ
- наследственная миопатия с тельцами включения
- дистальная миопатия с ободковыми вакуолями
- ДМРВ
- Миопатия Нонака
- ободковая вакуольная миопатия
- щадящая миопатия четырехглавой мышцы
Обзор заболеваний
Резюме
Миопатия ГНЭ, также известная как HIBM, миопатия Нонака, IBM2 и дистальная миопатия с ободковыми вакуолями, представляет собой генетическое заболевание, поражающее в первую очередь скелетные мышцы (мышцы, которые организм использует для выполнения ежедневных физических упражнений). активность). Первые признаки заболевания появляются в возрасте от 20 до 40 лет и поражают мужчин и женщин с одинаковой частотой. Это состояние характеризуется прогрессирующей мышечной слабостью, которая обычно ухудшается со временем, снижением силы хвата и частой потерей равновесия. 1,2
активность). Первые признаки заболевания появляются в возрасте от 20 до 40 лет и поражают мужчин и женщин с одинаковой частотой. Это состояние характеризуется прогрессирующей мышечной слабостью, которая обычно ухудшается со временем, снижением силы хвата и частой потерей равновесия. 1,2
Миопатия ГНЭ вызывается изменениями (мутациями) гена ГНЭ , который кодирует фермент, известный как глюкозамин (УДФ-N-ацетил)-2-эпимераза/N-ацетилманнозаминкиназа. Фермент отвечает за производство сиаловой кислоты (СК), сахара, необходимого всем клеткам, включая мышцы, для производства энергии, а также важного компонента клеточных мембран. Заболевание наследуется по аутосомно-рецессивному типу. 3
В настоящее время не существует лекарства от этой болезни, и лечение направлено на купирование симптомов. Тем не менее, в настоящее время проводятся доклинические и клинические исследования нескольких потенциальных методов лечения, включая замену субстрата и стратегии, основанные на генной терапии.
Введение
Термин миопатия ГНЭ относится к группе заболеваний, описанных во всем мире различными исследователями и врачами за последние несколько десятилетий. В 1984 г. Нонака и соавт. были первыми, кто описал редкое мышечное заболевание, поражающее преимущественно передние большеберцовые мышцы и характеризующееся умеренным повышением уровня креатинкиназы (КК) в сыворотке крови и мышечной атрофией. Под микроскопом биопсия мышц часто выявляла характерные гистопатологические изменения, включая вакуоли с ободком, отсутствие воспаления и отсутствие признаков регенерации. 4,5 Таким образом, они первоначально назвали болезнь дистальная миопатия с окаймленными вакуолями (DMRV) для описания семейной миопатии с началом в раннем взрослом возрасте. Затем последовали отчеты Аргова и Ярома, описывающие аналогичную патологию, обнаруженную в иранских еврейских семьях и характеризующуюся аутосомно-рецессивным наследованием. В дополнение к показу типичного присутствия вакуолей с ободком в биоптатах мышц, эти исследования также показали, что болезнь не затрагивает четырехглавую мышцу. 3 Это привело к тому, что группа назвала состояние наследственной миопатией с тельцами включения (HIBM). 6 Другие исторические названия включают миопатию Нонака, миопатию с тельцами включения 2 (IBM2) и миопатию, сохраняющую четырехглавую мышцу (QSM). Наконец, идентификация в начале 2000-х годов мутаций гена GNE , ответственных за эти заболевания, привела к объединению заболеваний под тем же названием, которое теперь известно и обычно называется миопатией GNE. 7-9
3 Это привело к тому, что группа назвала состояние наследственной миопатией с тельцами включения (HIBM). 6 Другие исторические названия включают миопатию Нонака, миопатию с тельцами включения 2 (IBM2) и миопатию, сохраняющую четырехглавую мышцу (QSM). Наконец, идентификация в начале 2000-х годов мутаций гена GNE , ответственных за эти заболевания, привела к объединению заболеваний под тем же названием, которое теперь известно и обычно называется миопатией GNE. 7-9
Признаки и симптомы
Миопатия ГНЭ проявляется между вторым и третьим десятилетием жизни и характеризуется прогрессирующей мышечной атрофией, часто сопровождаемой тяжелой инвалидностью в течение 10–20 лет после начала заболевания. Даже на ранних стадиях заболевания у пациентов с миопатией ГНЭ наблюдается характерное двустороннее свисание стопы, вызванное слабостью передней большеберцовой мышцы (одной из лобных мышц, которая связана с коленом и стопой). Мышечная слабость на ранней стадии у пациентов с миопатией с ГНЭ может включать нарушение походки и снижение устойчивости, частые падения, трудности при подъеме по лестнице, беге и вставании из положения сидя. Большинство пациентов оказываются прикованными к инвалидной коляске в течение 10-20 лет после начала заболевания. Мышцы нижних конечностей поражаются в первую очередь, за исключением четырехглавой мышцы, которая кажется относительно сохранной. По мере прогрессирования заболевания, через 5–10 лет после появления симптомов, у большинства пациентов наблюдается прогрессирующая слабость и потеря мышц верхних конечностей. На поздних стадиях болезни могут поражаться и мышцы шеи. 1, 10, 11 В конечном итоге прогрессирование заболевания может привести к полной потере функции скелетных мышц и зависимости от лиц, осуществляющих уход путают с другими состояниями, такими как другие дистальные миопатии, мышечная дистрофия пояса конечностей, спинальная мышечная атрофия или болезнь Шарко-Мари-Тута. Поэтому настоятельно рекомендуется обратиться к нейромышечному специалисту.
Большинство пациентов оказываются прикованными к инвалидной коляске в течение 10-20 лет после начала заболевания. Мышцы нижних конечностей поражаются в первую очередь, за исключением четырехглавой мышцы, которая кажется относительно сохранной. По мере прогрессирования заболевания, через 5–10 лет после появления симптомов, у большинства пациентов наблюдается прогрессирующая слабость и потеря мышц верхних конечностей. На поздних стадиях болезни могут поражаться и мышцы шеи. 1, 10, 11 В конечном итоге прогрессирование заболевания может привести к полной потере функции скелетных мышц и зависимости от лиц, осуществляющих уход путают с другими состояниями, такими как другие дистальные миопатии, мышечная дистрофия пояса конечностей, спинальная мышечная атрофия или болезнь Шарко-Мари-Тута. Поэтому настоятельно рекомендуется обратиться к нейромышечному специалисту.
Диагностика
Стандартная терапия
Исследовательская терапия
Был проведен ряд клинических испытаний для оценки безопасности и эффективности заместительной ферментной терапии для лечения миопатии, вызванной ГНЭ. Некоторые из этих испытаний завершены, в то время как другие еще продолжаются (подробную информацию о наборе и критериях включения/исключения для регистрации участников см. на https://clinicaltrials.gov/). Все исследования, финансируемые правительством США, а некоторые из них поддерживаются частным сектором, публикуются на этом правительственном веб-сайте.
Некоторые из этих испытаний завершены, в то время как другие еще продолжаются (подробную информацию о наборе и критериях включения/исключения для регистрации участников см. на https://clinicaltrials.gov/). Все исследования, финансируемые правительством США, а некоторые из них поддерживаются частным сектором, публикуются на этом правительственном веб-сайте.
Ниже приведены краткие сведения и информация об основных исследованиях, проведенных во всем мире у пациентов с миопатией, связанной с ГНЭ.
1-Внутривенный иммуноглобулин (ВВИГ) для лечения наследственной миопатии с включениями (ClinicalTrials.gov: NCT00195637) был проведен в Национальном институте здравоохранения (NIH) для оценки влияния лечения иммуноглобулином (ИГ) на мышцы и мышечную функцию . IG представляет собой белок крови, несущий большое количество SA. ВВИГ вводили четырем пациентам с миопатией ГНЭ в течение 2 дней подряд, и улучшение мышечной силы и других функциональных параметров было обнаружено в четырехглавой мышце и плечах, что позволяет предположить, что заместительная энзимная терапия и, в частности, добавка СК оказывают заметное благотворное влияние на пациентов.
2-Клиническое исследование фазы 1 с применением N-ацетилнейраминовой кислоты (NeuAc), предшественника СА, было проведено в Университете Тохоку в Японии у трех пациентов в 2010–2011 гг. (ClinicalTrials.gov: NCT01236898). Испытание было сосредоточено только на оценке безопасности приема 800 мг NeuAc три раза в день в течение пяти дней подряд и не предназначалось для демонстрации терапевтической эффективности. Результаты не показали значительных побочных эффектов ни у одного из пациентов, протестированных на протяжении всего исследования.
Трехфазные испытания 1/2 и фазы 3 были проведены фармацевтической компанией Ultragenix для оценки безопасности и эффективности состава SA с пролонгированным высвобождением (SA-ER). В исследование фазы 1/2 было включено 47 пациентов, получавших либо низкую дозу (3 г), либо высокую дозу (6 г) на срок до 48 недель (ClinicalTrials.gov: NCT01517880). Результаты показали умеренное, но положительное улучшение функции мышц верхних конечностей по сравнению с контрольной группой плацебо. Серьезных побочных эффектов и минимальных нежелательных явлений не наблюдалось.
Серьезных побочных эффектов и минимальных нежелательных явлений не наблюдалось.
Аналогичные результаты были получены в расширенных исследованиях фазы 2 у пациентов, включенных в исследование фазы 1/2. Были проведены исследования для оценки дополнительной долгосрочной безопасности лечения SA-ER у участников с миопатией GNE, ранее получавших SA-ER в дозе 6 г/день, а также для оценки безопасности 12 г/день SA в течение 6-месячный период лечения (ClinicalTrials.gov: NCT01830972). В первой части расширенного исследования все 46 пациентов из 48-недельного исследования фазы 1/2 перешли на прием 6 г/день в течение переменного периода времени, который в среднем составлял 24 недели. Во второй части расширенного исследования все 46 пациентов и 13 пациентов, ранее не получавших лечения, получали 12 г/день SA-ER в течение 24 недель. SA-ER оказался в целом безопасным и хорошо переносимым, без серьезных побочных эффектов, связанных с приемом препарата, хотя у небольшого числа пациентов наблюдались побочные эффекты со стороны желудочно-кишечного тракта легкой и средней степени тяжести.
Однако исследование фазы 3 (ClinicalTrials. gov: NCT02377921) не достигло своей основной конечной точки, продемонстрировав статистически значимое различие в силе мышц верхних конечностей по сравнению с плацебо. Исследование также не достигло ключевых вторичных конечных точек. Неутешительный результат заставил Ultragenyx отказаться от плана дальнейшего клинического развития SA-ER.
4 фазы 1 и 2 клинических испытаний ManNAc (моногидрат N-ацетил-D-маннозамина) также были проведены NIH у пациентов с миопатией GNE. ManNAc является предшественником в биосинтезе Neu5Ac и субстратом фермента GNE. В исследованиях фазы 1 (ClinicalTrials.gov NCT01634750) ManAc вводили перорально в виде жидкого раствора 3 группам из 6 субъектов (группы A, B, C) в дозах 3 грамма, 6 грамм и 10 грамм ManNAc соответственно. наиболее распространенными симптомами были проблемы с желудочно-кишечным трактом, такие как спазмы в животе и диарея.В исследование безопасности, фармакокинетики и продукции SA после перорального введения ManNAc у субъектов с миопатией GNE были включены в общей сложности 22 участника.
Исследования фазы 2 были сосредоточены на определении эффективности ManAc у пациентов с миопатией, связанной с ГНЭ (ClinicalTrials.gov NCT02346461A). Всего в исследование было включено 12 пациентов, которые были разделены на две когорты. Группа А получала перорально ManNAc по 3 грамма два раза в день (6 граммов в день) в течение 7 дней, а затем доза была увеличена до 6 граммов два раза в день (12 граммов в день) до конца исследования. Когорта B получала ManNAc перорально по 6 граммов два раза в день (12 граммов в день) на протяжении всего исследования.
Также запланировано многоцентровое исследование ManNAc для лечения миопатии GNE (MAGiNE) (ClinicalTrials.gov NCT04231266). Ожидается, что подробности этих исследований будут обнародованы в ближайшие несколько месяцев.
5-Естественный анамнез и исследования реестра пациентов были проведены Ultragenyx независимо друг от друга в сотрудничестве с TREAT-NMD (ClinicalTrials.gov: NCT04009226) и NIH (ClinicalTrials.gov: NCT01417533). Объем этих исследований заключается в оценке и лучшем понимании скорости прогрессирования миопатии ГНЭ, ее клинической вариабельности, а также в выявлении маркеров прогрессирования, которые можно использовать для оценки эффективности текущих и будущих клинических испытаний. Эти исследования также имеют потенциал для выявления новых пациентов во всем мире и создания реестра пациентов. Информацию о статусе исследования, регистрации, критериях включения и исключения можно найти по адресу https://clinicaltrials.gov/ 9.0005
Объем этих исследований заключается в оценке и лучшем понимании скорости прогрессирования миопатии ГНЭ, ее клинической вариабельности, а также в выявлении маркеров прогрессирования, которые можно использовать для оценки эффективности текущих и будущих клинических испытаний. Эти исследования также имеют потенциал для выявления новых пациентов во всем мире и создания реестра пациентов. Информацию о статусе исследования, регистрации, критериях включения и исключения можно найти по адресу https://clinicaltrials.gov/ 9.0005
Для получения информации о клинических испытаниях, проводимых в Клиническом центре NIH в Бетесде, штат Мэриленд, обращайтесь в отдел набора пациентов NIH:
Бесплатный звонок: (800) 411-1222
TTY: (866) 411-1010
Электронная почта: [email защищено]
Некоторые текущие клинические испытания также размещены на следующей странице веб-сайта NORD:
https://nord1dev.wpengine.com/for-patients-and-families/information-resources/info-clinical-trials-and -research-studies/
Для получения информации о клинических испытаниях, спонсируемых частными источниками, обращайтесь:
http://www.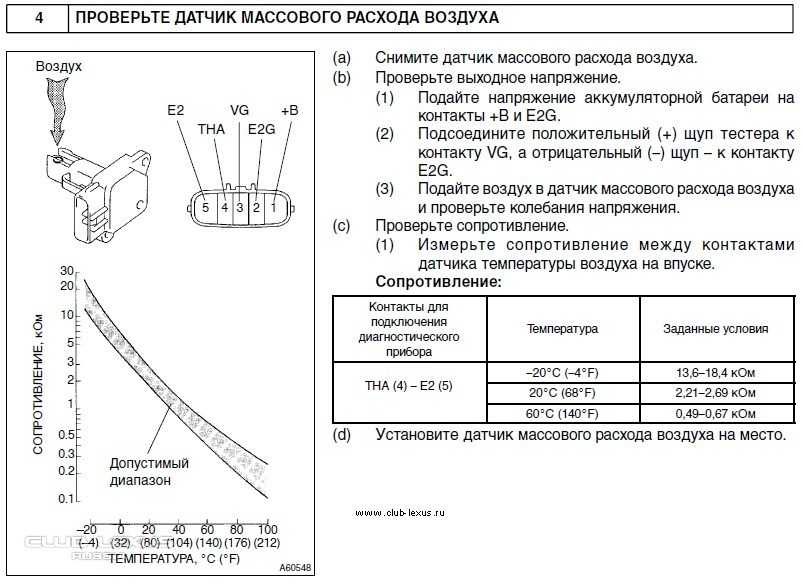 centerwatch.com/
centerwatch.com/
Для получения информации о клинических испытаниях, проведенных в Европе, обращайтесь:
https://www.clinicaltrialsregister.eu/
Ссылки
1. Carrillo N, Malicdan MC, Huizing M , Миопатия GNE: этиология, диагностика и терапевтические проблемы. Нейротерапия 2018;15(4):900-914.
2. Хьюзинг М., Маликдан М.С., Красневич Д.М., Маноли И., Каррильо-Карраско Н. ГНЭ Миопатия. В: Валле Д., Антонаракис С., Баллабио А., Боде А.Л., Митчелл Г.А., редакторы. OMMBID — Интернет-метаболические и молекулярные основы наследственных заболеваний. Нью-Йорк: McGraw-Hill; 2014.
3. Аргов З., Яром Р. Ободковая вакуольная миопатия с сохранением четырехглавой мышцы. Уникальное расстройство у иранских евреев. J Neurol Sci. 1984;64(1):33-43.
4. Нонака И., Сунохара Н., Ишиура С., Сатоёси Э. Семейная дистальная миопатия с образованием окаймленной вакуоли и пластинчатого (миелоидного) тела. J Neurol Sci. 1981;51(1):141-155.
5. Нонака И., Сунохара Н. , Сатоёси Э., Терасава К., Йонемото К. Аутосомно-рецессивная дистальная мышечная дистрофия: сравнительное исследование с дистальной миопатией с образованием краевых вакуолей. Энн Нейрол. 1985;17(1):51-59.
, Сатоёси Э., Терасава К., Йонемото К. Аутосомно-рецессивная дистальная мышечная дистрофия: сравнительное исследование с дистальной миопатией с образованием краевых вакуолей. Энн Нейрол. 1985;17(1):51-59.
6. Митрани-Розенбаум С., Аргов З., Блюменфельд А., Зайдман К.Э., Зайдман Дж.Г. Наследственная миопатия с тельцами включения картируется на хромосоме 9p1-q1. Хум Мол Жене. 1996;5(1):159-163.
7. Айзенберг И., Авидан Н., Потиха Т. и др. Ген UDP-N-ацетилглюкозамин-2-эпимеразы/N-ацетилманнозаминкиназы мутирует при рецессивной наследственной миопатии с тельцами включения. Нат Жене. 2001;29(1):83-87.
8. Нишино И., Ногучи С., Мураяма К. и др. Дистальная миопатия с окаймленными вакуолями аллельна наследственной миопатии с тельцами включения. Неврология 2002;59(11): 1689-1693.
9. Huizing M, Carrillo-Carrasco N, Malicdan MC et al. Миопатия ГНЭ: новое название и новая номенклатура мутаций. Нервно-мышечное расстройство. 2014;24(5):387-389.
10. Pogoryelova O, Cammish P, Mansbach H et al. Фенотипическая стратификация и корреляция генотип-фенотип в гетерогенной международной когорте пациентов с миопатией GNE: первый отчет Программы мониторинга заболеваний миопатии GNE, часть регистра. Нервно-мышечное расстройство. 2018;28(2):158-168.
Фенотипическая стратификация и корреляция генотип-фенотип в гетерогенной международной когорте пациентов с миопатией GNE: первый отчет Программы мониторинга заболеваний миопатии GNE, часть регистра. Нервно-мышечное расстройство. 2018;28(2):158-168.
11. Mori-Yoshimura M, Oya Y, Yajima H et al. Миопатия ГНЭ: проспективное исследование естественной истории прогрессирования заболевания. Нервно-мышечное расстройство 2014;24(5):380-386.
12. Слота С., Беванс М., Ян Л., Шредер Дж., Джо Г., Каррильо Н. Пациент сообщил об исходах миопатии с НЭ: включение достоверной оценки физической функции при редком заболевании. Реабилитация инвалида. 2018;40(10):1206-1213.
13. Чо А., Хаяши Ю.К., Монма К. и др. Профиль мутаций гена GNE у японских пациентов с дистальной миопатией с ободковыми вакуолями (миопатия GNE). J Neurol Neurosurg Psychiatry 2014;85(8):914-917.
14. Нишино И., Каррильо-Карраско Н., Аргов З. Миопатия GNE: текущее обновление и будущая терапия. J Neurol Нейрохирургия Психиатрия 2015;86(4):385-392.
15. Каррильо Н., Маликдан М.С., Хейзинг М. Г.Н.Э. Миопатия. 2004 г., 26 марта [Обновлено 9 апреля 2020 г.]. В: Адам М.П., Ардингер Х.Х., Пагон Р.А. и др., редакторы. GeneReviews® [Интернет]. Сиэтл (Вашингтон): Вашингтонский университет, Сиэтл; 1993-2020 гг. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK1262/ По состоянию на 6 мая 2020 г.
- Программы помощи
- Организации пациентов
- Реестр
RareCare
® Программы помощиNORD стремится открывать новые программы помощи, если позволяет финансирование. Если у нас нет программы для вас сейчас, пожалуйста, продолжайте проверять нас.
Дополнительные программы помощи
Узнайте больше о программах помощи пациента>
Организации пациентов
Узнайте больше об организации пациентов и членстве>
IAMRARE
® Реестр пациентов Powered By Nord, Платформа IAMRARE . 0044 ведет к революционным изменениям в изучении редких заболеваний. При участии врачей, исследователей и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США компания NORD создала IAMRARE для содействия исследованиям естествознания с привлечением пациентов для разработки исследований и методов лечения редких заболеваний. Конечная цель IAMRARE — объединить пациентов и исследовательские сообщества для улучшения ухода и разработки лекарств.
0044 ведет к революционным изменениям в изучении редких заболеваний. При участии врачей, исследователей и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США компания NORD создала IAMRARE для содействия исследованиям естествознания с привлечением пациентов для разработки исследований и методов лечения редких заболеваний. Конечная цель IAMRARE — объединить пациентов и исследовательские сообщества для улучшения ухода и разработки лекарств.
Узнать больше >
Жизнь с HIBM [Генетические заболевания, Ближний Восток, HIBM, миопатия GNE, миопатия Нонака, DMRV, болезнь мышц, дистрофия, инвалидность]
Содержание
Жизнь с HIBM
Что такое HIBM?
Что делает HIBM?
Как это влияет на меня?
Есть ли лечение?
Есть ли надежда на скорое лечение?
Где я могу получить дополнительную информацию?
Что такое HIBM?
HIBM (наследственные миопатии с тельцами-включениями) представляют собой группу генетических нарушений, которые редко встречаются среди населения мира в целом.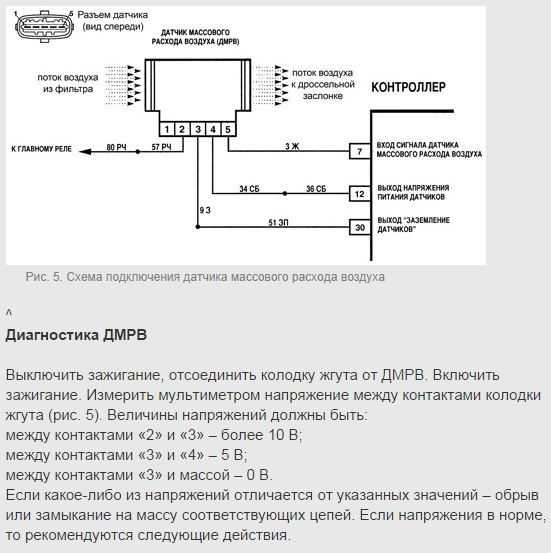 HIBM вызывает прогрессирующую атрофию мышц и слабость, которые могут привести к тяжелой инвалидности. Аутосомно-рецессивная форма миопатии GNE (IBM2 или DMRV миопатия Нонака) чаще встречается у людей ближневосточного, еврейского или японского происхождения, но пациентов можно найти в любом сообществе. HIBM был выявлен у других меньшинств по всему миру. Выявлены пациенты азиатского (японского, корейского, китайского и др.), европейского и южноамериканского происхождения, а также пациенты-мусульмане ближневосточного, палестинского и иранского происхождения. В Японии и многих странах Восточной Азии это заболевание известно как дистальная миопатия с ободковыми вакуолями (DMRV).
HIBM вызывает прогрессирующую атрофию мышц и слабость, которые могут привести к тяжелой инвалидности. Аутосомно-рецессивная форма миопатии GNE (IBM2 или DMRV миопатия Нонака) чаще встречается у людей ближневосточного, еврейского или японского происхождения, но пациентов можно найти в любом сообществе. HIBM был выявлен у других меньшинств по всему миру. Выявлены пациенты азиатского (японского, корейского, китайского и др.), европейского и южноамериканского происхождения, а также пациенты-мусульмане ближневосточного, палестинского и иранского происхождения. В Японии и многих странах Восточной Азии это заболевание известно как дистальная миопатия с ободковыми вакуолями (DMRV).
Что делает HIBM?
HIBM вызывает прогрессирующую мышечную слабость и истощение. Мышечная атрофия обычно начинается в возрасте 20-30 лет, хотя мы наблюдали ее начало в молодом возрасте в 17 лет и в старости в 52 года. Таким образом, это влияет на наиболее продуктивные периоды жизни человека. Это может привести к тяжелой инвалидности в течение 10-15 лет, приковав многих больных к инвалидному креслу. Слабость и тяжесть могут варьироваться от человека к человеку. У некоторых сначала замечается слабость в ногах. У немногих других руки слабеют быстрее, чем ноги. Слабость прогрессирует, что означает, что мышцы со временем становятся слабее. HIBM, по-видимому, не влияет на мозг, внутренние органы или ощущения. Квадрицепсы относительно сохранны и остаются сильными до поздних стадий заболевания, поэтому HIBM часто называют миопатией, сохраняющей четырехглавую мышцу (QSM).
Слабость и тяжесть могут варьироваться от человека к человеку. У некоторых сначала замечается слабость в ногах. У немногих других руки слабеют быстрее, чем ноги. Слабость прогрессирует, что означает, что мышцы со временем становятся слабее. HIBM, по-видимому, не влияет на мозг, внутренние органы или ощущения. Квадрицепсы относительно сохранны и остаются сильными до поздних стадий заболевания, поэтому HIBM часто называют миопатией, сохраняющей четырехглавую мышцу (QSM).
Некоторые ранние признаки HIBM включают в себя:
Трудности при ходьбе на каблуках и трудности при беге;
Слабый указательный палец;
Частая потеря равновесия.
Как это влияет на меня?
Поскольку заболевание является рецессивным (оба аллеля гена повреждены), им может заболеть любой человек, даже со здоровыми родителями и родительскими семьями. HIBM чаще встречается у людей ближневосточного, еврейского или японского происхождения, но больных можно найти в любом сообществе. Мы предлагаем генетическое тестирование для тех, кто подозревает заболевание или имеет более высокий риск заболевания.
Мы предлагаем генетическое тестирование для тех, кто подозревает заболевание или имеет более высокий риск заболевания.
Есть ли лечение?
В настоящее время не существует эффективных методов лечения HIBM. Исследователи из Хадассы, USC, UCLA, UCSD, Университета Джона Хопкинса, Канады, NIH и Японии вносят свой вклад в поиск эффективного лечения. Вы также можете посмотреть книгу «Разработка Рекса», в которой описывается, как ученые разрабатывают лечение болезни. При надлежащей финансовой поддержке и осведомленности мы можем значительно ускорить исследования.
Есть ли надежда на скорое лечение?
Да. Основываясь на предварительных научных данных, мы считаем, что разработать вмешательство для HIBM легче, чем для многих распространенных миопатических состояний. Это связано с тем, что HIBM связан с мутациями фермента, который экспрессируется на низких уровнях в скелетных мышцах, но многие другие распространенные состояния истощения мышц вызваны мутациями клеточных структурных белков, которые экспрессируются на очень высоких уровнях в мышцах.
Современные теории лечения вращаются вокруг следующих основных концепций:
1. Терапия на основе субстрата/продукта: Эти теории предполагают введение небольших молекул, которые увеличивают внутримышечные пулы соединения, известного как сиаловая кислота. Это может включать введение соединений, богатых сиаловой кислотой (например, ВВИГ — внутривенные иммунные глобулины), предшественников сиаловой кислоты или других производных. В настоящее время этот метод, скорее всего, достигнет клинических испытаний в кратчайшие сроки.
2.Генная или основанная на генах терапия: Эти теории включают введение нормальных или гиперактивных форм фермента GNE/MNK (фермента, который мутирует при HIBM).
3. Клеточная терапия: Эти теории предполагают использование специализированных стволовых клеток, способных регенерировать мышцы и экспрессировать нормальную или гиперактивную форму GNE/MNK.
Не исключено, что методы лечения, основанные на вышеуказанных концепциях, которые не доказали свою эффективность при других нарушениях атрофии мышц, могут оказаться полезными при HIBM.
Для HIBM речь идет не о НАЙТИ лекарство, а о ФИНАНСИРОВАНИИ лечения. При дополнительном финансировании и осведомленности мы можем значительно ускорить исследование. ARM предлагает научные гранты исследовательским центрам, которые заинтересованы в разработке лечения HIBM.
Вы можете найти много информации здесь, на нашем сайте. Если вы хотите поговорить с врачом о HIBM, вы можете позвонить по телефону (818) 789-1044.
Это расстройство было впервые названо «Вакуолярная миопатия, щадящая четырехглавую мышцу» Садехом и др. в статье, опубликованной в медицинском журнале Brain, 1993 (116: страницы 217-232). Вы можете получить копию этого документа в любой медицинской библиотеке.
Если вы страдаете другим заболеванием, например, рассеянным склерозом (РС), мы рекомендуем базу данных национальной организации редких заболеваний для организации, занимающейся вашим заболеванием. Если вы страдаете более распространенным заболеванием, таким как рассеянный склероз, вероятно, есть несколько организаций, которые могут предложить помощь и финансирование исследований.

 Необходимо осмотреть и протестировать электропроводку на предмет повреждений.
Необходимо осмотреть и протестировать электропроводку на предмет повреждений.



 2 Альтернативный способ проверки
2 Альтернативный способ проверки
 Если при пуске двигателя питание не замыкается, то проблема в ДМВР.
Если при пуске двигателя питание не замыкается, то проблема в ДМВР.