ГАЗ-66, СССР | Энциклопедия оружия
- размер шрифта уменьшить размер шрифта увеличить размер шрифта
Оцените материал
- 1
- 2
- 3
- 4
- 5
(3 голосов)
Армейский грузовик ГАЗ-66
Описание
Автомобиль ГАЗ-66 был призван заменить в классе грузоподъемности до 2 тонн грузовик ГАЗ-63.
Новый автомобиль оснащался восьмицилиндровым карбюраторным двигателем жидкостного охлаждения. Все колеса машины — односкатные ведущие. Размер шин 12,00-18″. Трансмиссия — восьмиступенчатая без межосевого дифференциала. Диапазон передаточных чисел трансмиссии -14,7. Главная передача — гипоидная. Установлены самоблокирующиеся кулачковые межколесные дифференциалы.
В состав оборудования машины входили также гидроусилитель руля, гидровакуумный усилитель в приводе тормозов, омыватель лобового стекла. Новый автомобиль имел кабину, расположенную над двигателем и отличался пониженным центром тяжести, что придавало машине повышенную устойчивость, особенно при прохождении поворотов.
Новый автомобиль имел кабину, расположенную над двигателем и отличался пониженным центром тяжести, что придавало машине повышенную устойчивость, особенно при прохождении поворотов.
Серийное производство автомобиля началось в 1964 году. Первыми модификациями машины были ГАЗ-66-01 — бортовой автомобиль без лебедки и ГАЗ-66-02 — модификация с лебедкой.
С 1968 года все модификации машины стали оснащаться системой централизованного регулирования давления воздуха в шинах. В процессе серийного производства автомобиль неоднократно модернизировался, в результате чего появились модификации ГАЗ-66-11, ГАЗ-66-40.
Все варианты грузовика использовались в Вооруженных Силах под армейским обозначением ГАЗ-66.
В 1998 году Горьковский автозавод прекратил крупносерийное производство машины и перешел к выпуску ее малыми партиями, которые продолжали поступать в войска. 1 июля 1999 года после ровно 35 лет серийного выпуска производство автомобиля ГАЗ-66 было прекращено.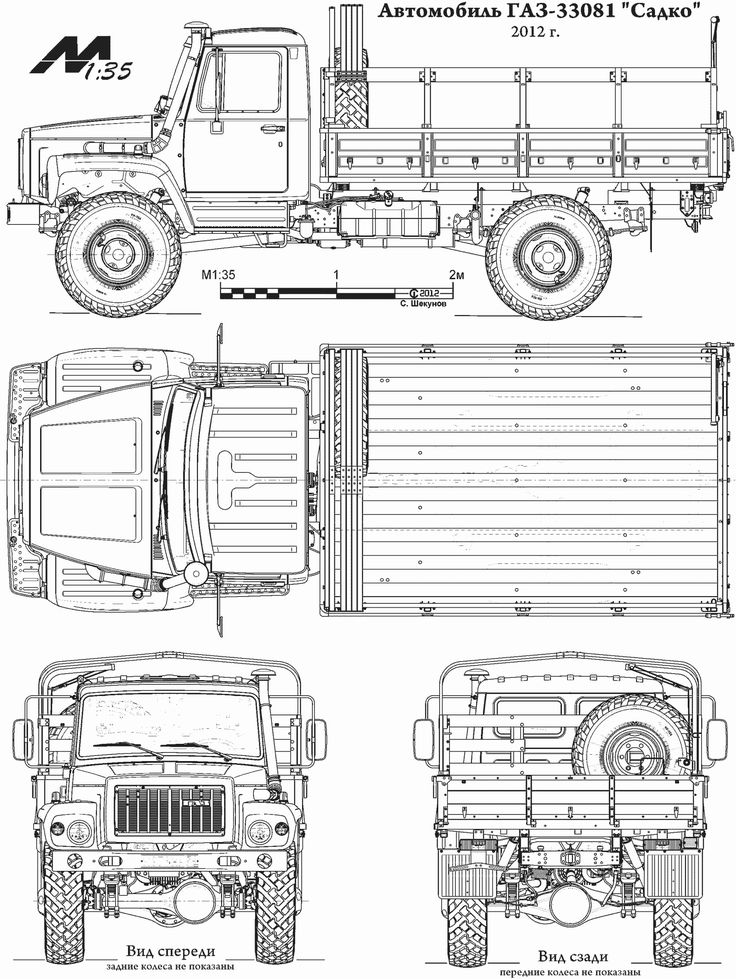 За эти годы был произведен 965941 (!) экземпляр машины.
За эти годы был произведен 965941 (!) экземпляр машины.
Автомобили последних серий выпуска имели универсальную грузовую платформу новой конструкции, унифицированную с коммерческим автомобилем ГАЗ-3309. ГАЗ-66 широко применялся в Советской Армии и в значительных количествах поставлялся за рубеж.
На базе ГАЗ-66 создано значительное число армейских транспортных и специальных автомобилей различного целевого назначения. Особое место среди модификаций грузовика занимает ГАЗ-66Б — автомобиль в специальном исполнении для Воздушно — десантных Войск. Эта машина имеет складную кабину с брезентовым верхом. Рамка ветрового стекла и боковины дверей — съемные. Автомобиль аэротранспортабелен, приспособлен для парашютного десантирования и оснащен всеми необходимыми швартовочными и крепежными приспособлениями. На базе ГАЗ-66Б также выпускалось большое количество различных спецавтомобилей, в том числе установка залпового огня БМ-21В. Для монтажа на шасси ГАЗ-66Б изготавливались спецкузова с малым габаритом по высоте. В 1966-67 годах на базе ГАЗ-66 были созданы опытные машины ГАЗ-34 грузоподъемностью 3 тонны с колесной формулой 6×6 и ГАЗ-33 грузоподъемностью до 7 тонн (колесная формула 6×4). Эти автомобили не пошли в серию, так как ко времени их создания уже началось производство близкого по характеристикам ЗиЛ-131, кроме того, продолжалось производство грузовика ЗиЛ-157, и запускать в серию еще один подобный автомобиль было сочтено нецелесообразным.
В 1966-67 годах на базе ГАЗ-66 были созданы опытные машины ГАЗ-34 грузоподъемностью 3 тонны с колесной формулой 6×6 и ГАЗ-33 грузоподъемностью до 7 тонн (колесная формула 6×4). Эти автомобили не пошли в серию, так как ко времени их создания уже началось производство близкого по характеристикам ЗиЛ-131, кроме того, продолжалось производство грузовика ЗиЛ-157, и запускать в серию еще один подобный автомобиль было сочтено нецелесообразным.
ТТХ
|
ТАКТИКО-ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ | |
| Колесаня формула | 4х4 |
| Грузоподъемность | 2000 кг |
| Габариты | 5655х2322х2440 мм |
| Колесная база | 3,3 м |
| Колея передняя/задняя | 1800/1750 мм |
| Двигатель | карбюраторный, жидкостного охлаждения |
| Число цилиндров | 8 |
| Рабочий объем двигателя | 4,254 л |
| Номинальная мощность | 115 л. |
| Максимальная скорость | 95 км/ч |
| Запас хода | 875 км |
{jlvkcomments}
- ВКонтакте
- Comments (0)
Добавить комментарий
Другие материалы в этой категории: « Универсальный многоцелевой тягач БТС-5Б, Украина ГАЗ-33097 «Садко», Российская Федерация »
Наверх
Газ-66
История
Первые опытные образцы ГАЗ-66 были созданы в 1957 году, но из-за отсутствия серийного двигателя необходимой мощности производство ГАЗ-66 было развёрнуто только с июля 1964 года. В период 1958—1962 г. в малых количествах производился 1,2-тонный грузовик ГАЗ-62, с кабиной заимствованной от ГАЗ-66. В июле 1967 г. на всех автомобилях изменилась облицовка передка кабины (без горизонтальных прорезей). В 1968 году все грузовики получили централизованную систему регулирования давления в шинах (ГАЗ-66-01 и модификации), ранее с указанной системой производились не все автомобили (ГАЗ-66, ГАЗ-66Э, ГАЗ-66-03).
ГАЗ-66 был принят на вооружение в ВС СССР, использовался в народном хозяйстве, после распада СССР большое количество ГАЗ-66 стали использовать в ВС России, в основном в ВДВ и Пограничных войсках.
В 1995 году массовое производство ГАЗ-66-11 с модификациями было прекращено. Взамен Горьковский автозавод освоил выпуск модели ГАЗ-3308 «Садко», унифицированной с ГАЗ-3307. Последний экземпляр ГАЗ-66-11 сошёл с конвейера 1 июля 1999 года.
ГАЗ-САЗ-3531, самосвал для сельского хозяйства
Технические характеристики автомобиля ГАЗ-66
| Тип | Двухосный грузовой автомобиль |
| Грузоподъёмность | 2000 кг |
| Разрешенная максимальная масса | 5940 кг |
| Длина | 5806 мм (с лебёдкой) |
| Ширина | 2322 мм |
| Высота по тенту без нагрузки | 2520 мм |
| Высота по кабине с полной массой | 2490 мм |
| Колёсная база | 3300 мм |
| Дорожный просвет | 315 мм |
| Колея передних колёс | 1800 мм |
| Колея задних колёс | 1750 мм |
| Радиус поворота | 9,5 м |
| Глубина преодолеваемого брода(по дну) | 0,8 м |
| Двигатель | ЗМЗ-66-06 восьмицилиндровый четырёхтактный,с жидкостным охлаждением |
| Рабочий объём | 4254 см3 |
| Мощность | 120 л. с. с. |
| КПП | механическая 4-ступенчатая с синхронизаторамина 3-й и 4-й передачах |
| Раздаточная коробка | С понижающей передачейи отключаемым передним мостом |
| Привод | задний или полный |
| Колёса | специальные с разъёмным ободоми бортовым кольцом 8,00-18; шины 12,00-18 |
| Давление в шинах | 0,5-3 кг/см2 |
| Максимальная скоростьс полной массой | 90 км/ч |
| Ёмкость топливных баков | 210 л |
| Контрольный расход топлива, л/100 кмпри скорости 60 км/ч | 20 |
| Марка топлива | бензин А-72, A-76, АИ-80 |
| Ёмкость АКБ | 75 А·ч |
| Максимальный ток автомобильного генератора | 85 А |
Описание
Своей высокой проходимостью автомобиль обязан самоблокирующимся дифференциалам переднего и заднего мостов и шинам с регулируемым давлением
Передний ведущий мост, виден гидравлический цилиндр усилителя рулевого управления.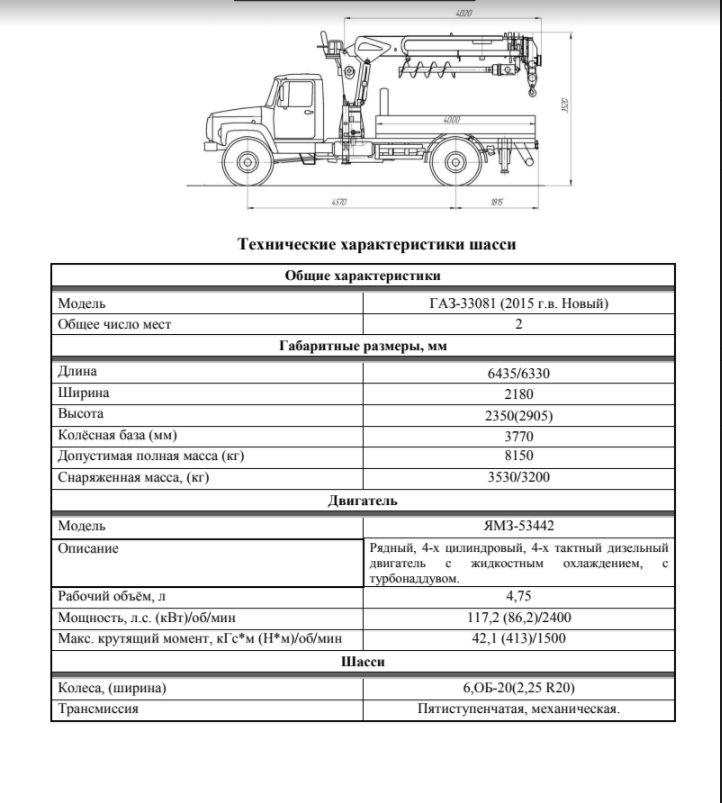 Концы рессор закреплены между резиновыми «подушками»
Концы рессор закреплены между резиновыми «подушками»
Задний ведущий мост, крестовины карданного вала защищены металлическими чехлами. Виден вакуумный усилитель гидравлического привода тормозов.
ГАЗ-66 представляет собой грузовой автомобиль повышенной проходимости грузоподъёмностью 2 тонны, предназначенный для движения в сложных дорожных условиях и по бездорожью. Высокая проходимость обусловлена использованием кулачковых дифференциалов переднего и заднего мостов, больши́м дорожным просветом и регулируемым давлением в шинах (колёсные диски имеют особую конструкцию), для подкачки шин установлен компрессор с приводом от двигателя. Двигатель автомобиля снабжён предпусковым подогревателем ПЖБ-12. Рабочая тормозная система — гидравлическая раздельная с вакуумным усилителем, стояночная — барабанный трансмиссионный тормоз. Гидравлический усилитель рулевого управления.
Важная особенность этого автомобиля — сбалансированное расположение центра тяжести, практически равная нагрузка на переднюю и заднюю ось и компактность за счёт кабины над двигателем, благодаря чему автомобиль широко использовался в десантных войсках, так как приземляется сразу на все колёса и спускается без завала кабины. Однако ограниченный внутренний объём кабины и её расположение непосредственно над колёсами оказались опасны для экипажа в случае подрыва на мине, поэтому ГАЗ-66, начиная с 1980-х, выводился из состава боевых частей в Афганистане. В 1990-х ГАЗ-66 массово списывался из строевых частей, позже его заменил капотный грузовик ГАЗ-3308 «Садко» с аналогичной ходовой частью, но большей длиной.
Однако ограниченный внутренний объём кабины и её расположение непосредственно над колёсами оказались опасны для экипажа в случае подрыва на мине, поэтому ГАЗ-66, начиная с 1980-х, выводился из состава боевых частей в Афганистане. В 1990-х ГАЗ-66 массово списывался из строевых частей, позже его заменил капотный грузовик ГАЗ-3308 «Садко» с аналогичной ходовой частью, но большей длиной.
Для осмотра двигателя кабина откидывается на шарнирах вперёд, между сиденьем водителя и сиденьем пассажира расположен несъёмный кожух, прикрывающий двигатель, из-за этого изогнутый рычаг коробки переключения передач расположен справа-сзади от водителя, что вызывает некоторые неудобства при переключении передач.
Для отдыха водителя ГАЗ-66 комплектовался съёмной подвесной брезентовой койкой, по существу гамаком, который подвешивался на четырёх крючках в кабине.
Передняя и задняя подвеска — на продольных полуэллиптических рессорах с гидравлическими телескопическими амортизаторами двухстороннего действия, ГАЗ-66 отличался плавностью хода.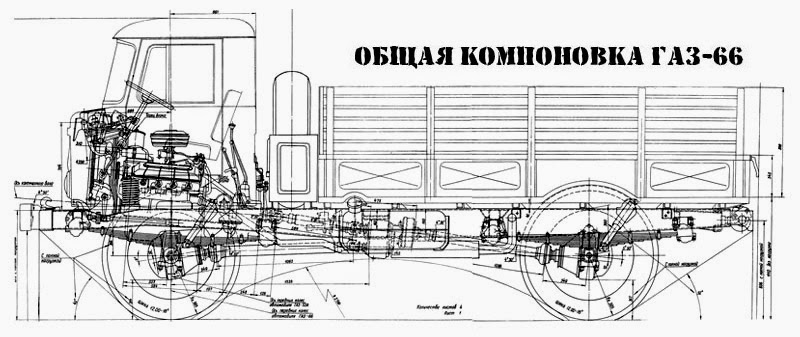
В игровой и сувенирной индустрии
- Модели в масштабе 1:43 выпускались в 1993-94 годах Екатеринбургской фирмой «Русская миниатюра». Имели очень высокую детализацию.
- Похожая модель выпускалась на Саратовском заводе «Моссар» (бывший «Агат»).
- Китайской фирмой «Технопарк» выпускаются модели:
- ГАЗ-66 и
- ГАЗ-34 в разных расцветках:
- «с тентом»,
- «с ракетной установкой» и
- «автокран».
- Также в 2012 году была выпущена партия бортовых ГАЗ-66 фирмой StartScaleModels тиражом 3000 штук.
- Выпускается пластиковая модель фирмой «Восточный Экспресс» в масштабе 1/35 в разных вариантах:
- радиоуправляемое авто,
- с зениткой ЗУ-23-2,
- с тентом
- и другие.
Представлен в игре SpinTires как «Модель-B-66». Обладает заниженной, по сравнению с реальной, проходимостью и крайне ограниченным функционалом (кунг, тележка и запасное колесо)
- Автор: Владимир
- Распечатать
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Лучшие цены на газ и местные заправочные станции в Техасе
GasBuddy поддерживает Украину. Нажмите здесь, чтобы сделать пожертвование United Way.
Нажмите здесь, чтобы сделать пожертвование United Way.
Цены на газ
Texas
- Обычные цены на топливо
- Цены на топливо
- Премиальные цены
- ЦЕНЫ Diesele Fuel 181818018 гг.
Show Map
Abilene
Alice
Amarillo
Andrews
Athens
Austin
Bay City
Beaumont
Beeville
Big Spring
Bonham
Borger
Brenham
Brownsville
Brownwood
Колледж-Стейшн
Корпус-Кристи
Корсикана
Даллас
Дель-Рио
Дюма
Игл Пасс
El Campo
El Paso
Fredericksburg
Gainesville
Hereford
Houston
Huntsville
Jacksonville
Kerrville
Killeen
Kingsville
Lamesa
Laredo
Levelland
Longview
Lubbock
Lufkin
Marshall
McAllen
Midland
Mineral Wells
Mount Pleasant
Nacogdoches
Odessa
Palestine
Pampa
Paris
Pecos
Plainview
Raymondville
Rio Grande City
San Angelo
San Antonio
Sherman
Snyder
Stephenville
Sulphur Springs
Суитуотер
Тексаркана
Тайлер
Увальде
Вернон
Виктория
Вако
Wichita Falls
округа Андерсон
округ Эндрюс
округ Анджелина
округ Арансас
округ Арчер
Округ Армстронг
Округ Атскоса. Округ
Округ
Округ Би
Округ Белл
Округ Бексар
Округ Бланко
Округ Боске
Округ Боуи
Каунти Бразория
Графство Бразос
округ Брюстер
Округ Бриско. Округ Кэмп
Округ Карсон
Округ Касс
Округ Кастро
Округ Чемберс
Округ Чероки
Childress County
Clay County
Cochran County
Coke County
Coleman County
Collin County
Collingsworth County
Colorado County
Comal County
Comanche County
Concho County
Cooke County
Coryell Округ
Округ Коттл
Округ Крейн
Округ Крокетт
Округ Кросби
Округ Калберсон
Dallam County
Dallas County
Dawson County
DeWitt County
Deaf Smith County
Delta County
Denton County
Dickens County
Dimmit County
Donley County
Duval County
Eastland County
Округ Эктор
Округ Эдвардс
Округ Эль-Пасо
Округ Эллис
Округ Эрат
Округ Фолс
Округ Фаннин
Fayette County
Fisher County
Floyd County
Foard County
Fort Bend County
Franklin County
Freestone County
Frio County
Gaines County
Galveston County
Garza County
Gillespie County
Округ Гласскок
Округ Голиад
Округ Гонсалес
Округ Грей
Округ Грейсон
Округ Грегг
Граус графство Граймс
Гуадалупе округ
Хейл Каунти
Округ Холл
Округ Гамильтон
Округ Хансфорд
Округ Хардман
графство Хардин
Hardels
Hardle Hardle. Округ
ОкругОкруг Хемфилл
Округ Хендерсон
Округ Идальго
Округ Хилл
Округ Хокли
Округ Худ
Hopkins County
Houston County
Howard County
Hudspeth County
Hunt County
Hutchinson County
Irion County
Jack County
Jackson County
Jasper County
Jeff Davis County
Jefferson County
Округ Джим Хогг
Округ Джим Уэллс
Округ Джонсон
Округ Джонс
Округ Карнс
Округ Кауфман
Kendall County
Kent County
Kerr County
Kimble County
Kinney County
Kleberg County
Knox County
La Salle County
Lamar County
Lamb County
Lampasas County
Lavaca County
Lee County
Leon County
Liberty County
Limestone County
Lipscomb County
Live Oak County
Llano County
Lubbock County
Lynn County
Madison County
Marion County
Martin County
Mason County
Matagorda County
Maverick County
McCulloch County
McLennan County
McMullen County
Medina County
Menard County
Midland County
Milam County
Mills County
Mitchell County
Montague County
округа Монтгомери
округ Мур
округ Моррис
округ Море
округ Nacogdoches
Округ Наварро. Округ Пинто
Округ Пинто
Округ Панола
Округ Паркер
Округ Пармер
Округ Пекос
Округ Полк
Округ Поттер
Округ Президио.
Округ Раск
Округ Сабин
Округ Сан-Огастин
Округ Сан-Хасинто
Округ Сан-Патрисио
Округ Сан-Саба
Округ Шлейхер
Округ SCURRY
Shackelford County
Округ Шелби
Округ Шерман
Округ Смит
Округ Сомервелл
СТАРС
Округ
County. Swisher County
Tarrant County
Taylor County
Terrell County
Terry County
Throckmorton County
Округ Титус
Том Грин округ
округ Трэвис
Тринити Каунти
Округ Тайлер
Округ Апшур
Округ Аптон
Округ UVALDE
Округ
Ван Зандт. Округ
Округ Уоллер
Округ Уорд
Округ Вашингтон
Округ Уэбб
Округ Уортон
Округ Уилер
округ Вичита
округ Уилбаргер
округ Уилласи
графство Уильямсон
Округ Уилсон
округ Уинклер
округ
Zapata
Якум.
Аляска
Аризона
Арканзас
Калифорния
Колорадо
Коннектикут
Делавэр
Florida
Georgia
Hawaii
Idaho
Illinois
Indiana
Iowa
Kansas
Kentucky
Louisiana
Maine
Maryland
Massachusetts
Michigan
Minnesota
Mississippi
Missouri
Монтана
Небраска
Невада
Нью-Гемпшир
Нью-Джерси
Нью-Мексико
New York
North Carolina
North Dakota
Ohio
Oklahoma
Oregon
Pennsylvania
Puerto Rico
Rhode Island
South Carolina
South Dakota
Tennessee
Texas
Utah
Вермонт
Вирджиния
Вашингтон
Вашингтон округ Колумбия
Западная Вирджиния
Висконсин
Вайоминг
ДомЦены на газ
Техас
Тетродотоксин-продуцирующий штамм вибриона, LM-1, из рыбы-фугу Fugu vermicularis radiatus
Appl Environ Microbiol. 2000 апрель; 66 (4): 1698–1701.
2000 апрель; 66 (4): 1698–1701.
doi: 10.1128/aem.66.4.1698-1701.2000
, 1, 2, † , 2, † , 2, † , 2, ‡ , 1, * , 1 , 3 , 2, § , 4 и 2
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности -слойная хроматография, электрофорез, высокоэффективная жидкостная хроматография и газовая хроматография-масс-спектрометрия, а также биоанализ на токсичность на мышах. Было продемонстрировано, что выделенная бактерия продуцировала ТТХ, 4-эпи-ТТХ и анчТТХ во время культивирования, что свидетельствует о том, что 9Штаммы 0820 Vibrio ответственны за токсичность рыбы фугу.
Тетродотоксин (ТТХ) является сильным нейротоксином и также известен как возбудитель отравления рыбой фугу. Более того, не все виды иглобрюхов токсичны, а некоторые токсичны лишь слабо или умеренно (4). Токсичность видов рыб фугу варьируется в зависимости от тканей или органов, географии, сезона года и пола (3). Самка рыбы фугу более ядовита, чем самец, поскольку яичники, как правило, гораздо более ядовиты, чем семенники (2). TTX не ограничивается рыбой фугу и широко распространен среди различных видов животных, таких как калифорнийский тритон 9.0820 Tarichi torosa (14), бычок Gobius criniger (19), Atelopus лягушки (9), брюхоногие моллюски Charonia sauliae (18) и Babylonia japonica (23, 32), краб-ксантид Atergatis floridus (25), синекольчатый осьминог Octopus maculosus (28), Astropecten морские звезды (11, 12, 24), панцирь лягушки Tutufa lissostoma (22), малый брюхоногий моллюск 9080 Зевксис синихорский (17) и Niotha clathrata (6). Эти факты указывают на то, что животные, содержащие ТТХ, могли поглощать и накапливать ТТХ и его производные, продуцируемые некоторыми морскими бактериями (10, 13).
Токсичность видов рыб фугу варьируется в зависимости от тканей или органов, географии, сезона года и пола (3). Самка рыбы фугу более ядовита, чем самец, поскольку яичники, как правило, гораздо более ядовиты, чем семенники (2). TTX не ограничивается рыбой фугу и широко распространен среди различных видов животных, таких как калифорнийский тритон 9.0820 Tarichi torosa (14), бычок Gobius criniger (19), Atelopus лягушки (9), брюхоногие моллюски Charonia sauliae (18) и Babylonia japonica (23, 32), краб-ксантид Atergatis floridus (25), синекольчатый осьминог Octopus maculosus (28), Astropecten морские звезды (11, 12, 24), панцирь лягушки Tutufa lissostoma (22), малый брюхоногий моллюск 9080 Зевксис синихорский (17) и Niotha clathrata (6). Эти факты указывают на то, что животные, содержащие ТТХ, могли поглощать и накапливать ТТХ и его производные, продуцируемые некоторыми морскими бактериями (10, 13). Происхождение TTX у морских животных было предметом ряда недавних исследований (16). Недавно был обнаружен вероятный механизм интоксикации животных-носителей ТТХ: Vibrio fischeri , выделенный из ксантидного краба Atergatis floridus и Vibrio alginolyticus , выделенный из рыбы-фугу Fugu vermicularis vermicularis , продуцировал ТТХ и ангидро-ТТХ (анх-ТТХ) (5, 20, 30). Другая бактерия, продуцирующая ТТХ, также была обнаружена в известняковой реалге, Jania sp. Бактерии, продуцирующие ТТХ, были выделены из различных морских организмов, включая морскую звезду Astropecten polyacanthus и синекольчатого осьминога O. maculosus (26, 27). Число бактериальных штаммов, продуцирующих токсин, увеличивается, и большинство штаммов идентифицировано как представители рода 9.0820 Вибрио (21). Кроме того, Simidu et al. (29) продемонстрировали, что многие виды морских бактерий, в том числе Vibrio spp. (21), Pseudomonas spp.
Происхождение TTX у морских животных было предметом ряда недавних исследований (16). Недавно был обнаружен вероятный механизм интоксикации животных-носителей ТТХ: Vibrio fischeri , выделенный из ксантидного краба Atergatis floridus и Vibrio alginolyticus , выделенный из рыбы-фугу Fugu vermicularis vermicularis , продуцировал ТТХ и ангидро-ТТХ (анх-ТТХ) (5, 20, 30). Другая бактерия, продуцирующая ТТХ, также была обнаружена в известняковой реалге, Jania sp. Бактерии, продуцирующие ТТХ, были выделены из различных морских организмов, включая морскую звезду Astropecten polyacanthus и синекольчатого осьминога O. maculosus (26, 27). Число бактериальных штаммов, продуцирующих токсин, увеличивается, и большинство штаммов идентифицировано как представители рода 9.0820 Вибрио (21). Кроме того, Simidu et al. (29) продемонстрировали, что многие виды морских бактерий, в том числе Vibrio spp. (21), Pseudomonas spp..jpg) (33) и актиномицеты (1) продуцируют ТТХ.
(33) и актиномицеты (1) продуцируют ТТХ.
Три особи иглобрюха F. vermicularis radiatus (самцы; масса тела 45 г) были пойманы в Пусане, Корея, в марте 1998 г., живыми доставлены в лабораторию и содержались в течение ночи при температуре 25°C в оборудованных аквариумах. Каждую рыбу фугу разрезали для тестирования кишечника, печени, кожи, мышц, семенников и желчи в асептических условиях. Когда эти органы были проанализированы на токсичность и бактериальную популяцию, они оказались токсичными. Кишечник использовали для бактериологического исследования.
Для культивирования ТТХ-продуцирующей микрофлоры в содержимом кишечника рыбы иглобрюха бульон ORI, содержащий 0,2% протеозопептона №. Использовали 3 (Difco Laboratories, Детройт, Мичиган), 0,2% фитонопептона (BBL Microbiology Systems, Кокисвилл, Мэриленд), 0,1% дрожжевого экстракта (Difco), 0,088% цитрата железа и 3% NaCl. рН среды доводили до 8,0. В некоторых случаях также использовали бульон с говяжьим экстрактом, содержащий 0,5 % глюкозы, 0,5 % полипептона, 0,5 % говяжьего экстракта и 3 % NaCl (pH 8,0). Для выращивания 9Также использовали штаммы 0820 Vibrio , среды PCA и TCBS. Среда PCA содержала 0,5% триптона Bacto, 0,25% экстракта дрожжей Bacto, 0,1% декстрозы Bacto, 1,5% агара Bacto и 3% NaCl (доведенный до конечного pH 7,0). Среда TCBS содержала 0,5 % дрожжевого экстракта, 0,5 % казеинового пептона, 0,5 % мясного пептона, 1,0 % цитрата натрия, 1,0 % тиосульфата натрия, 0,5 % выделенной бычьей желчи, 0,3 % холата натрия, 2 % сахарозы, 1 % хлорида натрия, 0,1 %. цитрата трехвалентного железа, 0,004% тимолового синего, 0,004% бромтимолового синего и 1,4% бактоагара (доведенный до конечного рН 8,6).
Для выращивания 9Также использовали штаммы 0820 Vibrio , среды PCA и TCBS. Среда PCA содержала 0,5% триптона Bacto, 0,25% экстракта дрожжей Bacto, 0,1% декстрозы Bacto, 1,5% агара Bacto и 3% NaCl (доведенный до конечного pH 7,0). Среда TCBS содержала 0,5 % дрожжевого экстракта, 0,5 % казеинового пептона, 0,5 % мясного пептона, 1,0 % цитрата натрия, 1,0 % тиосульфата натрия, 0,5 % выделенной бычьей желчи, 0,3 % холата натрия, 2 % сахарозы, 1 % хлорида натрия, 0,1 %. цитрата трехвалентного железа, 0,004% тимолового синего, 0,004% бромтимолового синего и 1,4% бактоагара (доведенный до конечного рН 8,6).
Для выявления бактерий, продуцирующих ТТХ, содержимое кишечника помещали в пробирки. Каждый образец взвешивали и серийно разбавляли 3 объемами стерилизованного физиологического раствора. После гомогенизации 1 мл трехкратного разведения наносили на среду РСА, содержащую 3% NaCl, и на среду TCBS и инкубировали при 23°С в течение 1–3 сут. После инкубации бактериальные колонии на каждой среде подсчитывали и делили на типы в соответствии с характеристиками колоний.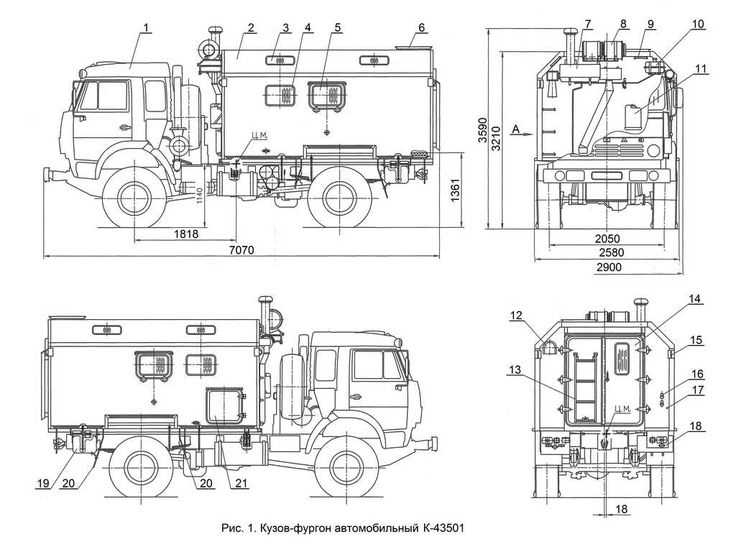 Репрезентативные колонии всех типов собирали случайным образом и очищали путем посева штрихами на поверхность образца среды для выделения одной колонии. Каждую колонию на среде TCBS отбирали и инкубировали при встряхивании в 200 мл среды ORI и экстракта говядины при 23°C в течение 48 часов. Для анализа способности кишечных бактерий фугу продуцировать ТТХ инкубированные клетки собирали центрифугированием при 5000× г за 30 мин (7). Бактериальные клетки использовали для изучения продукции ТТХ. Наконец, три штамма, которые явно демонстрировали продуктивность ТТХ, были отобраны и идентифицированы, как описано Tansill (31).
Репрезентативные колонии всех типов собирали случайным образом и очищали путем посева штрихами на поверхность образца среды для выделения одной колонии. Каждую колонию на среде TCBS отбирали и инкубировали при встряхивании в 200 мл среды ORI и экстракта говядины при 23°C в течение 48 часов. Для анализа способности кишечных бактерий фугу продуцировать ТТХ инкубированные клетки собирали центрифугированием при 5000× г за 30 мин (7). Бактериальные клетки использовали для изучения продукции ТТХ. Наконец, три штамма, которые явно демонстрировали продуктивность ТТХ, были отобраны и идентифицированы, как описано Tansill (31).
Для выделения токсина из бактериальных экстрактов экстракты обезжиривали дихлорметаном и водный слой концентрировали при пониженном давлении для удаления дихлорметана. Суспензию подвергали ультразвуковому разрушению с помощью ультразвукового аппарата в течение 10 мин. Для выделения ТТХ смесь нагревали на кипящей водяной бане, охлаждали до комнатной температуры, фильтровали через мембрану Diaflo YM-2 (Amicon), упаривали в вакууме и сушили вымораживанием. Полученное твердое вещество растворяли в 0,03 М уксусной кислоте и наносили на колонку Bio-Gel P-2 (Bio-Rad Laboratories, Ричмонд, Калифорния) (2×9).4 см), оснащенный насосом постоянного потока (Kyowa Seimitsu Co., Токио, Япония). Токсичные фракции объединяли и лиофилизировали. Полученные фракции ТТХ подвергали анализу на мышах, газовой хроматографии-масс-спектрометрии (ГХ-МС) и высокоэффективной жидкостной хроматографии (ВЭЖХ) для обнаружения и идентификации ТТХ (8).
Полученное твердое вещество растворяли в 0,03 М уксусной кислоте и наносили на колонку Bio-Gel P-2 (Bio-Rad Laboratories, Ричмонд, Калифорния) (2×9).4 см), оснащенный насосом постоянного потока (Kyowa Seimitsu Co., Токио, Япония). Токсичные фракции объединяли и лиофилизировали. Полученные фракции ТТХ подвергали анализу на мышах, газовой хроматографии-масс-спектрометрии (ГХ-МС) и высокоэффективной жидкостной хроматографии (ВЭЖХ) для обнаружения и идентификации ТТХ (8).
Один миллилитр испытуемого раствора, приготовленного путем обработки ультразвуком и ультрафильтрации культурального бульона, использовали для анализа токсичности. Токсичность оценивали официальным методом ТТХ на мышах (5). Каждой мыши (штамм 3 ddy, самцы, масса тела 18-20 г) вводили внутрибрюшинно 100 мкл тестируемого раствора и регистрировали время до смерти. Введенную дозу рассчитывали по среднему времени смерти и стандартной кривой доза-время смерти и выражали в мышиных единицах (MU), которые определяли как количество ТТХ, убивающее мышь через 30 минут после инъекции.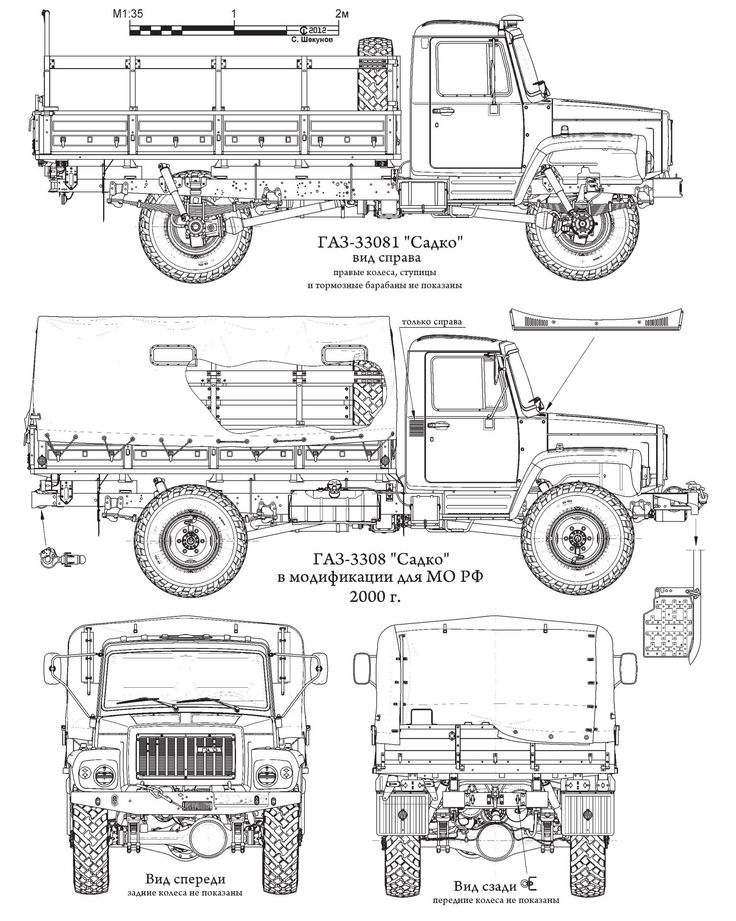
Флуорометрический метод ВЭЖХ, разработанный Nagashima et al. (15), использовали для обнаружения ТТХ и его производных. Аутентичные стандарты для TTX, 4-epi-TTX и anh-TTX были любезно предоставлены K. Hashimoto и T. Noguchi, факультет сельского хозяйства Токийского университета, Токио, Япония. ВЭЖХ с обращенной фазой выполняли на октилдецилсилановой колонке YMC-pack AM-314 (0,6 на 30 см) (15). Вкратце, колонку готовили путем смешивания 0,05 М гептансульфоновой кислоты и метанола в 0,05 М калий-фосфатном буфере (рН 7,0) при скорости потока 1 мл/мин. Элюат смешивали с равным объемом 4 н. NaOH и нагревали в реакционном змеевике при 100°С. Для обнаружения флуоресцентных продуктов длины волн возбуждения и испускания были установлены на 381 и 505 нм соответственно.
Для ГХ-МС аутентичный ТТХ и родственные вещества или частично очищенные токсины из бактериальных клеток и культуральных бульонов были преобразованы в триметилсилил-2-амино-6-гидроксиметил-8-гидроксихиназолин (C 9 -основание).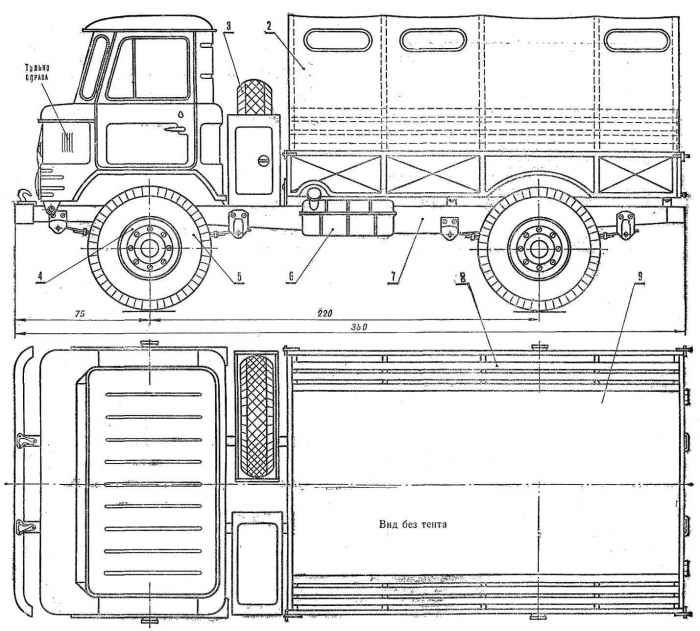 Вкратце, ТТХ или бактериальные токсины гидролизовали в 2 N NaOH в течение 45 мин на кипящей водяной бане. После охлаждения щелочные гидролизаты доводили до рН 4 с помощью 1 н. HCl и дважды экстрагировали 5 мл 1-бутанола. Экстракты объединяли, сушили вымораживанием и триметилсилилировали, как описано Nouguchi et al. (21). Затем полученные производные подвергали ГХ-МС на ГХ-масс-спектрометре Hitachi M-80 для исследования ТМА-С 9.0890 9 — основание, полученное из ТТХ и родственных ему веществ. Использовали колонку Chromosorb W, покрытую 1,5% OV 101, и температуру повышали от 165 до 200°С со скоростью 5°С/мин. Тонкослойную хроматографию (ТСХ) проводили на линейных высокоэффективных пластинах для ТСХ LHP-K размером 5 на 20 см с силикагелем (Whatman) с системой растворителей пиридин-этилацетат-уксусная кислота-вода (15:5:3). :4). Токсины визуализировались в виде розового пятна после опрыскивания планшета реактивом Вебера или в виде желтого флуоресцентного пятна в УФ-свете (365 нм) после опрыскивания планшета 10% КОН и нагревания.
Вкратце, ТТХ или бактериальные токсины гидролизовали в 2 N NaOH в течение 45 мин на кипящей водяной бане. После охлаждения щелочные гидролизаты доводили до рН 4 с помощью 1 н. HCl и дважды экстрагировали 5 мл 1-бутанола. Экстракты объединяли, сушили вымораживанием и триметилсилилировали, как описано Nouguchi et al. (21). Затем полученные производные подвергали ГХ-МС на ГХ-масс-спектрометре Hitachi M-80 для исследования ТМА-С 9.0890 9 — основание, полученное из ТТХ и родственных ему веществ. Использовали колонку Chromosorb W, покрытую 1,5% OV 101, и температуру повышали от 165 до 200°С со скоростью 5°С/мин. Тонкослойную хроматографию (ТСХ) проводили на линейных высокоэффективных пластинах для ТСХ LHP-K размером 5 на 20 см с силикагелем (Whatman) с системой растворителей пиридин-этилацетат-уксусная кислота-вода (15:5:3). :4). Токсины визуализировались в виде розового пятна после опрыскивания планшета реактивом Вебера или в виде желтого флуоресцентного пятна в УФ-свете (365 нм) после опрыскивания планшета 10% КОН и нагревания.
Электрофорез проводили на полосках из ацетата целлюлозы размером 5 на 18 см (Хеметрон) в 0,08 М Трис-HCl-буфере (рН 8,7) при 0,8 мА/см в течение 30 мин. Аутентичный ТТХ, приготовленный из печени рыбы-фугу, использовали в качестве стандарта сравнения. Токсины визуализировали тем же методом, что и для ТСХ.
Токсичность рыбы-фугу была проанализирована, чтобы показать наличие кишечных бактерий у рыбы-фугу как нового продуцента ТТХ, а также механизм токсичности образца. Три F. vermicularis radiatus 9Рыба-фугу 0821 была умеренно токсичной, с летальностью 70 ± 8 МЕ/г печени и 45 ± 3 МЕ/г кожи.
Все три доминирующих штамма Vibrio были выделены и исследованы на способность продуцировать ТТХ и родственные вещества с помощью ВЭЖХ, ГХ-МС, электрофореза и ТСХ. Только один штамм из трех кандидатов был дополнительно охарактеризован, поскольку было установлено, что он является продуцентом ТТХ с помощью анализа ВЭЖХ. Картина ВЭЖХ фракции ТТХ из этого штамма показана на рис.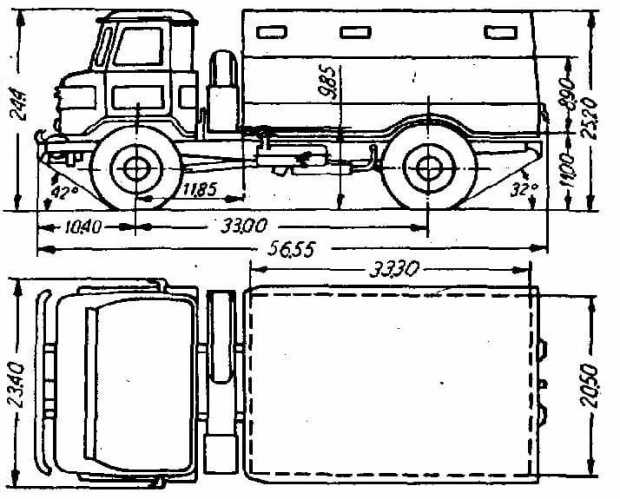 Фракция ТТХ дала несколько пиков в ВЭЖХ, времена удерживания которых (8, 16, 19и 22 мин) соответствовали или были близки к таковым для тетродоевой кислоты (ТДА), ТТХ, 4-эпи-ТТХ и анх-ТТХ соответственно. Триметилсилилированное производное из щелочного гидролизата фракции ТТХ проявляло ионы массовых фрагментов при m / z 407 (исходный пик), 392 (основной пик) и 376, которые характерны для соответствующих производных из аутентичных ТТХ (рис. . ). При использовании системы растворителя пиридин-этилацетат-уксусная кислота-вода (15:5:3:4) опрыскивание пластины 10% КОН выявило три пятна с R f значения 0,4, 0,6 и 0,8 для бактериальных токсинов. После опрыскивания реактивом Вебера пятен больше не появлялось. Токсины, выделенные из инкубированных клеток, хорошо совпадали с токсинами аутентичных ТДА, ТТХ и анч-ТТХ соответственно (рис. 1). Во время электрофореза как бактериальные токсины, так и аутентичные ТТХ четко демонстрировали два пятна при опрыскивании 10% КОН, одно из которых соответствовало ТДА (относительное расстояние миграции [ R м ]), а другие соответствовали анх-ТТХ и ТТХ (9).
Фракция ТТХ дала несколько пиков в ВЭЖХ, времена удерживания которых (8, 16, 19и 22 мин) соответствовали или были близки к таковым для тетродоевой кислоты (ТДА), ТТХ, 4-эпи-ТТХ и анх-ТТХ соответственно. Триметилсилилированное производное из щелочного гидролизата фракции ТТХ проявляло ионы массовых фрагментов при m / z 407 (исходный пик), 392 (основной пик) и 376, которые характерны для соответствующих производных из аутентичных ТТХ (рис. . ). При использовании системы растворителя пиридин-этилацетат-уксусная кислота-вода (15:5:3:4) опрыскивание пластины 10% КОН выявило три пятна с R f значения 0,4, 0,6 и 0,8 для бактериальных токсинов. После опрыскивания реактивом Вебера пятен больше не появлялось. Токсины, выделенные из инкубированных клеток, хорошо совпадали с токсинами аутентичных ТДА, ТТХ и анч-ТТХ соответственно (рис. 1). Во время электрофореза как бактериальные токсины, так и аутентичные ТТХ четко демонстрировали два пятна при опрыскивании 10% КОН, одно из которых соответствовало ТДА (относительное расстояние миграции [ R м ]), а другие соответствовали анх-ТТХ и ТТХ (9).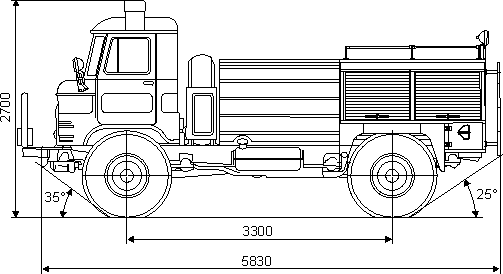 0820 R m , 0,5 и 0,7 соответственно) (рис. ). Было известно, что штаммы семейства Vibrionaceae проявляли способность продуцировать безводную форму ТТХ. Напротив, Escherichia coli , типичная наземная бактерия, не продуцирует ТТХ (14). Также было известно, что анх-ТТХ лишь слегка токсичен, но легко превращается в ТТХ в растворе, особенно при более низких значениях рН. ТТХ также переходит в безводную форму в растворе (33). Хотя роль ТТХ в самих бактериях до сих пор неясна, предполагалось, что ТТХ регулируют перенос ионов натрия через биологические мембраны (26), и этот факт может иметь некоторое отношение к функции токсина в клетках морских бактерий.
0820 R m , 0,5 и 0,7 соответственно) (рис. ). Было известно, что штаммы семейства Vibrionaceae проявляли способность продуцировать безводную форму ТТХ. Напротив, Escherichia coli , типичная наземная бактерия, не продуцирует ТТХ (14). Также было известно, что анх-ТТХ лишь слегка токсичен, но легко превращается в ТТХ в растворе, особенно при более низких значениях рН. ТТХ также переходит в безводную форму в растворе (33). Хотя роль ТТХ в самих бактериях до сих пор неясна, предполагалось, что ТТХ регулируют перенос ионов натрия через биологические мембраны (26), и этот факт может иметь некоторое отношение к функции токсина в клетках морских бактерий.
Открыть в отдельном окне
ВЭЖХ-картина фракции ТТХ из штамма Vibrio , выделенного из кишечника иглобрюха F. vermicularis radiatus (вверху), вместе с аутентичными ТТХ (внизу). А, ТДА; Б, ТТХ; С, 4-эпи-ТТХ; Д,анх-ТТХ.
Открыть в отдельном окне.0820 F. vermicularis radiatus Кишечник рыбы-фугу (внизу).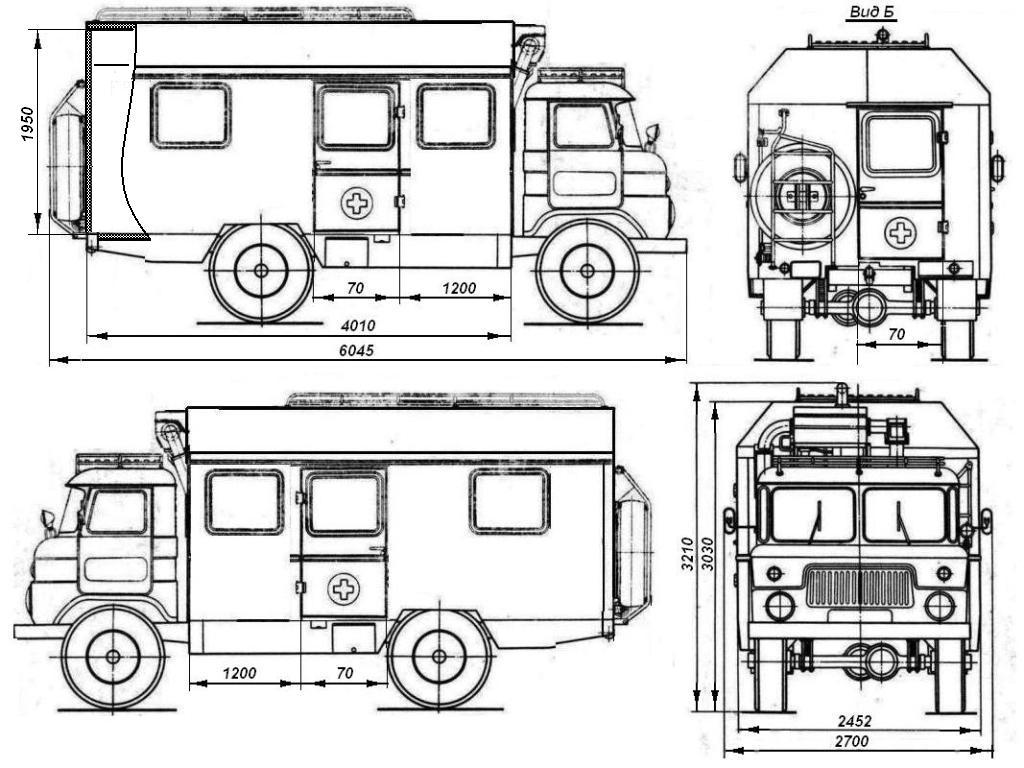
Открыть в отдельном окне
Электрофорез фракции ТТХ штамма Vibrio (LM-1), выделенного из кишечника F. vermicularis radiatus , вместе с аутентичными ТТХ (ЗППП). Электрофорез проводили на полоске из ацетата целлюлозы (Хеметрон) в 0,08 М трис-HCl-буфере (рН 8,7) при 0,8 мА/см в течение 30 мин. После проявления образцы нагревали в течение 10 мин и визуализировали в УФ-свете (365 нм). А, ТДА; Б, ан-ТТХ; С, ТТХ.
Открыть в отдельном окне
ТСХ фракции ТТХ штамма Vibrio (LM-1), выделенного из кишечника F. vermicularis radiatus , вместе с аутентичными ТТХ (ЗППП). Токсины проявляли на предварительно покрытой пластине с силикагелем Whatman LHP-K с системой растворителей пиридин-этилацетат-уксусная кислота-вода (15:5:3:4). Детектирование было таким же, как и для рис. А, ТДА; Б, ТТХ; С, ан-ТТХ.
Результаты предварительных тестов показали, что количество жизнеспособных бактерий в содержимом кишечника значительно различается в зависимости от индивидуума, но различия в культуральной среде были незначительными.%20%D0%90%D0%B2%D1%82%D0%BE%D0%BC%D0%BE%D0%B1%D0%B8%D0%BB%D1%8C-%D0%BC%D0%B0%D1%81%D0%BB%D0%BE%D0%B7%D0%B0%D0%BF%D1%80%D0%B0%D0%B2%D1%89%D0%B8%D0%BA%20%D0%BD%D0%B0%20%D1%88%D0%B0%D1%81%D1%81%D0%B8%20%D0%93%D0%90%D0%97-66.jpg) Агар для подсчета в чашках с 3% NaCl, 6,4 × 10 5 клеток/г. Всего на агаризованной среде TCBS было выделено три штамма кишечных бактерий. Более того, с использованием процедуры, описанной выше, было обнаружено, что Vibrionaceae являются наиболее доминирующими. Все штаммов Vibrionaceae были идентифицированы как Vibrio sp., и они были разделены на три штамма на основе цвета, внешнего вида поверхности, реакции окрашивания по Граму, ширины, длины, спорообразования и подвижности. На следующем этапе штаммы исследовали на продукцию ТТХ. Среди этих групп ТТХ были обнаружены только у штамма 1 при анализе клеточных экстрактов официальным методом на ТТХ. Другие бактерии штаммов 2 и 3 не были положительными в отношении продукции ТТХ, 4-эпи-ТТХ и анч-ТТХ при анализе с помощью ВЭЖХ (таблица). Ранее Ногучи и соавт. (21) сообщил, что 9Штаммы 0820 Vibrio , выделенные из ксантидного краба Atergatis floridus и морской звезды Astropecten polyacanthus , продуцировали ТТХ при культивировании в условиях, аналогичных тем, которые использовались в этом исследовании.
Агар для подсчета в чашках с 3% NaCl, 6,4 × 10 5 клеток/г. Всего на агаризованной среде TCBS было выделено три штамма кишечных бактерий. Более того, с использованием процедуры, описанной выше, было обнаружено, что Vibrionaceae являются наиболее доминирующими. Все штаммов Vibrionaceae были идентифицированы как Vibrio sp., и они были разделены на три штамма на основе цвета, внешнего вида поверхности, реакции окрашивания по Граму, ширины, длины, спорообразования и подвижности. На следующем этапе штаммы исследовали на продукцию ТТХ. Среди этих групп ТТХ были обнаружены только у штамма 1 при анализе клеточных экстрактов официальным методом на ТТХ. Другие бактерии штаммов 2 и 3 не были положительными в отношении продукции ТТХ, 4-эпи-ТТХ и анч-ТТХ при анализе с помощью ВЭЖХ (таблица). Ранее Ногучи и соавт. (21) сообщил, что 9Штаммы 0820 Vibrio , выделенные из ксантидного краба Atergatis floridus и морской звезды Astropecten polyacanthus , продуцировали ТТХ при культивировании в условиях, аналогичных тем, которые использовались в этом исследовании. Кроме того, несколько бактерий, продуцирующих ТТХ, были выделены из тканей, в основном из кишечника, рыб-фугу, содержащих ТТХ (16).
Кроме того, несколько бактерий, продуцирующих ТТХ, были выделены из тканей, в основном из кишечника, рыб-фугу, содержащих ТТХ (16).
ТАБЛИЦА 1
Анализы на ТТХ и его производные в экстрактах трех штаммов Vibrio , выделенных из кишечника F. vermicularis radiatus puffer fish
| Strain | Toxicity | HPLC result a | ||
|---|---|---|---|---|
| TTX | 4-Epi-TTX | Anh-TTX | ||
| 1 | − | + | + | + |
| 2 | − | ± | + | + |
| 3 | − | + | ± | + |
Открыть в отдельном окне
a +, четко определяется; ± трудно обнаружить.
Бактерия идентифицирована на биохимическом и морфологическом уровнях (таблица). Штамм представлял собой факультативно аэробную, хемоорганотрофную и неспорообразующую грамотрицательную бактерию. Клетки имели форму палочек (примерно 0,6 на 1,7 мкм) в логарифмической фазе роста. Они встречались поодиночке или цепочками и были подвижны с помощью жгутиков, имеющих один жгутик на одном полюсе.
TABLE 2
Culture characteristics of surface colonies of isolated strain 1 grown on TCBS agar at 23°C for 24 h
| Characteristic | Result for strain 1 |
|---|---|
| Colony diam (mm) | 3–4 |
| А.1006 Surface appearance | Smooth |
| Density | Transparent |
| Consistency | Mucoid |
| Gram stain reaction | Negative |
| Cell width (μm) | 0. 6 6 |
| Cell length (мкм) | 1,7 |
| Спорообразование | |
| Подвижность | Подвижность |
Открыть в отдельном окне
Таким образом, это исследование впервые показало, что штамм Vibrio , выделенный из кишечника высокотоксичной дикой рыбы-фугу F. vermicularis radiatus , продуцирует ТТХ, 4-эпи-ТТХ. , и ан-ТТХ и секретировали токсины в культуральный бульон. Этот результат свидетельствует о том, что отравление рыбы фугу, вероятно, вызвано бактериями. Эти бактерии, предположительно, участвуют в накоплении токсина у иглобрюха по следующему механизму у животных, несущих ТТХ. Морская пехота с ТТХ 9Штаммы 0820 Vibrio проникают в кишечник иглобрюха и ингибируют его. Эти бактерии продуцируют ТТХ и/или родственные вещества, которые накапливаются в организме хозяина и затем передаются другим организмам.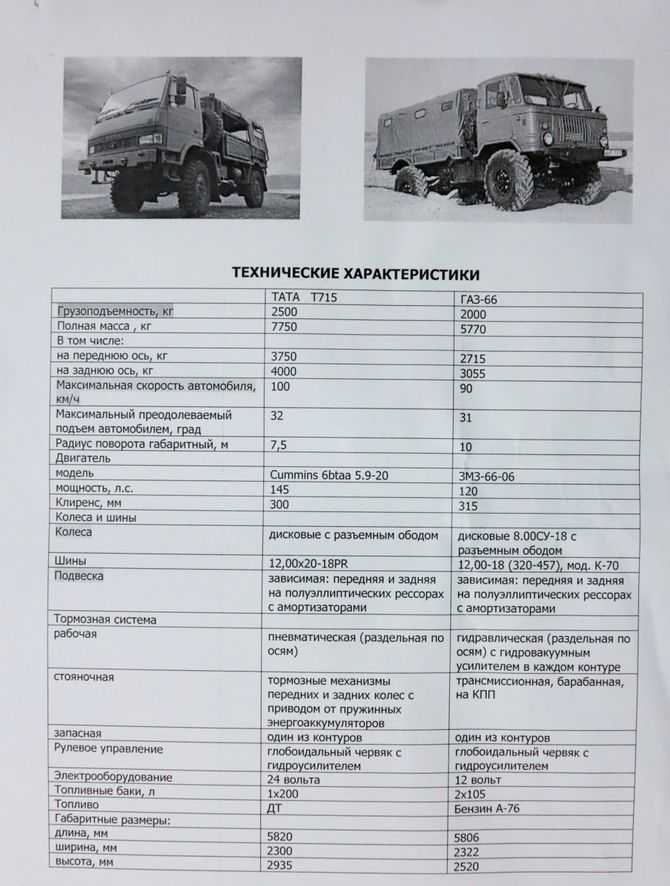 Чтобы прояснить это предположение, мы находимся в процессе получения более точных данных о биосинтетических производных ТТХ в организме.
Чтобы прояснить это предположение, мы находимся в процессе получения более точных данных о биосинтетических производных ТТХ в организме.
Эта работа была частично поддержана грантом (1998-023-H00026) Корейского исследовательского фонда, Министерства образования, правительства Кореи.
1. Do H K, Kogure K, Imada C, Noguchi T, Ohwada K, Shimidu U. Производство тетродотоксина актиномицетами, выделенными из морских отложений. J Приложение Bacteriol. 1991; 70: 464–468. [Google Scholar]
2. Гото Т., Киши Ю., Такахаши С., Хирате Ю. Тетродотоксин. Тетраэдр. 1965; 21: 2059–2088. [PubMed] [Google Scholar]
3. Хасимото Ю., Камия Х. Гипотеза пищевой цепи о происхождении морских токсинов. Bull Jpn Soc Sci Fish. 1970; 36: 425–434. [Google Scholar]
4. Hwang D, Lin LC, Jeong S S. Возникновение связанных с тетродотоксином токсинов в брюхоногих моллюсках 9Клатрат 0820 Niotha из Тайваня. Ниппон Суйсан Гаккаиси. 1992; 58: 63–67. [Google Scholar]
5. Jensen PR, Fenical W. Стратегии обнаружения вторичных метаболитов морских бактерий. Анну Рев Микробиол. 1994; 48: 559–584. [PubMed] [Google Scholar]
Стратегии обнаружения вторичных метаболитов морских бактерий. Анну Рев Микробиол. 1994; 48: 559–584. [PubMed] [Google Scholar]
6. Чон Дж. К., Миядзава К., Ногучи Т., Нарита Х., Ито К., Хасимото К. Наличие тетродотоксина в брюхоногих моллюсках «арарегаи» Niotha clathrata . Bull Jpn Soc Sci Fish. 1984;50:2099–2105. [Академия Google]
7. Кадота Х., Тага Н. Методы морской микробиологии. Токио, Япония: Центр Гаккай Шуппан; 1985. [Google Scholar]
8. Кавабата Т. Руководство по проверке гигиены пищевых продуктов. 2. Метод определения тетродотоксина 1978 г. . Японская ассоциация пищевой гигиены, Токио, Япония. [Google Scholar]
9. Ким Ю. Х., Браун Г. Б., Фурман Ф. А. Тетродотоксин: встречаемость у ателопидных лягушек в Коста-Рике. Наука. 1975; 189: 151–153. [PubMed] [Google Scholar]
10. Косуге Т., Цудзи К., Хираи К., Фукуяма Т. Первое свидетельство выработки токсинов бактериями в морском организме. Хим Фарм Бык. 1985;33:3059–3061. [PubMed] [Google Scholar]
11. Маруяма Дж., Ногучи Т., Чон Дж. К., Харада Т., Хасимото К. Наличие тетродотоксина у морских звезд Astropenten latespinisus . Опыт. 1984; 40: 1395–1402. [Google Scholar]
Маруяма Дж., Ногучи Т., Чон Дж. К., Харада Т., Хасимото К. Наличие тетродотоксина у морских звезд Astropenten latespinisus . Опыт. 1984; 40: 1395–1402. [Google Scholar]
12. Маруяма Дж., Ногучи Т., Нарита Х., Нара М., Чон Дж. К., Оцука М., Хашимото К. Наличие тетродотоксина у морских звезд Astropenten scoparius . Сельскохозяйственная биохимия. 1985; 49: 3069–3075. [Google Scholar]
13. Мацуи Т., Такэцугу С., Кодама К., Ишил А., Ямамори К., Симидзу С. Производство тетродотоксина кишечными бактериями рыбы-фугу, Нифобы Такифугу . Ниппон Суйсан Гаккаиси. 1989;55:2199–2203. [Google Scholar]
14. Mosher H S, Fuhrman F A, Buchwaid H D, Fischer H G. Тарихатоксин-тетродотоксин: сильнодействующий нейротоксин. Наука. 1964; 144:1100–1110. [PubMed] [Google Scholar]
15. Nagashima Y, Maruyama J, Noguchi T, Hashimoto K. Анализ паралитического яда моллюсков и тетродотоксина с помощью высокоэффективной жидкостной хроматографии с ионным паром.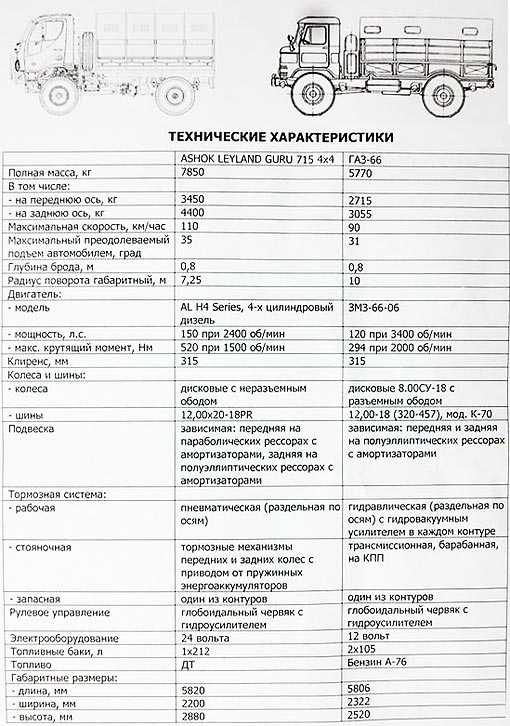 Ниппон Суйсан Гаккаиси. 1984; 53: 819–823. [Академия Google]
Ниппон Суйсан Гаккаиси. 1984; 53: 819–823. [Академия Google]
16. Narita H, Matsubara S, Miwa N, Akahane S, Murakami M, Goto T, Nara M, Noguchi T, Saito T, Shida Y, Hashimoto K. морская звезда Astropecten polyacanthus . Ниппон Суйсан Гаккаиси. 1987; 53: 617–612. [Google Scholar]
17. Narita H, Noguchi T, Maruyama J, Nara M, Hashimoto K. Наличие вещества, связанного с тетродотоксином, у брюхоногого моллюска, «hanamushirogai» Zeuxis siquijorensis . Bull Jpn Soc Sci Fish. 1984;50:85–89. [Google Scholar]
18. Narita H, Noguchi T, Maruyama J, Ueda Y, Hashimoto K, Watanabe Y, Hida K. Наличие тетродотоксина в трубчатой раковине, «boshubora» Charonia sauliae . Bull Jpn Soc Sci Fish. 1981; 47: 935–942. [Google Scholar]
19. Noguchi T, Hashimoto Y. Выделение тетродотоксина из бычка Gobius criniger . Токсин. 1973; 11: 305–310. [PubMed] [Google Scholar]
20. Ногучи Т., Хван Д. Ф., Аракава О., Сугита Х., Дегучи Ю. , Шида Ю., Хасимото К. Vibrio alginolyticus , бактерия, продуцирующая тетродотоксин, в кишечнике рыб Fugu vermicularis vermicularis . Мар биол. 1987; 94: 625–630. [Google Scholar]
, Шида Ю., Хасимото К. Vibrio alginolyticus , бактерия, продуцирующая тетродотоксин, в кишечнике рыб Fugu vermicularis vermicularis . Мар биол. 1987; 94: 625–630. [Google Scholar]
21. Noguchi T, Jeon J K, Arakawa O, Sugita H, Deguchi Y, Shida Y, Hashimoto K. Наличие тетродотоксина и ангидротетродотоксина в Vibrio sp. , выделенный из кишечника ксантидного краба, Atergatis floridus . Дж Биохим. 1986; 99: 311–314. [PubMed] [Академия Google]
22. Ногучи Т., Маруяма Дж., Нарита Х., Хашимото К. Наличие тетродотоксина в брюхоногих моллюсках Tutifa lissostoma (раковина лягушки) Toxicon. 1984; 22: 219–224. [PubMed] [Google Scholar]
23. Noguchi T, Maruyama J, Ueda Y, Hashimoto K, Harada T. Присутствие тетродотоксина в японской слоновой кости Babylonia japonica . Bull Jpn Soc Sci Fish. 1981; 478: 909–1013. [Google Scholar]
24. Ногучи Т., Нарита Х., Маруяма Дж., Хасимото К. Тетродотоксин в морской звезде Astropenten polyacanthus в связи с отравлением трубчатой раковины, «boshubora» Charonia sauliae .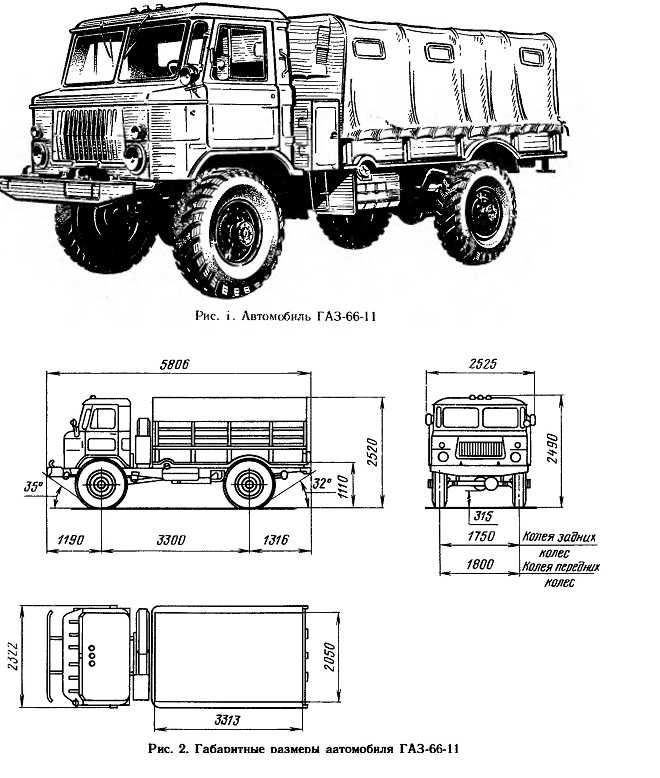 Bull Jpn Soc Sci Fish. 1982; 48: 1173–1179. [Google Scholar]
Bull Jpn Soc Sci Fish. 1982; 48: 1173–1179. [Google Scholar]
25. Noguchi T, Uzu A, Koyama K, Maruyama J, Nagashima Y, Hashimoto K. Наличие тетродотоксина в качестве основного токсина у ксантидного краба, Atergatis floridus . Bull Jpn Soc Sci Fish. 1983; 49: 1887–1892. [Google Scholar]
26. Savage I V E, Howden M E H, Spence I. Хапалотоксин, второй смертельный токсин осьминога Hapalochlaena maculosa . Токсикон. 1977; 15: 463–466. [PubMed] [Google Scholar]
27. Sheumack D D, Howden ME H, Spence I. Наличие тетродотоксиноподобного соединения в яйцах ядовитого синекольчатого осьминога ( Haplaochlaena maculosa ) Toxicon. 1984; 22:811–812. [PubMed] [Google Scholar]
28. Sheumack DD, Howden ME, Spence I, Quinn R J. Макулотоксин: нейротоксин из ядовитых желез осьминога Hapalochlaena maculosa , идентифицированный как тетродотоксин. Наука. 1978;199:188–191. [PubMed] [Google Scholar]
29. Simidu U, Noguchi T, Hwang DF, Shida Y, Hashimoto K.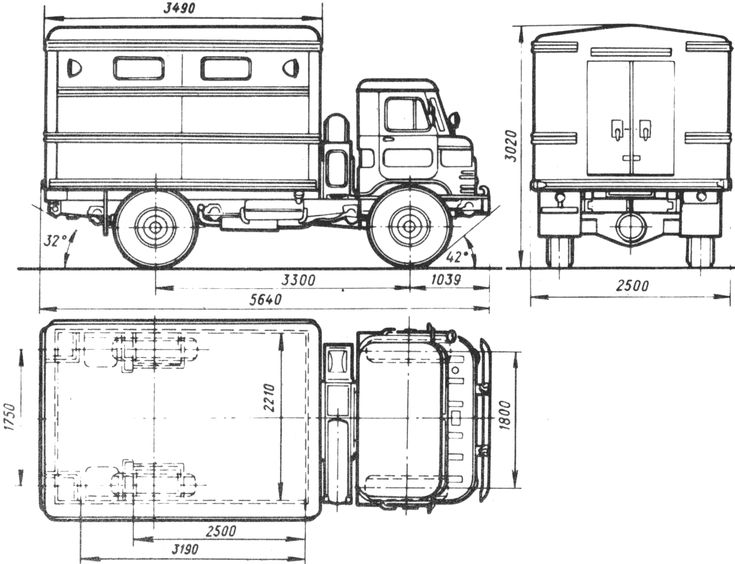 Морские бактерии, вырабатывающие тетродотоксин. Appl Environ Microbiol. 1987; 53: 1714–1715. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Морские бактерии, вырабатывающие тетродотоксин. Appl Environ Microbiol. 1987; 53: 1714–1715. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Sugita H, Ueda R, Noguchi T, Arakawa O, Hashimoto K, Deguchi Y. Идентификация бактерии, продуцирующей тетродотоксин, выделенной из ксантидного краба Atergatis floridus . Ниппон Суйсан Гаккаиси. 1987; 53:1693. [Академия Google]
31. Тансил Б. Семья II. Vibrionaceae Veron 1965. В: Krieg NR, Holt JG, editors. Руководство Бержи по систематической бактериологии. Том. 1. Балтимор, Мэриленд: Williams & Wilkins; 1984. С. 516–550. [Google Scholar]
32. Yasumoto T, Oshima Y, Hosaka M, Miyakoshi H. Наличие тетродотоксина в раковине из слоновой кости Babylonia japonica из залива Вакаса. Bull Jpn Soc Sci Fish. 1981; 47: 909–914. [Google Scholar]
33. Ясумото Т., Ясумура Д., Йоцу М., Мичишита Т., Эндо А. Бактериальное производство тетродотоксина и ангидротетродотоксина. Сельскохозяйственная биохимия.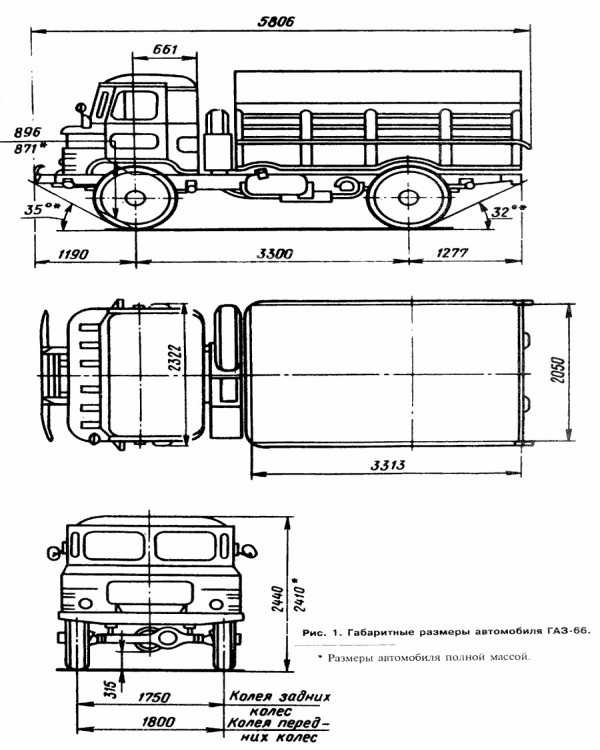

 с. при 3200 об/мин
с. при 3200 об/мин