цена обмена/замены кпп ГАЗель, соболь, волга
В данной статье, хотелось бы осветить вопросы обмена КПП это, как альтернатива быстрому ремонту, расписать основные моменты и стоимость данных услуг.
Стоимость обмена сломанной КПП на отремонтированную ГАЗ Газель, Волга, Соболь |
||
| Бензиновый мотор ЗМЗ, 402, 405, 406, 4216… | 8000 | 1000 уст. |
| КПП старый образец Камминс | 8000 | 1000 уст. |
| КПП новый образец усиленная Камминс | 20000 | 2000 уст. |
| Газель Бизнес | 8000 | 1000 уст. |
Несколько важных моментов обмена КПП ГАЗель, Соболь, Волга
Коробка передач – надежный узел таких автомобилей, как ГАЗель, Волга и Соболь. Но естественный износ в определенный момент приводит к появлению неисправностей в нем и естественно к ремонту МКПП. Также поломки могут быть обусловлены нарушением условий эксплуатации автомобиля.
Также поломки могут быть обусловлены нарушением условий эксплуатации автомобиля.
Когда актуален обмен коробки передач?
Быстрый ремонт, обмен КПП ГАЗель может потребоваться в разных случаях. Чаще всего причинами обращения в профильную мастерскую являются:
- затруднение переключения передач;
- нарушение синхронности переключения передач, посторонние звуки при осуществлении манипуляций ручкой;
- самопроизвольное выключение передачи;
- подтекание масла и т.п.
КПП Волга, ГАЗель, Соболь требует профессионального подхода к ремонту.
Как не поменять КПП шило на мыло?
Механическая КПП Соболь, Волга, ГАЗель изнашивается с определенной скоростью. Последняя зависит от условий и специфики эксплуатации транспортного средства. Обмену подлежат как неисправные, так и рабочие узлы с запасом прочности. Последние обычно меняются в плановом порядке.
К обмену предлагается три типа КПП:
- Бывшие в употреблении, исправные. Такие агрегаты снимаются с одного авто и переставляются на другое.
- Бывшие в употреблении, перебранные, отремонтированные.
- Б/у, после капитального ремонта.
С целью минимизации возможных рисков обмена сотрудничать рекомендуется с профильными специалистами. Обращение к частникам возможно исключительно на свой страх и риск. Купленная с рук КПП и установленная в кустарных условиях не обеспечивает надежность функционирования автомобиля и безопасность его эксплуатации.
Сотрудничество с профильной мастерской имеет ряд преимуществ. Прежде всего это гарантия качества представленного на обмен товара. Все детали тщательно проверяются опытными специалистами автосервиса. Установка КПП осуществляется в условиях СТО с применением профильного инструментария и оборудования.
Обмен КПП: цели и специфика
Принято считать, что обмен КПП выбирают исключительно автовладельцы, желающие сэкономить время на ремонт. На самом деле это не так. Обмен коробки передач имеет и так называемые технические выгоды. Фактически покупатель получает агрегат, протестированный в реальных дорожных условиях. КПП, предлагаемые на обмен, гарантированно не имеют производственного брака, проблем эксплуатации.
Важным преимуществом услуги является ее стоимость. Бывшая в употреблении КПП стоит дешевле новой. Соответственно, на обмен для своего авто можно получить качественный агрегат по вполне приемлемой цене.
Какие детали восстанавливаются для последующего использования в автотранспорте? В нашей мастерской на переборку и капремонт отправляются коробки, имеющие серьезный запас рабочих ресурсов.
Ремонт коробок передач Газель – Замена замена коробок передач Москва ВАО
Ремонт КПП на ГАЗель в Москве – то сложная задача, доверить которую следует профессионалам. Если необходимо отремонтировать коммерческий автотранспорт в Москве, то самым оптимальным выбором станет «ТЕХцентр ГАЗ» ВАО. Мы предлагаем оригинальные запасные части и профессиональные услуги по ремонту КПП на ГАЗель. Коробка переключения передач (КПП)- это важный элемент между двигателем и колесами автомобиля. Несвоевременный или некачественный ремонт коробки передач Газели, ведет к заметному ухудшению функционированию автомобиля в целом и сокращению срока её эксплуатации.
 Поэтому наиболее сложные диагностические и ремонтно-восстановительные работы, включая капитальный или текущий ремонт КПП автомобиля «Газель», следует поручить квалифицированным специалистам из «ТЕХцентр ГАЗ» .
Поэтому наиболее сложные диагностические и ремонтно-восстановительные работы, включая капитальный или текущий ремонт КПП автомобиля «Газель», следует поручить квалифицированным специалистам из «ТЕХцентр ГАЗ» .
Когда следует провести диагностику или ремонт КПП на Газель:
- Затруднённое включение и переключение передач.
- При включении КПП возникает треск и скрежет.
- Повышенный шум и стуки при работе коробки передач.
- Самопроизвольное выключение передач в процессе движения автомобиля.
- Подтёки трансмиссионного масла через сальники или прокладки.
- Диагносты автосервиса ГАЗ проводят тщательную диагностику, для установления неисправности и причин ее возникновения. После чего и принимается решение о стратегии ремонта КПП, а именно: частичный ее ремонт или демонтаж и разборка коробки передач.
- Оперативно, качественно и надлежащим уровнем мы делаем ремонт КПП на ГАЗель :
- осуществляем диагностику КПП;
- снимаем КПП;
- разбираем и производим дефектовку неисправных частей;
- собираем коробку;
- регулируем КПП;
- устанавливаем КПП на ваш автомобиль.
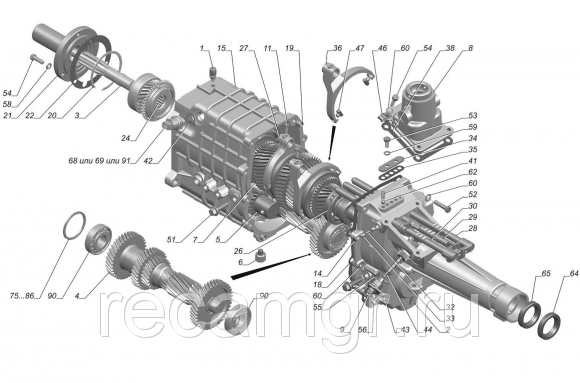
Для капитального ремонта КПП Газели производится полная разборка, которая включает в себя и разборку первичного вала, вторичного вала, рычага переключения. После полной разборки все детали коробки передач тщательно промываются и очищаются, потом определяют и меняют поврежденные детали. Последним этапом ремонта КПП — следует сборка и установка. Необходимо помнить, что бережное обращение и профилактика позволяют существенно увеличить экономичность и срок службы КПП Газели. Для этого нужно менять вовремя масло не только в двигателе ,но и в коробке передач (КПП), периодически проверять уровень масла , визуально осматривать на предмет течей. Также при наличии посторонних звуков не ждать до последнего, а своевременно приезжать в автосервис и устранять неисправность, так как это может послужить причиной более серьезного и дорогостоящего ремонта.
При устранении выявленных неисправностей коробки передач автомобиля ГАЗель особого внимания заслуживают сборочные операции – от точности и аккуратности которых зависит безотказная работа силового агрегата в гарантийный и послегарантийный период.
Разборка комплексов митотических контрольных точек совместным действием ААА-АТФазы TRIP13 и p31(comet)
. 2014 19 августа; 111 (33): 12019-24.
doi: 10.1073/pnas.14121. Epub 2014 4 августа.
Эстер Эйтан 1 , Кекси Ван 2 , Ширли Миниовиц-Шемтов 1 , Даниэль Ситри-Шева 1 , Шарон Кайсари 1 , Тим Дж. Йен 3 , Сун-Тао Лю 2 , Аврам Гершко 4
Йен 3 , Сун-Тао Лю 2 , Аврам Гершко 4
Принадлежности
- 1 Отделение биохимии, Медицинский факультет Раппапорта, Израильский технологический институт Технион, Хайфа 31096, Израиль;
- 3 Онкологический центр Fox Chase, Филадельфия, Пенсильвания 19111.
- 4 Отделение биохимии, Медицинский факультет Раппапорта, Израильский технологический институт Технион, Хайфа 31096, Израиль; [email protected].
- PMID: 25092294
- PMCID: PMC4142996
- DOI:
10.
 1073/пнас.14121
1073/пнас.14121
Бесплатная статья ЧВК
Эстер Эйтан и др. Proc Natl Acad Sci U S A. .
Бесплатная статья ЧВК
. 2014 19 августа; 111 (33): 12019-24.
doi: 10.1073/pnas.14121. Epub 2014 4 августа.
Авторы
Эстер Эйтан 1 , Кекси Ван 2 , Ширли Миниовиц-Шемтов 1 , Даниэль Ситри-Шева 1 , Шарон Кайсари 1 , Тим Дж. Йен 3 , Сун-Тао Лю 2 , Аврам Гершко 4
Йен 3 , Сун-Тао Лю 2 , Аврам Гершко 4
Принадлежности
- 1 Отделение биохимии, Медицинский факультет Раппапорта, Израильский технологический институт Технион, Хайфа 31096, Израиль;
- 2 Факультет биологических наук Толедского университета, Толедо, Огайо, 43606; и.
- 3 Онкологический центр Fox Chase, Филадельфия, Пенсильвания 19111.
- 4 Отделение биохимии, Медицинский факультет Раппапорта, Израильский технологический институт Технион, Хайфа 31096, Израиль; [email protected].
- PMID: 25092294
- PMCID: PMC4142996
- DOI:
10.
 1073/пнас.14121
1073/пнас.14121
Абстрактный
Система контрольных точек митотического (или сборки веретена) задерживает анафазу до тех пор, пока все хромосомы не будут правильно присоединены к митотическому веретену. Когда контрольная точка активна, комплекс митотической контрольной точки (MCC) собирается и ингибирует убиквитинлигазу, стимулирующую анафазу комплекса/циклосомы (APC/C). MCC состоит из контрольных белков Mad2, BubR1 и Bub3, связанных с активатором APC/C Cdc20. При отключении сигнала КПП ЦУП разбирается и КПП деактивируется. Механизмы разборки МКЦ недостаточно изучены. Ранее мы наблюдали, что гидролиз АТФ необходим для действия Mad2-связывающего белка p31 (comet) для разборки MCC. Теперь мы показываем, что экстракты клеток HeLa содержат фактор, который способствует АТФ- и p31(комет)-зависимой разборке субкомплекса Cdc20-Mad2, и идентифицируем его как белок 13, взаимодействующий с рецептором щитовидной железы (TRIP13), ААА-АТФазу, которая, как известно, взаимодействует с p31. (комета). Совместное действие TRIP13 и p31(comet) также способствует высвобождению Mad2 из MCC, участвует в полной разборке MCC и отменяет ингибирование контрольной точки APC/C. Мы предполагаем, что TRIP13 играет центральную роль в последовательности событий, ведущих к разборке MCC и инактивации контрольно-пропускных пунктов.
(комета). Совместное действие TRIP13 и p31(comet) также способствует высвобождению Mad2 из MCC, участвует в полной разборке MCC и отменяет ингибирование контрольной точки APC/C. Мы предполагаем, что TRIP13 играет центральную роль в последовательности событий, ведущих к разборке MCC и инактивации контрольно-пропускных пунктов.
Ключевые слова: митоз; КПП шпинделя.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рис. 1.
Выделение из экстрактов клеток HeLa…
Рис. 1.
1.
Выделение из экстрактов клеток HeLa АТФ-требующего фактора, который расщепляет Cdc20–Mad2 и…
Рисунок 1. Выделение из экстрактов клеток HeLa АТФ-требующего фактора, который разбирает Cdc20-Mad2, и его идентификация как TRIP13. ( A ) АТФ-зависимая разборка Cdc20-Mad2 с помощью клеточного экстракта HeLa. Экстракт клеток HeLa с задержанными контрольными точками подвергали трем последовательным иммунодеплециям для удаления эндогенных компонентов MCC, как описано в 9.0151 Материалы и методы . Полученный супернатант (Sup ×3) использовали в качестве источника фермента. Разборку Cdc20-Mad2 определяли, как описано в «Материалы и методы» , с использованием материала, высвобождаемого из иммуноочищенной MCC, в качестве субстрата. Там, где указано, добавки были следующими: Sup ×3, 1 мкл; АТФ, 1 мМ, вместе с 10 мМ фосфокреатином и 100 мкг/мл креатинфосфокиназы; гексокиназа, 200 мкг/мл, вместе с 20 мМ 2-дезоксиглюкозы; стауроспорин, 10 мкМ./39.gif) ( B ) Ионообменная хроматография экстракта клеток HeLa на MonoQ. См. SI Материалы и методы для получения подробной информации. Образцы 5 мкл фракций колонки анализировали на активность разборки Cdc20-Mad2 ( Верхний ), а другие 5 мкл образцы тех же фракций колонки подвергали иммуноблотингу с аффинно очищенным кроличьим антителом против TRIP13 ( Нижний ). Стрелка справа указывает положение маркерного белка (кДа). ( C ) Разборка Cdc20-Mad2 с помощью рекомбинантного TRIP13. Разборку субкомплекса Cdc20-Mad2 определяли, как описано в 9.0151 Материалы и методы , в присутствии либо 5 мкл препарата, очищенного MonoQ, из экстракта клеток HeLa (дорожка 3), либо бактериально экспрессированного, очищенного his6-TRIP13 (дорожки 4 и 5) в указанных концентрациях.
( B ) Ионообменная хроматография экстракта клеток HeLa на MonoQ. См. SI Материалы и методы для получения подробной информации. Образцы 5 мкл фракций колонки анализировали на активность разборки Cdc20-Mad2 ( Верхний ), а другие 5 мкл образцы тех же фракций колонки подвергали иммуноблотингу с аффинно очищенным кроличьим антителом против TRIP13 ( Нижний ). Стрелка справа указывает положение маркерного белка (кДа). ( C ) Разборка Cdc20-Mad2 с помощью рекомбинантного TRIP13. Разборку субкомплекса Cdc20-Mad2 определяли, как описано в 9.0151 Материалы и методы , в присутствии либо 5 мкл препарата, очищенного MonoQ, из экстракта клеток HeLa (дорожка 3), либо бактериально экспрессированного, очищенного his6-TRIP13 (дорожки 4 и 5) в указанных концентрациях.
Рис. 2.
TRIP13 продвигает выпуск…
Рис. 2.
2.
TRIP13 продвигает выпуск Mad2 из MCC. ( А ) Влияние…
Рис. 2. TRIP13 продвигает выпуск Mad2 из MCC. ( A ) Влияние иммунодеплеции TRIP13 на высвобождение Mad2 и Cdc20 из MCC. Высвобождение Mad2 и Cdc20 из эндогенных MCC в экстрактах контрольных точек, подвергнутых указанным иммунодеплециям, определяли, как описано в SI Materials and Methods . После инкубации при 23 °C с АТФ в течение указанных периодов времени образцы подвергали иммунопреципитации с анти-BubR1 с последующим иммуноблоттингом для Mad2 и Cdc20. ( B ) Количественная оценка результатов показана в A . Результаты выражены в процентах от значений в момент времени 0. ( C ) Добавление TRIP13 восстанавливает высвобождение Mad2 из MCC в экстрактах контрольных точек, лишенных анти-TRIP13. Экстракты подвергали иммунодеплеции с помощью анти-TRIP13 и инкубировали (23 °C, 1 ч) с АТФ, как описано в «Материалы и методы» .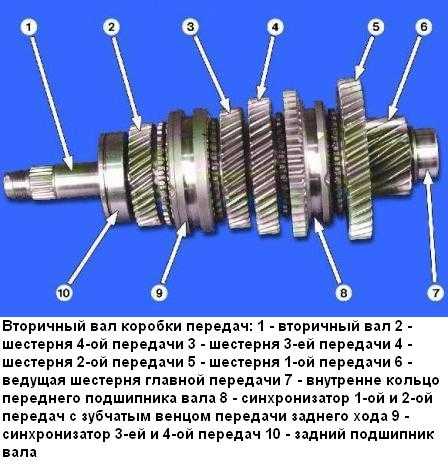 Рекомбинантный his6-TRIP13 («Recomb.») или очищенный MonoQ TRIP13 из клеток HeLa («HeLa») добавляли в указанных концентрациях. Образцы осаждали анти-BubR1 и подвергали иммуноблотингу на Mad2.
Рекомбинантный his6-TRIP13 («Recomb.») или очищенный MonoQ TRIP13 из клеток HeLa («HeLa») добавляли в указанных концентрациях. Образцы осаждали анти-BubR1 и подвергали иммуноблотингу на Mad2.
Рис. 3.
Синергетические действия TRIP13 и…
Рис. 3.
Синергическое действие TRIP13 и p31 кометы в дизассемблировании субкомплекса Cdc20–Mad2…
Рис. 3. Синергическое действие TRIP13 и p31 кометы в разборке субкомплекса Cdc20-Mad2 и MCC. ( A ) Для разборки рекомбинантного комплекса Cdc20-Mad2 требуются TRIP13, p31 комета и гидролизуемая АТФ. Рекомбинантный комплекс Cdc20-Mad2 экспрессировали и очищали, как описано в «Материалы и методы» , и добавляли к анализу в концентрации 2 нМ. Указанные добавки были в следующих концентрациях: his6-TRIP13, 50 нМ; his6–p31 комета , 25 нМ; АТФ или AMP-PNP, 3 мМ. После инкубации при 23°С в течение 60 мин образцы подвергали иммунопреципитации анти-Cdc20 с последующим иммуноблоттингом на Mad2. ( B ) Взаимосвязь между действиями TRIP13 и p31 кометы при выходе Mad2 из ЦУПа. Экстракты контрольных точек подвергали иммунодеплеции с помощью анти-TRIP13 или ложной иммунодеплеции, как указано. Там, где указано, добавляли 80 нМ his6-TRIP13 или 40 нМ his6-p31 комета . После инкубации при 23 °C в течение 1 часа высвобождение Mad2 из эндогенной MCC определяли, как описано на рис. 2 A .
Указанные добавки были в следующих концентрациях: his6-TRIP13, 50 нМ; his6–p31 комета , 25 нМ; АТФ или AMP-PNP, 3 мМ. После инкубации при 23°С в течение 60 мин образцы подвергали иммунопреципитации анти-Cdc20 с последующим иммуноблоттингом на Mad2. ( B ) Взаимосвязь между действиями TRIP13 и p31 кометы при выходе Mad2 из ЦУПа. Экстракты контрольных точек подвергали иммунодеплеции с помощью анти-TRIP13 или ложной иммунодеплеции, как указано. Там, где указано, добавляли 80 нМ his6-TRIP13 или 40 нМ his6-p31 комета . После инкубации при 23 °C в течение 1 часа высвобождение Mad2 из эндогенной MCC определяли, как описано на рис. 2 A .
Рис. 4.
Совместное действие TRIP13…
Рис. 4.
Совместное действие TRIP13 и кометы p31 отменяет ингибирование контрольной точки APC/C. …
…
Совместное действие TRIP13 и p31 кометы отменяет ингибирование контрольной точки APC/C. Деградация эндогенного циклина B в ложно-истощенном экстракте или в TRIP13 и p31 9Экстракт кометы 0007 с двойным обеднением анализировали, как описано в Материалы и методы . Там, где указано, добавляли 80 нМ his6-TRIP13 или 40 нМ his6-p31 комета . Образцы брали в указанное время и подвергали иммуноблотингу на циклин В.
Рис. 5.
Предлагаемые роли АТФазы TRIP13…
Рис. 5.
Предполагаемая роль АТФазы TRIP13 и p31 кометы Mad2-связывающего белка в путях…
Рис. 5. Предполагаемая роль АТФазы TRIP13 и p31 кометы Mad2-связывающего белка в путях разборки комплексов митотических контрольных точек и в инактивации контрольных точек. См. Обсуждение . ( Шаг 1 ) Диссоциация Cdc20–Mad2 от BubR1–Bub3, вызванная p31 кометой и Cdk-катализируемое фосфорилирование Cdc20. ( Шаг 2 ) АТФ-зависимая разборка субкомплекса Cdc20-Mad2, осуществляемая совместным действием TRIP13 и p31 кометы . Предполагается, что высвобождению Mad2 из Cdc20 может способствовать его превращение из закрытой в открытую конформацию. ( Этап 3 ) Высвобождение Mad2 из MCC с помощью TRIP13- и p31 кометы -зависимого процесса, аналогичного этапу 2. Предлагаемыми продуктами диссоциации являются MCC, не содержащие O-Mad2 и Mad2. ( Шаг 4 ) MCC без Mad2 подвергается дальнейшей разборке с высвобождением Cdc20 из BubR1–Bub3 неизвестным механизмом. Cdk, циклинзависимая киназа.
См. Обсуждение . ( Шаг 1 ) Диссоциация Cdc20–Mad2 от BubR1–Bub3, вызванная p31 кометой и Cdk-катализируемое фосфорилирование Cdc20. ( Шаг 2 ) АТФ-зависимая разборка субкомплекса Cdc20-Mad2, осуществляемая совместным действием TRIP13 и p31 кометы . Предполагается, что высвобождению Mad2 из Cdc20 может способствовать его превращение из закрытой в открытую конформацию. ( Этап 3 ) Высвобождение Mad2 из MCC с помощью TRIP13- и p31 кометы -зависимого процесса, аналогичного этапу 2. Предлагаемыми продуктами диссоциации являются MCC, не содержащие O-Mad2 и Mad2. ( Шаг 4 ) MCC без Mad2 подвергается дальнейшей разборке с высвобождением Cdc20 из BubR1–Bub3 неизвестным механизмом. Cdk, циклинзависимая киназа.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Способ взаимодействия ААА-АТФазы TRIP13 с Mad2-связывающим белком p31comet и комплексами митотических контрольных точек.

Миниовиц-Шемтов С., Эйтан Э., Кайсари С., Ситри-Шева Д., Гершко А. Миниовиц-Шемтов С. и соавт. Proc Natl Acad Sci U S A. 2015 Sep 15;112(37):11536-40. doi: 10.1073/pnas.1515358112. Epub 2015 31 августа. Proc Natl Acad Sci U S A. 2015. PMID: 26324890 Бесплатная статья ЧВК.
p31comet Способствует разборке комплекса митотических контрольных точек в АТФ-зависимом процессе.
Тайхнер А., Эйтан Э., Ситри-Шева Д., Миниовиц-Шемтов С., Думин Э., Громис Дж., Гершко А. Тайхнер А. и соавт. Proc Natl Acad Sci U S A. 2011 Feb 22;108(8):3187-92. doi: 10.1073/pnas.1100023108. Epub 2011 7 февраля. Proc Natl Acad Sci U S A. 2011. PMID: 21300909Бесплатная статья ЧВК.
Роль фосфорилирования Cdc20 в p31(comet)-стимулированной разборке комплекса митотических контрольных точек.

Миниовиц-Шемтов С., Эйтан Э., Ганот Д., Ситри-Шева Д., Думин Э., Гершко А. Миниовиц-Шемтов С. и соавт. Proc Natl Acad Sci U S A. 2012 May 22;109(21):8056-60. doi: 10.1073/pnas.1204081109. Epub 2012 7 мая. Proc Natl Acad Sci U S A. 2012. PMID: 22566641 Бесплатная статья ЧВК.
Mad2-связывающий белок p31 комета как потенциальная мишень для терапии рака человека.
Энрикес А.С., Сильва ПМА, Сарменто Б., Бусбаа Х. Энрикес А.С. и соавт. Цели лекарств против рака Curr. 2021;21(5):401-415. дои: 10.2174/1568009621666210129095726. Цели лекарств против рака Curr. 2021. PMID: 33511944 Обзор.
Митотическая контрольная точка: сигнальный путь, который позволяет одной неприкрепленной кинетохоре ингибировать выход из митоза.

Чан Г.К., Йен Т.Дж. Чан Г.К. и соавт. Прог Клеточный Цикл Рез. 2003;5:431-9. Прог Клеточный Цикл Рез. 2003. PMID: 14593737 Обзор.
Посмотреть все похожие статьи
Цитируется
TRIP13 участвует в немедленном и раннем обнаружении разрывов цепей ДНК и усилении передачи сигналов ATM посредством MRE11.
Чон Х., Ви М., Пэк И.Дж., Сон Г., Ум С.Х., Ли С.Г., Со И, Ра Дж., Ли Э.А., Ким С., Ким Б.Г., Дешпанде Р.А., Полл Т.Т., Хан Д.С., Квон Т., Мён К. Чон Х. и др. Клетки. 2022 16 декабря; 11 (24): 4095. doi: 10.3390/cells11244095. Клетки. 2022. PMID: 36552858 Бесплатная статья ЧВК.
Восстановление после остановки, опосредованной контрольной точкой веретена, требует нового Dnt1-зависимого механизма активации APC/C.

Бай С, Сунь Л, Ван Х, Ван С.М., Ло ZQ, Ван И, Джин QW. Бай С. и др. Генетика PLoS. 15 сентября 2022 г .; 18 (9): e1010397. doi: 10.1371/journal.pgen.1010397. электронная коллекция 2022 сент. Генетика PLoS. 2022. PMID: 36108046 Бесплатная статья ЧВК.
Истощение Trip13 при раке печени вызывает липогенный ответ, способствующий Plin2-зависимой митотической гибели клеток.
Риос Гарсия М., Мейсбургер Б., Чан Дж., де Гиа Р.М., Маттейссен Ф., Ресслер С., Биркенфельд А.Л., Ращзок Н., Риолс Ф., Токарц Дж., Жиру М., Гил Лозано М., Хартлебен Г., Наврот П., Хайд М., Лопес М., Херциг С., Берриэль Диас М. Риос Гарсия М. и др. Adv Sci (Вейн). 2022 окт;9(29):e2104291. doi: 10.1002/advs.202104291. Epub 2022 28 августа. Adv Sci (Вейн). 2022. PMID: 36031387 Бесплатная статья ЧВК.
Роль фосфорилирования Cdc20 в регуляции действия APC/C в митозе.

Шевах-Ситри Д., Миниовиц-Шемтов С., Тайхнер А., Кайсари С., Гершко А. Шева-Ситри Д. и соавт. Proc Natl Acad Sci U S A. 2022, 30 августа; 119 (35): e2210367119. doi: 10.1073/pnas.2210367119. Epub 2022 24 августа. Proc Natl Acad Sci U S A. 2022. PMID: 36001690
TRIP13 индуцирует устойчивость к недаплатину при плоскоклеточной карциноме пищевода, усиливая репарацию повреждений ДНК и ингибируя апоптоз.
Чжан Л.Т., Ке Л.С., Ву С.Ю., Тянь Х.Т., Дэн Х.З., Сюй Л.И., Ли Э.М., Лонг Л. Чжан Л.Т. и соавт. Биомед Рез Инт. 2022 10 мая; 2022:7295458. дои: 10.1155/2022/7295458. Электронная коллекция 2022. Биомед Рез Инт. 2022. PMID: 35601150 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- CA06927/CA/NCI NIH HHS/США
- R01CA169500/CA/NCI NIH HHS/США
- CA169706/CA/NCI NIH HHS/США
- R01 CA169500/CA/NCI NIH HHS/США
- R21 CA169706/CA/NCI NIH HHS/США
- P30 CA006927/CA/NCI NIH HHS/США
TRIP13 и APC15 управляют выходом из митоза за счет оборота MCC, продуцируемых интерфазными и неприкрепленными кинетохорами.
 дрожжи. Клетка. 1995; 81: 269–278. doi: 10.1016/0092-8674(95)
дрожжи. Клетка. 1995; 81: 269–278. doi: 10.1016/0092-8674(95)2. Судакин В. и соавт. Циклосома, большой комплекс, содержащий циклин-селективную активность убиквитинлигазы, нацеливает циклины на разрушение в конце митоза. Мол. биол. Клетка. 1995;6:185–197. doi: 10.1091/mbc.6.2.185. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. King RW, et al. Комплекс 20S, содержащий CDC27 и CDC16, катализирует митоз-специфическую конъюгацию убиквитина с циклином B. Клетка. 1995; 81: 279–288. doi: 10.1016/0092-8674(95)
-0. [PubMed] [CrossRef] [Google Scholar]
4. Tugendreich S, Tomkiel J, Earnshaw W, Hieter P. CDC27Hs колокализуется с CDC16Hs в центросоме и митотическом веретене и необходим для перехода от метафазы к анафазе. Клетка. 1995;81:261–268. doi: 10.1016/0092-8674(95)
5. Пайнс Дж. Кубизм и клеточный цикл: многоликость APC/C. Нац. Преподобный Мол. Клеточная биол. 2011; 12:427–438. doi: 10.1038/nrm3132. [PubMed] [CrossRef] [Google Scholar]
Нац. Преподобный Мол. Клеточная биол. 2011; 12:427–438. doi: 10.1038/nrm3132. [PubMed] [CrossRef] [Google Scholar]
6. Li Y, Gorbea C, Mahaffey D, Rechsteiner M, Benezra R. MAD2 связывается с комплексом, способствующим циклосоме/анафазе, и ингибирует его активность. проц. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 1997; 94:12431–12436. doi: 10.1073/pnas.94.23.12431. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Фанг Г., Ю. Х., Киршнер М. В. Белок контрольной точки MAD2 и регулятор митоза CDC20 образуют тройной комплекс с комплексом, способствующим анафазе, для контроля инициации анафазы. Гены Дев. 1998; 12:1871–1883. doi: 10.1101/gad.12.12.1871. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Судакин В., Чан Г.К., Йен Т.Дж. Ингибирование контрольной точки APC/C в клетках HeLa опосредуется комплексом BUBR1, BUB3, CDC20 и MAD2. Дж. Селл. биол. 2001; 154: 925–936. doi: 10.1083/jcb.200102093. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Schweizer N, et al. Надежность контрольной точки сборки веретена требует Tpr-опосредованной регуляции протеостаза Mad1/Mad2. Дж. Селл. биол. 2013; 203: 883–893. doi: 10.1083/jcb.201309076. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Schweizer N, et al. Надежность контрольной точки сборки веретена требует Tpr-опосредованной регуляции протеостаза Mad1/Mad2. Дж. Селл. биол. 2013; 203: 883–893. doi: 10.1083/jcb.201309076. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Meraldi P, Draviam VM, Sorger PK. Сроки и контрольные точки в регуляции митотической прогрессии. Дев. Клетка. 2004; 7: 45–60. doi: 10.1016/j.devcel.2004.06.006. [PubMed] [CrossRef] [Академия Google]
11. Родригес-Браво В. и соавт. Ядерные поры защищают целостность генома, собирая премитотический и Mad1-зависимый ингибитор анафазы. Клетка. 2014; 156:1017–1031. doi: 10.1016/j.cell.2014.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Tipton AR, et al. BUBR1 и закрытый MAD2 (C-MAD2) взаимодействуют непосредственно, чтобы собрать функциональный комплекс митотических контрольных точек. Дж. Биол. хим. 2011; 286:21173–21179. doi: 10.1074/jbc.M111.238543. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Аравинд Л., Кунин Е.В. Домен HORMA: общий структурный знаменатель в контрольных точках митоза, синапсисе хромосом и репарации ДНК. Тенденции биохим. науч. 1998; 23: 284–286. doi: 10.1016/S0968-0004(98)01257-2. [PubMed] [CrossRef] [Google Scholar]
Аравинд Л., Кунин Е.В. Домен HORMA: общий структурный знаменатель в контрольных точках митоза, синапсисе хромосом и репарации ДНК. Тенденции биохим. науч. 1998; 23: 284–286. doi: 10.1016/S0968-0004(98)01257-2. [PubMed] [CrossRef] [Google Scholar]
14. Luo X, Tang Z, Rizo J, Yu H. Белок контрольной точки веретена Mad2 претерпевает аналогичные серьезные конформационные изменения при связывании либо с Mad1, либо с Cdc20. Мол. Клетка. 2002; 9: 59–71. doi: 10.1016/S1097-2765(01)00435-X. [PubMed] [CrossRef] [Академия Google]
15. Sironi L, et al. Кристаллическая структура тетрамерного основного комплекса Mad1-Mad2: последствия механизма связывания «пояса безопасности» для контрольной точки веретена. EMBO J. 2002; 21: 2496–2506. doi: 10.1093/emboj/21.10.2496. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Мапелли М., Массимилиано Л., Сантагуида С., Мусаккио А. Конформационный димер Mad2: структура и последствия для контрольной точки сборки шпинделя. Клетка. 2007; 131:730–743. doi: 10.1016/j.cell.2007.08.049. [PubMed] [CrossRef] [Google Scholar]
2007; 131:730–743. doi: 10.1016/j.cell.2007.08.049. [PubMed] [CrossRef] [Google Scholar]
17. Luo X, et al. Белок контрольной точки веретена Mad2 имеет два различных состояния нативной укладки. Нац. Структура Мол. биол. 2004; 11: 338–345. doi: 10.1038/nsmb748. [PubMed] [CrossRef] [Google Scholar]
18. Shah J, et al. Динамика центромерных и кинетохорных белков, влияющих на передачу сигналов контрольных точек и молчание. Курс. биол. 2004; 14:942–952. [PubMed] [Google Scholar]
19. Vink M, et al. In vitro FRAP определяет минимальные требования к динамике кинетохор Mad2. Курс. биол. 2006; 16: 755–766. doi: 10.1016/j.cub.2006.03.057. [PubMed] [CrossRef] [Академия Google]
20. Ji, Z., Gao, H., Jia, L., Li, B. & Yu, H. Последовательный многоцелевой каскад фосфорилирования Mps1 способствует передаче сигналов контрольной точки веретена. eLife 6 , e22513 (2017). [Бесплатная статья PMC] [PubMed]
21. Кулукян А., Хан Дж. С., Кливленд Д. В. Неприкрепленные кинетохоры катализируют продукцию ингибитора анафазы, для которого требуется матрица Mad2, чтобы активировать Cdc20 для связывания BubR1. Дев. Клетка. 2009; 16:105–117. doi: 10.1016/j.devcel.2008.11.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
В. Неприкрепленные кинетохоры катализируют продукцию ингибитора анафазы, для которого требуется матрица Mad2, чтобы активировать Cdc20 для связывания BubR1. Дев. Клетка. 2009; 16:105–117. doi: 10.1016/j.devcel.2008.11.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Faesen AC, et al. Основа каталитической сборки комплекса митотической контрольной точки. Природа. 2017; 542: 498–502. doi: 10.1038/nature21384. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Lee SH, Sterling H, Burlingame A, McCormick F. Tpr напрямую связывается с Mad1 и Mad2 и имеет важное значение для Mad1-Mad2-опосредованного митотического веретена. пропускной пункт. Гены Дев. 2008;22:2926–2931. doi: 10.1101/gad.1677208. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Howell BJ, et al. Цитоплазматический динеин/динактин управляет транспортом белков кинетохор к полюсам веретена и играет роль в инактивации контрольных точек митотического веретена. Дж. Селл. биол. 2001;155:1159–1172. doi: 10.1083/jcb.200105093. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Дж. Селл. биол. 2001;155:1159–1172. doi: 10.1083/jcb.200105093. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Barisic M, Geley S. Веретенообразный переключатель контролирует анафазу: веретенообразный и RZZ функции в прикреплении хромосом и контроле митотических контрольных точек. Клеточный цикл. 2011; 10:449–456. doi: 10.4161/cc.10.3.14759. [PubMed] [CrossRef] [Google Scholar]
26. Gassmann R, et al. Новый механизм, контролирующий взаимодействие кинетохор и микротрубочек, выявлен путем сравнения двух компонентов, нацеленных на динеин: SPDL-1 и комплекса Rod/Zwilch/Zw10. Гены Дев. 2008; 22: 2385–239.9. doi: 10.1101/gad.1687508. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Gassmann R, et al. Удаление Spindly из кинетохор, прикрепленных к микротрубочкам, контролирует молчание контрольных точек веретена в клетках человека. Гены Дев. 2010; 24:957–971. doi: 10.1101/gad.1886810. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Wei R, Ngo B, Wu G, Lee WH. Фосфорилирование сложного белка Ndc80, HEC1, киназой Nek2 модулирует выравнивание хромосом и передачу сигналов контрольной точки сборки веретена. Мол. биол. Клетка. 2011; 22:3584–3594. doi: 10.1091/mbc.e11-01-0012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Wei R, Ngo B, Wu G, Lee WH. Фосфорилирование сложного белка Ndc80, HEC1, киназой Nek2 модулирует выравнивание хромосом и передачу сигналов контрольной точки сборки веретена. Мол. биол. Клетка. 2011; 22:3584–3594. doi: 10.1091/mbc.e11-01-0012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Zhang G, Lischetti T, Nilsson J. Минимальное количество повторов MELT поддерживает все функции KNL1 при сегрегации хромосом. Дж. Селл. науч. 2014; 127:871–884. doi: 10.1242/jcs.139725. [PubMed] [CrossRef] [Google Scholar]
30. Розенберг Дж.С., Кросс Ф.Р., Фунабики Х. KNL1/Spc105 нанимает PP1, чтобы заглушить контрольную точку сборки шпинделя. Курс. биол. 2011;21:942–947. doi: 10.1016/j.cub.2011.04.011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Meadows JC, et al. Замалчивание контрольной точки веретена требует ассоциации PP1 с моторами Spc7 и kinesin-8. Дев. Клетка. 2011;20:739–750. doi: 10.1016/j.devcel.2011.05.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Vanoosthuyse V, Hardwick KG. Новый механизм подавления контрольной точки веретена, зависимый от протеинфосфатазы 1. Курс. биол. 2009;19:1176–1181. doi: 10.1016/j.cub.2009.05.060. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Vanoosthuyse V, Hardwick KG. Новый механизм подавления контрольной точки веретена, зависимый от протеинфосфатазы 1. Курс. биол. 2009;19:1176–1181. doi: 10.1016/j.cub.2009.05.060. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33. Пинский Б.А., Нельсон К.Р., Биггинс С. Протеинфосфатаза 1 регулирует выход из контрольной точки веретена у почкующихся дрожжей. Курс. биол. 2009 г.;19:1182–1187. doi: 10.1016/j.cub.2009.06.043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Pan J, Chen RH. Контрольная точка веретена регулирует стабильность Cdc20p в Saccharomyces cerevisiae. Гены Дев. 2004; 18:1439–1451. doi: 10.1101/gad.1184204. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Reddy SK, Rape M, Margansky WA, Kirschner MW. Убиквитинирование комплексом, способствующим анафазе, вызывает инактивацию контрольной точки веретена. Природа. 2007; 446: 921–925. doi: 10.1038/nature05734. [PubMed] [CrossRef] [Академия Google]
36. Ge S, Skaar JR, Pagano M. Опосредованная APC/C и Mad2 деградация Cdc20 во время активации контрольной точки веретена. Клеточный цикл. 2009; 8: 167–171. doi: 10.4161/cc.8.1.7606. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ge S, Skaar JR, Pagano M. Опосредованная APC/C и Mad2 деградация Cdc20 во время активации контрольной точки веретена. Клеточный цикл. 2009; 8: 167–171. doi: 10.4161/cc.8.1.7606. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Foe IT, et al. Убиквитинирование Cdc20 с помощью APC происходит по внутримолекулярному механизму. Курс. биол. 2011; 21:1870–1877. doi: 10.1016/j.cub.2011.09.051. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Мансфельд Дж., Коллин П., Коллинз М.О., Чоудхари Дж.С., Пайнс Дж. прикрепление кинетохор. Нац. Клеточная биол. 2011;13:1234–1243. дои: 10.1038/ncb2347. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Фостер С.А., Морган Д.О. Субъединица APC/C Mnd2/Apc15 способствует аутоубиквитинированию Cdc20 и инактивации контрольной точки сборки веретена. Мол. Клетка. 2012;47:921–932. doi: 10.1016/j.molcel.2012.07.031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Uzunova K, et al. APC15 опосредует аутоубиквитинирование CDC20 с помощью APC/C(MCC) и разборку комплекса митотических контрольных точек. Нац. Структура Мол. биол. 2012;19:1116–1123. doi: 10.1038/nsmb.2412. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
APC15 опосредует аутоубиквитинирование CDC20 с помощью APC/C(MCC) и разборку комплекса митотических контрольных точек. Нац. Структура Мол. биол. 2012;19:1116–1123. doi: 10.1038/nsmb.2412. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Alfieri C, et al. Молекулярные основы регуляции APC/C контрольной точкой узла шпинделя. Природа. 2016; 536: 431–436. doi: 10.1038/nature19083. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Yamaguchi M, et al. Крио-ЭМ связанного с комплексом митотической контрольной точки APC/C выявляет реципрокную и конформационную регуляцию лигирования убиквитина. Мол. Клетка. 2016; 63: 593–607. doi: 10.1016/j.molcel.2016.07.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Westhorpe FG, Tighe A, Lara-Gonzalez P, Taylor SS. Опосредованная p31comet экстракция Mad2 из MCC способствует эффективному выходу из митоза. Дж. Селл. науч. 2011;124:3905–3916. doi: 10.1242/jcs.093286. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Yang M, et al. p31comet блокирует активацию Mad2 посредством структурной мимикрии. Клетка. 2007; 131: 744–755. doi: 10.1016/j.cell.2007.08.048. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Yang M, et al. p31comet блокирует активацию Mad2 посредством структурной мимикрии. Клетка. 2007; 131: 744–755. doi: 10.1016/j.cell.2007.08.048. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Chao WC, Kulkarni K, Zhang Z, Kong EH, Barford D. Структура комплекса митотических контрольных точек. Природа. 2012; 484: 208–213. doi: 10.1038/nature10896. [PubMed] [CrossRef] [Академия Google]
46. Xia G, et al. Конформационно-специфическое связывание p31(comet) противодействует функции Mad2 в контрольной точке веретена. EMBO J. 2004; 23:3133–3143. doi: 10.1038/sj.emboj.7600322. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Miniowitz-Shemtov S, Eytan E, Kaisari S, Sitry-Shevah D, Hershko A. Способ взаимодействия TRIP13 AAA-ATPase с Mad2- связывающий белок p31comet и комплексы митотических контрольных точек. проц. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2015;112:11536–11540. doi: 10.1073/pnas.1515358112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Eytan E, et al. Разборка комплексов митотических контрольных точек совместным действием ААА-АТФазы TRIP13 и p31(comet) Proc. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2014;111:12019–12024. doi: 10.1073/pnas.14121. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Eytan E, et al. Разборка комплексов митотических контрольных точек совместным действием ААА-АТФазы TRIP13 и p31(comet) Proc. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2014;111:12019–12024. doi: 10.1073/pnas.14121. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Wang K, et al. Белок 13, взаимодействующий с рецептором гормона щитовидной железы (TRIP13) ААА-АТФаза, представляет собой новый белок, подавляющий митотическую контрольную точку. Дж. Биол. хим. 2014; 289:23928–23937. doi: 10.1074/jbc.M114.585315. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Ye, Q. et al. TRIP13 представляет собой ремоделирующую белок ААА+АТФазу, которая катализирует переключение конформации MAD2. eLife 4 , e07367 (2015). [Статья бесплатно PMC] [PubMed]
51. Alfieri C, Chang L, Barford D. Механизм ремоделирования белка контрольной точки клеточного цикла MAD2 с помощью АТФазы TRIP13. Природа. 2018; 559: 274–278. doi: 10.1038/s41586-018-0281-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1038/s41586-018-0281-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Ye Q, et al. AAA + АТФаза TRIP13 ремоделирует домены HORMA посредством N-концевого взаимодействия и развертывания. EMBO J. 2017;36:2419–2434. doi: 10.15252/embj.201797291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Nelson CR, Hwang T, Chen PH, Bhalla N. TRIP13PCH-2 способствует локализации Mad2 в неприкрепленных кинетохорах в реакции контрольной точки веретена. Дж. Селл. биол. 2015; 211:503–516. doi: 10.1083/jcb.201505114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Ma HT, Poon RYC. TRIP13 регулирует как активацию, так и деактивацию контрольной точки узла шпинделя. Cell Rep. 2016; 14: 1086–109.9. doi: 10.1016/j.celrep.2016.01.001. [PubMed] [CrossRef] [Google Scholar]
55. Yost S, et al. Биаллельные мутации TRIP13 предрасполагают к опухоли Вильмса и неправильной сегрегации хромосом. Нац. Жене. 2017;49:1148–1151. doi: 10. 1038/ng.3883. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1038/ng.3883. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Marks DH, et al. Сверхэкспрессия Mad2 раскрывает критическую роль TRIP13 в выходе из митоза. Cell Rep. 2017; 19: 1832–1845. doi: 10.1016/j.celrep.2017.05.021. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Ларкин С.Е., и соавт. Идентификация маркеров прогрессирования рака предстательной железы с использованием экспрессии генов-кандидатов. бр. Дж. Рак. 2012; 106: 157–165. doi: 10.1038/bjc.2011.490. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Banerjee R, et al. TRIP13 способствует подверженному ошибкам негомологичному соединению концов и индуцирует химиорезистентность при раке головы и шеи. Нац. коммун. 2014;5:4527. doi: 10.1038/ncomms5527. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Нисимура К., Фукагава Т., Такисава Х., Какимото Т., Канемаки М. Дегроновая система на основе ауксина для быстрого истощения белков в нерастительных клетках. Нац. Методы. 2009; 6: 917–922. doi: 10.1038/nmeth.1401. [PubMed] [CrossRef] [Google Scholar]
Нац. Методы. 2009; 6: 917–922. doi: 10.1038/nmeth.1401. [PubMed] [CrossRef] [Google Scholar]
60. Holland AJ, Fachinetti D, Han JS, Cleveland DW. Индуцируемая обратимая система для быстрой и полной деградации белков в клетках млекопитающих. проц. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2012;109:E3350–E3357. doi: 10.1073/pnas.1216880109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Hara M, Ozkan E, Sun H, Yu H, Luo X. Структура промежуточного конформера белка Mad2 контрольной точки веретена. проц. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2015;112:11252–11257. doi: 10.1073/pnas.1512197112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Fry DW, et al. Специфическое ингибирование циклинзависимой киназы 4/6 с помощью PD 0332991 и связанная с этим противоопухолевая активность в ксенотрансплантатах опухолей человека. Мол. Рак Тер. 2004;3:1427–1438. [PubMed] [Google Scholar]
63. Yang M, et al. Информация о регуляции mad2 в контрольной точке веретена, обнаруженная с помощью кристаллической структуры симметричного димера mad2. PLoS биол. 2008;6:e50. doi: 10.1371/journal.pbio.0060050. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS биол. 2008;6:e50. doi: 10.1371/journal.pbio.0060050. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Кайсари С., Ситри-Шева Д., Миниовиц-Шемтов С., Гершко А. Промежуточные соединения в сборке комплексов митотических контрольных точек и их роль в регуляции комплекса, способствующего анафазе. проц. Натл акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2016; 113:966–971. doi: 10.1073/pnas.1524551113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Santaguida S, Tighe A, D’Alise AM, Taylor SS, Musacchio A. Анализ роли MPS1 в биориентации хромосом и контрольной точке веретена через низкомолекулярный ингибитор реверсина. Дж. Селл. биол. 2010;190: 73–87. doi: 10.1083/jcb.201001036. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Brulotte ML, et al. Механистическое понимание структурного перехода Mad2, катализируемого TRIP13, и молчание контрольной точки шпинделя. Нац. коммун. 2017; 8:1956. doi: 10.1038/s41467-017-02012-2.
