Электролит свинцово-кислотной аккумуляторной батареи.
Для работы свинцово-кислотной аккумуляторной батареи необходим электролит – водный раствор серной кислоты, обладающий высокой ионной проводимостью. При погружении электродов аккумулятора в электролит и подключении к выводам электродов внешней нагрузки начинаются электрохимические реакции, описанные в предыдущей статье.
Электролит для заливки в аккумуляторную батарею готовят из серной кислоты (ГОСТ 667-73) и дистиллированной воды (ГОСТ 6709-72). При подготовке электролита следует пользоваться руководством по эксплуатации автомобиля. Для надежной работы аккумуляторных батарей необходима высокая степень чистоты электролита.
Нельзя применять техническую серную кислоту и недистиллированную воду, так как при этом ускоряется саморазрядка, сульфатация и разрушение пластин, и уменьшается емкость батареи.
При приготовлении электролита кислоту льют тонкой струйкой в воду, одновременно помешивая раствор чистой стеклянной палочкой.
Смешивать электролит следует в кислотостойкой эбонитовой, фарфоровой или освинцованной посуде.
Количество дистиллированной воды, серной кислоты или электролита при приготовлении 1 литра электролита необходимой плотности приведены в таблице 1.
Таблица 1. Количество дистиллированной воды, серной кислоты или электролита плотностью 1,4 г/см3 для приготовления 1 л электролита необходимой плотности при температуре 25 ˚С, л
Плотность |
Для серной кислоты |
Для электролита |
||
дистиллированная |
серная кислота |
дистиллированная |
электролит |
|
1,23 |
0,829 |
0,231 |
0,465 |
0,549 |
1,25 |
0,809 |
0,253 |
0,410 |
0,601 |
1,27 |
0,791 |
0,274 |
0,357 |
0,652 |
1,31 |
0,749 |
0,319 |
0,246 |
0,760 |
1,40 |
0,650 |
0,423 |
0 |
1 |
Плотность электролита определяют с помощью денсиметра или ареометра.
Новые аккумуляторные батареи заливают электролитом плотностью на 0,02 г/см3 меньше той, которая должна быть в конце зарядки.
***
Плотность электролита
Плотность электролита, как и любого другого вещества, определяется отношением массы к занимаемому этой массой объему. Для электролита плотность измеряется в граммах на кубический сантиметр ( г/см3).
Поскольку плотность дистиллированной воды равна 1 г/см3, а серная кислота тяжелее воды (ее плотность при +20 ˚С составляет: 1,8312-1,8355 г/см3), то с добавлением серной кислоты в воду плотность электролита будет возрастать, а при добавлении в раствор (электролит) воды, его плотность будет уменьшаться. По этим же причинам плотность будет уменьшаться при сульфатации пластин и при сильной разрядке батареи, а увеличивается при испарении воды (например, в процессе интенсивной зарядки).
При понижении плотности электролита возрастает внутреннее сопротивление аккумуляторной батареи и уменьшается ее емкость. В морозное время года чрезмерное снижение плотности может привести к замерзанию электролита.
В морозное время года чрезмерное снижение плотности может привести к замерзанию электролита.
Повышение плотности электролита приводит к интенсивному разрушению пластин и их сульфатации, что снижает емкость аккумулятора и уменьшает срок его службы. Следует учитывать, что плотность электролита в аккумуляторах (банках) аккумуляторной батареи не должна отличаться более чем на
Если плотность выше нормы — доливают дистиллированную воду, если ниже — электролит плотностью 1,4 г/см3 (электролит можно доливать лишь в полностью заряженную аккумуляторную батарею). Корректировку плотности доливкой производят после предварительного отбора из аккумуляторов нужного количества электролита. После этого аккумуляторную батарею заряжают в течение 25…30 мин для полного перемешивания электролита и снова измеряют его плотность.
В процессе эксплуатации необходимо следить за состоянием аккумуляторной батареи. При нормальных эксплуатационных параметрах плотность электролита в аккумуляторах батареи является индикатором степени их разрядки. Снижение плотности электролита на 0,01 г/см3 соответствует разрядке аккумулятора на 6 %.
Если появляется необходимость в частой подзарядке батареи, следует выяснить причину и ее устранить, поскольку систематическая недозарядка аккумуляторной батареи значительной сокращает срок ее службы и отрицательно сказывается на пусковых качествах двигателя.
***
Определение степени зарядки аккумуляторной батареи
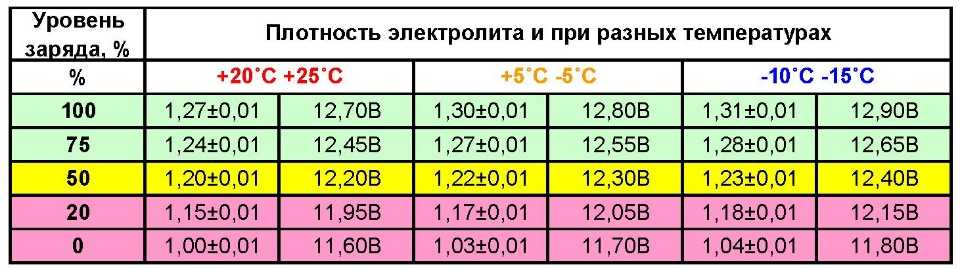
Степень зарядки аккумуляторной батареи проверяют измерением плотности электролита, приведенной к температуре +25 ˚С. В зависимости от климатических условий эксплуатации автомобиля и времени года используется электролит разной плотности (таблица 2).
Таблица 2. Плотность электролита в зависимости от климатических условий и времени года
Макрокли- |
Климатический район (ГОСТ 16350-80) |
Средне- |
Время года |
Плотность электролита приведенная к температуре +25 ˚С, г/см3 |
|
Для новой аккумуляторной батареи |
Для заряженной аккумуляторной батареи |
||||
Холодный |
Очень холодный |
от -50 до -30 |
Зима |
1,28 |
1,30 |
Лето |
1,24 |
1,26 |
|||
Холодный |
от -30 до -15 |
Круглый год |
1,26 |
1,28 |
|
Умеренный |
Умеренный |
от -15 до -3 |
Круглый год |
1,24 |
1,26 |
Жаркий сухой |
от -15 до +4 |
1,22 |
1,24 |
||
Теплый влажный |
1,20 |
1,22 |
|||
При определении плотности электролита необходимо учитывать его температуру, применяя соответствующие поправки, приведенные в таблице 3.
Таблица 3. Поправки при измерении плотности электролита (г/см3) в зависимости от его температуры
Температура электролита, |
+45 |
+30 |
+15 |
0 |
-30 |
-15 |
-45 |
Поправка плотности |
+0,02 |
+0,01 |
0 |
-0,01 |
-0,02 |
-0,03 |
-0,04 |
***
Проверка уровня электролита
Одним из важнейших условий надежной работы аккумуляторной батареи является поддержание необходимого уровня электролита в ее элементах. Уровень электролита в каждой секции моноблока (банках) должен быть на 10…15 мм выше предохранительного щитка, установленного над сепараторами.
Уровень электролита в каждой секции моноблока (банках) должен быть на 10…15 мм выше предохранительного щитка, установленного над сепараторами.
Для облегчения контроля уровня электролита у заливных горловин аккумуляторных батарей снизу имеются указатели – тубусы, входящие внутрь аккумуляторной батареи. Нижний срез тубуса находится на требуемом расстоянии от поверхности предохранительного щитка. Уровень электролита считается достаточным, если поверхность электролита касается нижнего торца тубуса горловины. При этом на поверхности электролита образуется четко видимый мениск. Если уровень электролита ниже указанного из-за выплескивания, следует долить дистиллированной воды.
Проверять уровень электролита рекомендуется на остывшей заряженной аккумуляторной батарее или после длительной поездки, так как в этом случае происходит «кипение» электролита, повышение его температуры и испарение дистиллированной воды.
В случае превышения уровня электролита в банках аккумуляторной батареи его следует уменьшить с помощью резиновой груши, так как выплескивание может привести к интенсивной коррозии деталей крепления и к окислению проводов.
***
Типы автомобильных аккумуляторов
Главная страница
- Страничка абитуриента
Дистанционное образование
- Группа ТО-81
- Группа М-81
- Группа ТО-71
Специальности
- Ветеринария
- Механизация сельского хозяйства
- Коммерция
- Техническое обслуживание и ремонт автотранспорта
Учебные дисциплины
- Инженерная графика
- МДК.01.01. «Устройство автомобилей»
- Карта раздела
- Общее устройство автомобиля
- Автомобильный двигатель
- Трансмиссия автомобиля
- Рулевое управление
- Тормозная система
- Подвеска
- Колеса
- Кузов
- Электрооборудование автомобиля
- Основы теории автомобиля
- Основы технической диагностики
- Основы гидравлики и теплотехники
- Метрология и стандартизация
- Сельскохозяйственные машины
- Основы агрономии
- Перевозка опасных грузов
- Материаловедение
- Менеджмент
- Техническая механика
- Советы дипломнику
Олимпиады и тесты
- «Инженерная графика»
- «Техническая механика»
- «Двигатель и его системы»
- «Шасси автомобиля»
- «Электрооборудование автомобиля»
Данные для точной подгонки плотности электролита для автомобильных аккумуляторных батарей
Данные для точной подгонки плотности электролита для автомобильных аккумуляторных батарейИнтернет-журнал по ремонту бытовой техники и автоэлектроники Времонт. su
su
Для точной подгонки плотности электролита при его заливке в батарею необходимо иметь дистиллированную воду и электролит с повышенной плотностью 1,4 г/см3.
Если приготовленный электролит имеет плотность ниже требуемой, то в него доливается не аккумуляторная кислота, а электролит с повышенной плотностью.
При необходимости понизить плотность в электролит доливают дистиллированную воду.
Для удобства составления электролита с требуемой плотностью приведена таблица:
| Плотность
электролита в аккумуляторе, г/см3 | Корректировка плотности электролита в объеме 1 л | ||||||||||
| До 1,25 г/см3 | До 1,27 г/см3 | До 1,29 г/см3 | До 1,31 г/см3 | ||||||||
| Количество отбираемого электролита | Добавки см3 | Количество отбираемого электролита | Добавки см3 | Количество отбираемого электролита | Добавки см3 | Количество отбираемого электролита | Добавки см3 | ||||
| Электролита плотностью 1,40 г/см3 | Дистилли- рованной воды | Электролита плотностью 1,40 г/см3 | Дистилли- рованной воды | Электролита плотностью 1,40 г/см3 | Дистилли- рованной воды | Электролита плотностью 1,40 г/см3 | |||||
| 1,24 | 61 | 62 | — | 173 | 175 | — | 252 | 256 | — | — | — |
| 1,25 | — | — | — | 118 | 119 | — | 215 | 219 | — | — | — |
| 1,26 | 39 | — | 40 | 65 | 66 | — | 174 | 180 | — | 290 | 294 |
| 1,27 | 78 | — | 80 | — | — | — | 122 | 124 | — | 246 | 249 |
| 1,28 | 117 | — | 120 | 40 | — | 42 | 63 | 64 | — | 198 | 201 |
| 1,29 | 157 | — | 161 | 75 | — | 78 | — | — | — | 143 | 145 |
| 1,30 | — | — | — | 109 | — | 113 | 36 | — | 37 | 79 | 81 |
| 1,31 | — | — | — | 143 | — | 148 | 72 | — | 76 | — | — |
| Примечание: плотность электролита увеличивается на 0,0007 г/см3 при понижении температуры на 1°С | |||||||||||
Как приготовить и залить электролит в автомобильный аккумулятор.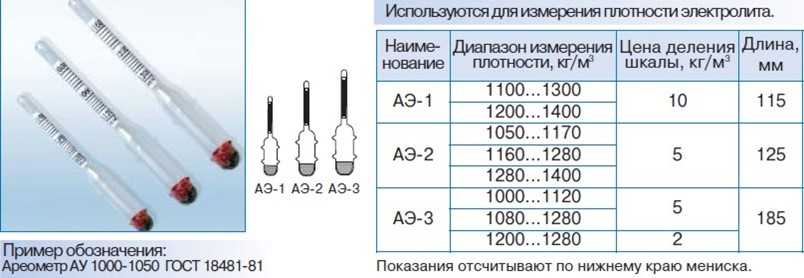 Простые правила.
Простые правила.
© Обслуживание автомобильных аккумуляторов — учебное пособие для самостоятельной подготовки специалиста
Ионы в воде и электропроводность
Ионы в воде и электропроводность
До сих пор мы имели дело с законом Ома и электропроводностью в целом и надеемся, что вы поняли его концепцию. Вы можете, однако, задаться вопросом, какое это имеет отношение к измерению электропроводности воды — настоящий вопрос с самого начала. Итак, мы подошли к основной теме.
Под потоком заряда до сих пор подразумевался электрический ток. Металл, например электрический провод, содержит большое количество свободных электронов. Эти электроны передают электрический ток от одного к другому, как шеренга людей, образующих бригаду ведер. Такой металл называется проводником.
Во-вторых, введем ионный проводник, электрический ток которого переносится ионами, например, раствором электролита.
Сейчас мы обсудим некоторые новые термины, которые появились. Когда определенное вещество растворяется в жидкости — воде в случае Твин — и если полученная таким образом жидкость может проводить электричество, такая жидкость называется раствором электролита, а растворенное вещество называется электролитом. И каждая корпускула, несущая электричество, называется ионом (греческое слово, означающее странник).
Когда определенное вещество растворяется в жидкости — воде в случае Твин — и если полученная таким образом жидкость может проводить электричество, такая жидкость называется раствором электролита, а растворенное вещество называется электролитом. И каждая корпускула, несущая электричество, называется ионом (греческое слово, означающее странник).
Поваренная поваренная соль (NaCl) является электролитом, и когда она растворяется в воде с образованием соленой воды, она превращается в ионы натрия (Na + ) и ионы хлорида (Cl — ), каждый из которых представляет собой корпускулу который проводит электричество.
Вернемся к проводимости. Электропроводность — это показатель того, насколько легко протекает электричество. В воде именно ионы передают электричество от одного к другому. Это означает, что чем больше Na + и Cl — содержится в воде, тем больше электричества переносится и тем выше проводимость.
Подводя итог, если мы знаем электропроводность образца соленой воды, мы можем рассчитать, насколько соленая вода. (Это то, что происходит при преобразовании солености для получения значения, отображаемого кондуктометром Twin.)
(Это то, что происходит при преобразовании солености для получения значения, отображаемого кондуктометром Twin.)
Соленость (плотность соли в соленой воде) и электропроводность
Температура жидкости 25°C IEEE J.Ocean.Eng., ОЕ-5(1),3~8(1980).
| Плотность NaCl (В/об) % | Электропроводность (мСм/см) | Плотность NACL (вес / цепь) % | Проводящий. |
|---|---|---|---|
| 0.3 | 5.7 | 1.3 | 22.4 |
| 0.4 | 7.5 | 1.4 | 24.0 |
| 0.5 | 9.2 | 1.5 | 25.6 |
| 0.6 | 10.9 | 1.6 | 27.1 |
| 0.7 | 12.6 | 1.7 | 28.6 |
| 0.8 | 14.3 | 1.8 | 30.1 |
0. 9 9 | 16.0 | 1,9 | 31,6 |
| 1,0 | 17,6 | 2,0 | 33,0 |
Сильные электролиты, с помощью Слабых Электрит. Некоторые из вас могут задаться вопросом, можно ли также измерить сахарную воду. К сожалению, кондуктометр не может определить плотность сахара в воде. Хотя сахар растворим в воде, он не образует ионов, а значит, не является электролитом. Только когда в воде образуются ионы, можно рассчитать плотность растворенного вещества по проводимости, измеренной с помощью кондуктометра.
Как и человек, электролит обладает множеством свойств. Электролиты можно условно разделить на сильные электролиты и слабые электролиты. Давайте потратим немного времени на эту тему.
Сильные электролиты
Соль содержит NaCl и KCl, которые при растворении в воде образуют электролиты, большая часть которых становится ионами. Зависимость между плотностью и проводимостью почти линейна. Однако, как видно на диаграмме, в отличие от зоны низкой плотности, в зоне высокой плотности не наблюдается увеличения проводимости при дальнейшем увеличении плотности. Наступает точка насыщения, мало чем отличающаяся от дорожной пробки, когда ионы взаимодействуют друг с другом, и это затрудняет протекание электричества.
Наступает точка насыщения, мало чем отличающаяся от дорожной пробки, когда ионы взаимодействуют друг с другом, и это затрудняет протекание электричества.
Слабые электролиты
В зоне очень низкой плотности проводимость имеет линейную зависимость от плотности, как это видно для органических кислот. Хорошим примером является раствор уксусной кислоты. Однако с увеличением плотности скорость ионизации уменьшается. В зоне высокой плотности ионизируется только часть электролита, и из-за переполненности большая часть потенциальных ионов остается растворенной в воде в виде молекул.
При ионизации CH 3 COOH становится CH 3 COO — и H + , но поскольку это слабый электролит, большая часть молекул остается CH 3 COOH. Другими словами, они хорошая пара. Когда ацетат натрия (CH 3 COONa) ионизируется, он превращается в ацетат ионов CH 3 COO — и ион натрия Na + , но, поскольку он является сильным электролитом, в отличие от ацетата, он проявляет разделение большинства его молекул. В отличие от ацетата, ацетат натрия похож на плохую пару.
В отличие от ацетата, ацетат натрия похож на плохую пару.
О моль/л (моль на литр): моль (обозначение единицы моль в системе СИ) — это одна из химических единиц, которую мы используем для выражения измеренного количества вещества. Число атомов или молекул в одном моле вещества равно константе Авогадро, которая имеет значение 6,022 х 10 23 . Поэтому единица плотности моль/л (моль на литр) показывает, какое количество вещества (в молях) растворено в 1 л раствора.
История электропроводности
Алессандро Вольта был физиком, родившимся в Италии в 1745 году. Он стал известен в 1800 году как изобретатель первой электрической батареи. В отличие от фрикционных батарей, известных до того времени, батарея Вольта обеспечивала непрерывный электрический ток и была одним из величайших изобретений века. Это достижение Вольта проложило путь таким, как Георг Ом, немецкий физик, измеривший проводимость металлов и в 1827 году открывший знаменитый теперь закон Ома.
Майкл Фарадей родился в 179 г.1, сын английского кузнеца. В 13 лет он стал учеником переплетчика, что дало ему доступ ко многим книгам. В 1833 году он стал ассистентом профессора Дэвиса в Королевской исследовательской лаборатории. Он проделал выдающуюся работу в области химии и физики, а в 1833 году сформулировал закон электролиза и представил ион состоящим из корпускул, которые передают электричество в растворе.
Электропроводность электролитов была энергетически измерена Фридрихом Кольраушем из Германии в 1869 г.и 1880. Говорят, что он начал измерять проводимость как средство получения ионного продукта. Мост Кольрауша, изобретенный им в то время для измерения электропроводности, хорошо известен и сегодня.
| A. Volta | (Italy) | 1745-1827 |
|---|---|---|
| G. Ohm | (Germany) | 1787-1854 |
| M. Faraday | (England) | 1791-1867 |
F. Kohlrausch Kohlrausch | (Германия) | 1840-1910 |
Отдел технологий водорода и топливных элементов
В этих таблицах перечислены технические цели Министерства энергетики США (DOE) для компонентов топливных элементов с мембраной из полимерного электролита (PEM): мембранно-электродных сборок, мембран, электрокатализаторов и биполярных пластин. Эти цели были разработаны при участии партнерства U.S. DRIVE, в которое входят автомобильные и энергетические компании и, в частности, техническая группа по топливным элементам. Цели компонентов руководства разработаны, чтобы помочь разработчикам компонентов оценить прогресс без тестирования всей системы.
Дополнительную информацию о целях можно найти в разделе «Топливные элементы» Многолетнего плана исследований, разработок и демонстраций Управления технологий топливных элементов.
Technical Targets: Membrane Electrode Assemblies for Transportation Applications
| Characteristic | Units | 2015 Status | 2020 Targets |
|---|---|---|---|
| Cost a | $/kW net | 17 b | 14 |
| Durability with cycling | hours | 2,500 c | 5,000 d |
| Start-up/shutdown durability e | cycles | – | 5000 |
| Производительность @ 0,8 В F | MA/CM 2 | 240 G | 300 |
| PERFEMAT0015 h (150 kPa abs ) | mW/cm 2 | 810 i | 1,000 |
| Robustness (cold operation) j | see footnote | 1. 09 k 09 k | 0,7 |
| Мощность (горячая операция) L | См. Сноска | 0,87 K | 0,7 |
| ROBUSTNESS (ROLD TRANSIT) | |||
| (ROLD TRANSIT) | |||
| (ROLD TRANSIT) | |||
| .0052 см. сноску | 0,84 k | 0,7 |
a Прогнозируемые затраты на крупносерийное производство (500 000 систем 80 кВт нетто в год).
b Затраты при производстве достаточного количества MEA для 500 000 систем в год. Отчет Министерства энергетики США по водороду и топливным элементам 15015, «Стоимость системы топливных элементов — 2015 г.». В стоимость входят все компоненты MEA, включая рамы и прокладки.
c Время до снижения напряжения на 10 % при 1,0–1,5 А/см 2 для МЭА Gore с катализатором 510 (загрузка анода/катода 0,2/0,4 мг PGM /см 2 ), работающего по протоколу испытаний на долговечность, приведенному в таблице P. 7. Род Боруп и Рангачари Мукундан (LANL), личное общение и презентация Ежегодного обзора заслуг за 2013 год. В других источниках сообщалось о более высоких значениях долговечности (например, 3900 часов при дорожных испытаниях, таблица 3.4.3), но эти более высокие значения не были измерены с использованием ездового цикла, указанного в таблице P.7.
7. Род Боруп и Рангачари Мукундан (LANL), личное общение и презентация Ежегодного обзора заслуг за 2013 год. В других источниках сообщалось о более высоких значениях долговечности (например, 3900 часов при дорожных испытаниях, таблица 3.4.3), но эти более высокие значения не были измерены с использованием ездового цикла, указанного в таблице P.7.
d Необходимость соответствия или превышения при температурах от 80°C до пиковой температуры. На основе кривой поляризации и протоколов испытаний на долговечность в таблице P.6 и таблице P.7, с падением номинальной мощности <10% после испытаний.
e Измерено в соответствии с протоколом, приведенным в таблице P.8, при снижении напряжения менее чем на 5 % при 1,2 А/см 2 .
f Измерено с использованием протокола кривой поляризации в таблице P.6.
г Kongkanand et al. (Дженерал Моторс), «Высокоактивные катализаторы на основе диаллоя», Годовой отчет о ходе работ за 2014 г.
h Измерено с использованием протокола поляризационной кривой в таблице P.6, но может использоваться любая температура вплоть до максимальной рабочей температуры с максимальной относительной влажностью на входе 40 %. Рабочая точка номинальной мощности зависит от температуры МЭБ и определяется как напряжение, при котором V = 77,6 / (22,1 + T[°C]), исходя из целевого значения Q/ΔTi = 1,45 кВт/°C и определения Q/ΔTi из Таблица 3.4.4, с аппроксимацией температуры МЭБ равной температуре теплоносителя на выходе из дымовой трубы.
i Поверхностная плотность мощности 810 мВт/см 2 при 150 кПа абс. и 1060 мВт/см 2 При 250 кПа абс. . А. Штейнбах и др. (3M), «Высокопроизводительные, долговечные и недорогие сборки мембранных электродов для транспортных приложений», Ежегодный обзор заслуг, 2014 г.
j Отношение напряжения при 30 °C к напряжению при 80 °C во время работы при 1,0 А/см 2 , измеренное с использованием протокола для поляризационной кривой, приведенного в таблице P. 6. Точка росы 25°C используется только для работы при 30°C.
6. Точка росы 25°C используется только для работы при 30°C.
k На основе испытаний, проведенных в LANL с использованием МЭА Gore с высокой катодной нагрузкой (0,1/0,4 мг PGM /см 2 анод/катод) и SGL GDL (25BC/25BC). Род Боруп, презентация группе специалистов по топливным элементам, 15 июля 2015 г. поляризационная кривая находится в таблице П.6. Точка росы 59°C используется как при 90°C, так и при 80°C.
м Отношение напряжения при 30°C в переходном режиме к напряжению при 80°C в установившемся режиме при 1,0 А/см 2 , измеренное с использованием протокола для поляризационной кривой, приведенного в таблице P.6. Точка росы 25°C используется только для работы при 30°C. Переходный режим при 30°C составляет 1 А/см 2 в течение не менее 15 минут, затем снижается до 0,1 А/см 2 в течение 3 минут без изменения рабочих условий. Через 3 минуты плотность тока возвращается к 1 А/см 2 . Напряжение измеряется через 5 секунд после возврата к 1 А/см 2 .
Технические цели: мембраны для транспортных применений
| Характеристика | 2015 Статус | 2020 Цели | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 2020 Мишни | |||||||||
| 2020 MALCHTS | |||||||||
| 2020 MALCHTS | |||||||||
| 2020. | 2,4 b | 2 | |||||||
| Максимальное пересечение водорода a | мА/см 2 | 0015 C | 2 | ||||||
| Специфическая устойчивость к протонам. ° C, 40 кПа) C | 0,02 | ||||||||
| 80 ° C и частичные давления воды от 25–45 кПа | Ом CM 2 | 0.027 (25 KPA) C | 0,027 (25 KPA) C | 0,027 (25 KPA) C | 0,027 (25 KPA) 2 | 0,027 (25 KPA) 2 | 0,027 (25 км) 2 | 0,027 (25 км)0016 | 0.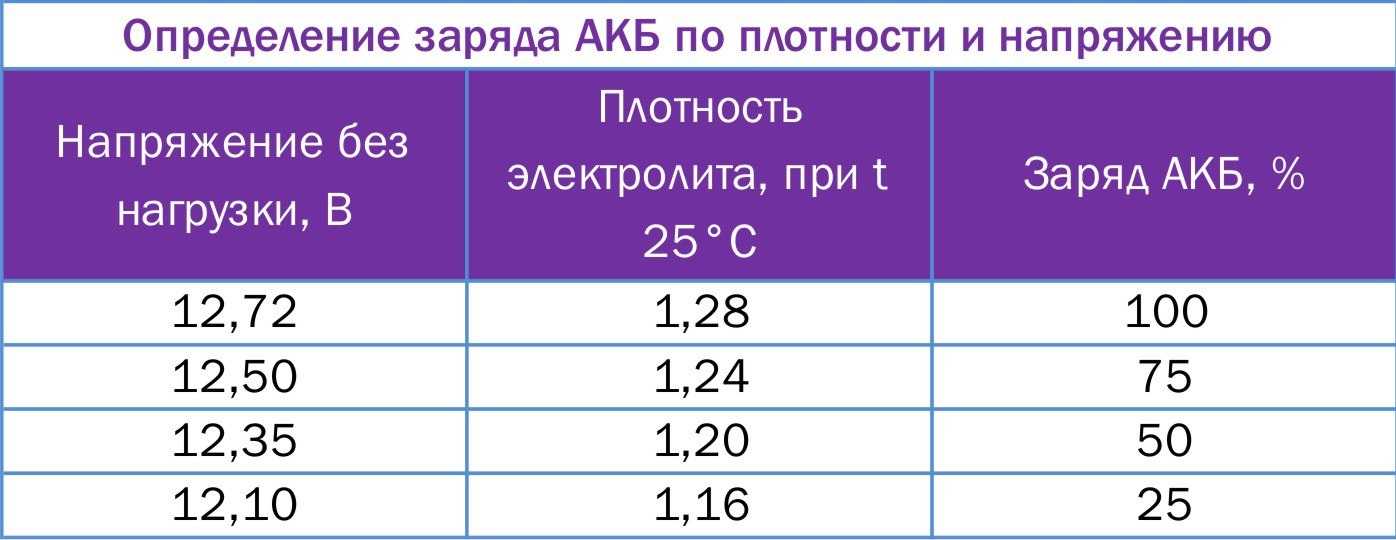 02 02 |
| 30°C and water partial pressures up to 4 kPa | ohm cm 2 | 0.027 (4 kPa) c | 0.03 | ||||||
| -20°C | ohm cm 2 | 0.1 b | 0.2 | ||||||
| Maximum operating temperature | °C | 120 c | 120 | ||||||
| Minimum electrical resistance | ohm cm 2 | >5,600 c | 1,000 | ||||||
| Cost d | $/m 2 | 17 e | 20 | ||||||
| Durability f | |||||||||
| МЕХАНИЧЕСКИЙ | Циклы до> 15 мА/см 2 H 2 .0052 20 000 | ||||||||
| ХИМИЧЕСКИЕ | часа до> 15 мА/см 2 или> 20% Потеря в OCV | 742 C | > 500 | ||||||
| > 500 | |||||||||
| > 500 | |||||||||
| > 500 | |||||||||
| > 500 | |||||||||
. 15 мА/см 2 Кроссовер или> 20% Потеря в OCV 15 мА/см 2 Кроссовер или> 20% Потеря в OCV | — | 20000 |
A Протестировано в MEA на O 2 или H 2 , 80174 2 или H 2 , 80174, 2 или H 2 , 80174, 2 или H 2 , 80174, 80175 или H 2 . , 1 атм полное давление. Для Н 2 методы испытаний, см. M. Inaba et. др. Electrochimica Acta, 51, 5746, 2006. О методах испытаний O 2 см. Zhang et. др. Journal of The Electrochemical Society, 160, F616-F622, 2013.
b Мембрана PFIA 14 мкм с опорой из нановолокна. М. Яндрасиц (3М), частное сообщение, 1 февраля 2016 г.
c Армированная и химически стабилизированная мембрана PFIA. М. Яндрасиц и соавт. (3M), Годовой отчет о ходе выполнения программы Министерства энергетики США по водороду и топливным элементам за 2015 год.
d Прогнозируемые затраты на крупносерийное производство (500 000 систем мощностью 80 кВт в год).
e Стоимость при производстве достаточного количества мембраны для 500 000 систем в год. Отчет Министерства энергетики США по водороду и топливным элементам 15015, «Стоимость системы топливных элементов — 2015 г.».
f Измерено в соответствии с протоколами в Таблице P.3, Таблице P.4 и Таблице P.5.
г Для испытаний воздухом или N 2 в качестве альтернативы можно использовать эквивалентный перекрестный показатель 0,1 см3/см 2 при перепаде давления 50 кПа, температуре 80ºC и относительной влажности 100 %.
Технические цели: электрокатализаторы для транспортных применений
| Характеристика | 2015 Состояние | 2020 Targets | |
|---|---|---|---|
| 2020 Targets | |||
2020. кВт (номинал, b брутто) при 150 кПа (абс.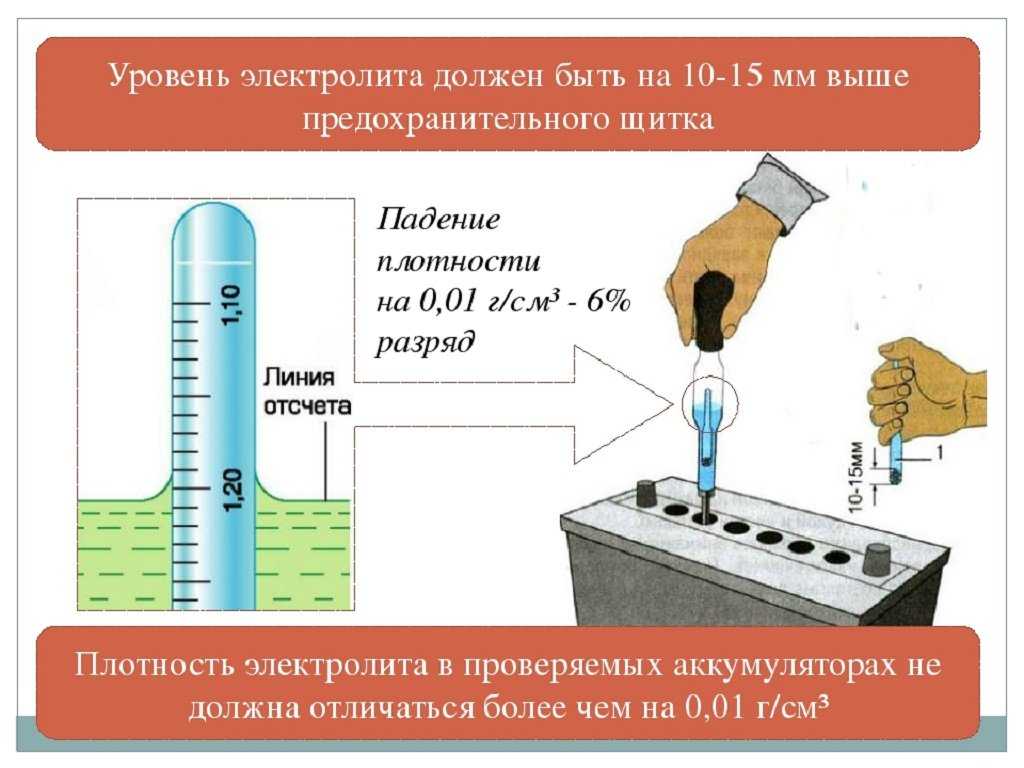 ) ) | 0,16 c,d | 0,125 | |
| Металл группы платины (PGM) общая нагрузка (оба электрода) a | mg PGM/cm 2 electrode area | 0.13 c | 0.125 |
| Mass activity e | A/mg PGM @ 900 mV IR-free | >0.5 F | 0,44 |
| Потеря в начальной каталитической активности E | % Потеря массовой активности | 66 C | <40 | 9008
| <40 | |||
| <40 | |||
| mV | 13 c | <30 | |
| Electrocatalyst support stability g | % mass activity loss | 41 h | <40 |
| Loss in performance at 1.5 A/cm 2 g | mV | 65 h | <30 |
| PGM-free catalyst activity | A/cm 2 @ 0. 9V Без ИК-излучения 9V Без ИК-излучения | 0,016 i | >0,044 j |
Система может иметь меньшую стоимость для достижения целей содержания и загрузки PGM.
b Рабочая точка номинальной мощности зависит от температуры МЭБ и определяется как напряжение, при котором V = 77,6 / (22,1 + T[°C]), исходя из целевого значения Q/ΔTi = 1,45 кВт/°C и определения Q/ΔTi из таблицы 3.4.4, с аппроксимацией температуры МЭБ равной температуре теплоносителя на выходе из дымовой трубы.
c Steinbach et al. (3M), «Высокопроизводительные, долговечные и недорогие сборки мембранных электродов для транспортных приложений», Ежегодный обзор заслуг, 2014 г.
d На основе полной мощности MEA при 150 кПа абс. Измерено при 0,692 В и 90°C, удовлетворяя Q/ΔT < 1,45 кВт/°C. При 250 кПа абс.состояние составляет 0,12 г/кВт.
e Измерено с использованием протокола в таблице P.1.
f Kongkanand et al. (General Motors), «Высокоактивные катализаторы на основе диаллоя», 2014 Annual Merit Review.
(General Motors), «Высокоактивные катализаторы на основе диаллоя», 2014 Annual Merit Review.
г Измерено с использованием протокола, приведенного в таблице P.2.
h Б. Попов и др., «Разработка катодных катализаторов со сверхнизким содержанием легированной платины для топливных элементов PEM», Ежегодный обзор заслуг, 2015 г.
i П. Зеленай (LANL), «Катоды топливных элементов из недрагоценных металлов: разработка катализатора и конструкция электродной структуры», Ежегодный обзор достижений 2016 г. мг PGM при 0,1 мг PGM /см 2 .
Технические цели: биполярные тарелки для транспортных применений
| Характеристика | 2015 Состояние | . b | 3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вес плиты | кг/кВт нетто | <0,4 c | 0,4 0,40035 | Пластина H 2 Коэффициент проникновения D | STD CM 3 /(SEC CM 2 PA) @ 80 ° C, 3 атмосфера, 100% RH | 0 E | ||||||
| Corrosion, anode g | µA/cm 2 | no active peak h | <1 and no active peak | |||||||||
| Corrosion, cathode i | мкА/см 2 | <0,1 C | <1 | |||||||||
| Электрическая проводимость | S/CM | > 100 J | > 100. 9005. 9005. 9005. 9008 9005. 9005. 9005. 9008 9008> 100 J | > 100 J | . 2 | 0,006 H | <0,01 | |||||
| Прочность на изгиб L | МПа | > 34 (углеродная пластина) M | >> 34 (углеродная пластина) M | > 34 (углерочная пластина) M | > 34.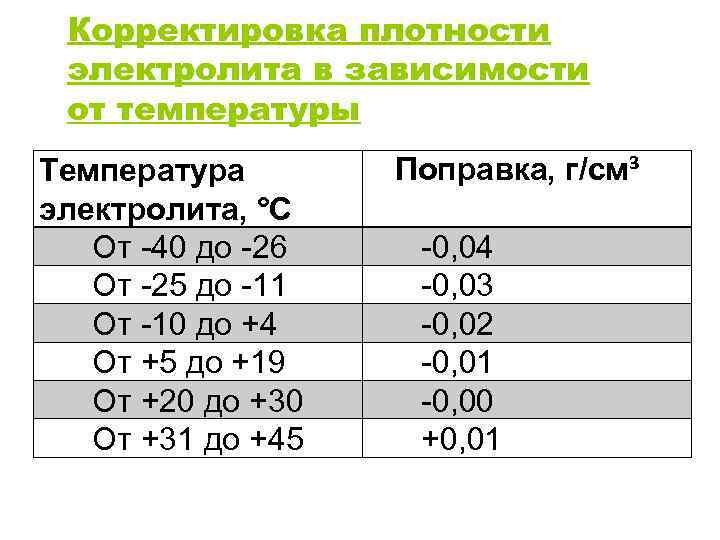 0053 0053 | |||||||
| Формирование удлинения N | % | 20–40 O | 40 |
. цель 1000 мВт/см 2 .
b Стоимость при производстве достаточного количества пластин для 500 000 систем в год. Отчет Министерства энергетики США по водороду и топливным элементам 15015, «Стоимость системы топливных элементов — 2015 г.».
с К.Х. Ван (Тредстоун), «Недорогие металлические биполярные пластины топливных элементов PEM», Годовой отчет о ходе работ за 2012 г.
d В соответствии со стандартными испытаниями на транспортировку газа (ASTM D1434).
и С.Х. Wang (Treadstone), частное сообщение, октябрь 2014 г.
f Blunk, et al., J. Power Sources 159 (2006) 533–542.
г pH 3 0,1 ppm HF, 80°C, пиковый активный ток <1x10 -6 А/см 2 (потенциодинамический тест при 0,1 мВ/с, от -0,4 В до +0,6 В (Ag/AgCl) ), деаэрированный с продувкой Ar.
h Кумар, М. Рикеттс и С. Хирано, «Оценка ex-situ золотого покрытия в нанометровом диапазоне на подложке из нержавеющей стали для биполярной пластины топливного элемента с мембраной из полимерного электролита для автомобилей», Journal of Power Sources 195 (2010): 1401 –1407, сентябрь 2009 г.
i pH 3 0,1 ppm HF, 80°C, пассивный ток <5x10 -8 А/см 2 (потенциостатическое испытание при +0,6 В (Ag/AgCl) в течение >24 ч, аэрированный раствор
j О. Адрианович (GrafTech), «Биполярные пластины следующего поколения для автомобильных топливных элементов PEM», 2009 г.Годовой отчет о проделанной работе.
k Включает межфазное контактное сопротивление (при получении и после потенциостатического испытания), измеренное с обеих сторон согласно Wang, et al. J. Power Sources 115 (2003) 243–251 при 200 фунтов на квадратный дюйм (138 Н/см 2 ).
l ASTM-D 790-10 Стандартный метод испытаний на изгиб неармированных и армированных пластиков и электроизоляционных материалов.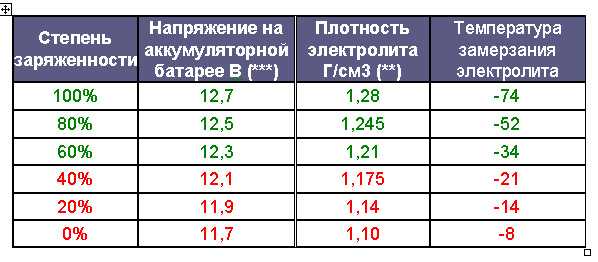

 -14 f
-14 f