Что такое щелочной электролит? Как произвести замену щелочного электролита?
Щелочной электролит – одна из основных составляющих щелочных аккумуляторов. Он имеет массу плюсов перед другими видами токопроводящих веществ.
Что же такое щелочной электролит, какими свойствами он обладает и как с ним работать, придется разобраться.
В первую очередь, это химическое соединение, которое активно участвует в накоплении аккумулятором электроэнергии. Щелочной электролит может многократно участвовать в восстановительно-окислительных реакциях без потери качества, благодаря своим свойствам.
Щелочной электролит встречается разного состава:
- Калиево-литиевый
- Натриевый
- Никель-кадмиевый
- Никель-металлогидридный
Натриевые электролиты обладают большим сроком эксплуатации, но обладают значительным минусом – невозможность использования при отрицательной температуре воздуха.
У калиево-литиевых обратная ситуация, они морозостойки, но непригодны для работы в жарких условиях, так как эксплуатационная температура у них ограничена до 35°С.
Никель-кадмиевые аккумуляторы обладают эффектом памяти, что налагает на их использование определенные ограничения.
У никель-металлогидридных аккумуляторов отсутствует эффект памяти, они способны работать как при низких, так и высоких температурах, но обладают высокой стоимостью, что препятствует их широкому распространению как портативного источника энергии.
Каждое из соединений, будь то калий, литий, натрий или едкий калий разбавляется с дистиллированной водой в нужной концентрации, в итоге, получается раствор-электролит для щелочи. По консистенции он жидкий и похож на обычную воду.
Щелочные электролиты считаются наиболее надежными и долговечными составляющими аккумуляторных батарей, но и минус у них есть – отсутствие возможности выдавать стартовый ток. В связи с этим в автомобильных аккумуляторах чаще встречаются именно кислотные электролиты.
Продлеваем срок службы щелочного электролита и аккумулятора!Стоит помнить про факторы, которые уменьшают срок службы щелочных электролитов:
- Неполная зарядка аккумулятора
- Меньшее количество электролита в сепараторе, чем необходимо
- Долгое использование электролита при высоких температурах
- Высокие температуры жидкости
Если стараться следить за этими моментами, то можно продлить срок службы аккумуляторной батареи в разы.
Для аккумуляторных батарей есть возможность замены щелочного электролита. Чаще всего необходимость замены возникает если аккумулятор перестает держать зарядку.
Порядок замены щелочного электролита следующий:
- Демонтируйте аккумуляторную батарею
- Поставьте ее в удобном для работы месть, без доступа для детей, сторонних лиц.
- Проводить замену щелочного электролита необходимо в защитной одежде, иметь при себе инструмент, для открытия крышки аккумулятора и щелочной электролит для залива, который можно приготовить и в домашних условиях.
- Произвести демонтаж крышки АКБ, залить электролит до необходимого уровня.
- Собрать аккумулятор в первоначальный вид, установить в оборудование.
- После смены электролита в щелочном аккумуляторе его необходимо зарядить в усиленном режиме.
Для аккумуляторной батареи существуют базовые правила зарядки, на которые всегда стоит ориентироваться, если вы хотите продлить срок его службы.
Щелочная аккумуляторная батарея – не требует слишком частого внимания. Если обеспечить её в полной мере, то можно она будет радовать бесперебойной работой в течении долгих лет и полностью оправдает свою цену.
Компания ООО «Курс» располагает широким ассортиментом щелочных аккумуляторов от таких производителей как «ВАЗ «Импульс» и «Завод автономных источников тока». Наши менеджеры проконсультируют Вас и помогут подобрать необходимые аккумуляторы и аккумуляторные батареи. Связаться с нами можно по бесплатному номеру 8 800 200 60 10.
Как восстановить аккумулятор в домашних условиях
Запуск автомобильных двигателей и других силовых установок осуществляется стартером, представляющим собой специальный электрический двигатель. Для создания пускового момента ему требуется электроэнергия, получаемая от внешнего источника – аккумуляторной батареи. Однако с течением времени в процессе эксплуатации у батареи могут возникнуть различные неисправности, и тогда у владельцев появляется вопрос, как восстановить аккумулятор. Эта задача решается различными способами, в зависимости от конструкции и технического состояния батареи, с использованием специального оборудования и инструмента.
Эта задача решается различными способами, в зависимости от конструкции и технического состояния батареи, с использованием специального оборудования и инструмента.
Содержание
Устройство кислотного аккумулятора
Основная функция аккумулятора состоит в кратковременной подаче мощного электропитания к стартеру, обеспечивающему запуск различных силовых установок. На короткое время АКБ снабжает электричеством все бортовые приборы до запуска двигателя, после чего питание к ним начинает вырабатываться генератором. Для автомобилей выпускаются устройства двух типов – кислотный и щелочной аккумулятор. Восстановительные мероприятия чаще всего касаются первого варианта, который и будет рассмотрен более подробно в качестве примера.
Все батареи имеют достаточно надежную конструкцию, но несмотря на это все равно случаются повреждения и неисправности из-за неправильного обслуживания или неаккуратной эксплуатации. Если кислотный аккумулятор старый, то ремонтировать его нет никакого смысла. Как правило восстановительные мероприятия проводятся в отношении сравнительно новых АКБ. Для этого нужно хорошо представлять конструкцию данных устройств.
Как правило восстановительные мероприятия проводятся в отношении сравнительно новых АКБ. Для этого нужно хорошо представлять конструкцию данных устройств.
Любая батарея помещается в закрытом пластиковом корпусе, из которого наружу выходят две клеммы плюса и минуса. Конструкция предполагает возможность обслуживания аккумулятора или же модель является необслуживаемой. В первом случае в верхней части корпуса имеются отверстия, закрывающиеся пробками. Во втором случае данные конструктивные элементы отсутствуют, за исключением одного небольшого отверстия, через которое отводятся газы. Подобные устройства обладают улучшенными характеристиками.
Внутреннее пространство корпуса разделено на 6 частей, называемых секциями или банками. Они заполнены рабочими элементами – свинцовыми пластинами с положительным или отрицательным значением, на которые нанесено активное вещество. Пластины аккумулятора располагаются поочередно таким образом, чтобы плюс чередовался с минусом. Между ними расположен сепаратор, исключающий возможность случайного соприкосновения. Пластины соединяются в общие блоки на каждом из которых установлена выводная перемычка, соединенная с мостом. Таким образом, все элементы соединяются в единый мост и выводятся на клеммы.
Пластины соединяются в общие блоки на каждом из которых установлена выводная перемычка, соединенная с мостом. Таким образом, все элементы соединяются в единый мост и выводятся на клеммы.
Принцип работы АКБ
Образование и передача электроэнергии в АКБ осуществляется путем химических реакций. С этой целью в каждую банку заливается электролит, представляющий собой раствор, в котором в строго определенных дозах смешаны кислота и дистиллированная вода.
Аккумулятор не может самостоятельно вырабатывать электроэнергию, он лишь получает ее из посторонних источников и сохраняет в течение определенного времени. В процессе зарядки электричество поступает на клеммы, после чего происходит его преобразование в химическую энергию. Разряжаясь, батарея вступает в обратный процесс, когда химическая энергия превращается в электрический ток.
Когда к аккумулятору подключается нагрузка, начинается реакция между губчатым свинцом, расположенным на отрицательных пластинах, двуокисью свинца с положительной пластины и электролитом. В результате происходит высвобождение электроэнергии, которая затем и используется по назначению. В это же время отрицательные пластины покрываются слоем сульфата свинца. Во время зарядки АКБ весь процесс происходит в обратной последовательности, после чего сульфат оказывается растворенным в электролите, а положительные пластины покрываются слоем диоксида свинца.
В результате происходит высвобождение электроэнергии, которая затем и используется по назначению. В это же время отрицательные пластины покрываются слоем сульфата свинца. Во время зарядки АКБ весь процесс происходит в обратной последовательности, после чего сульфат оказывается растворенным в электролите, а положительные пластины покрываются слоем диоксида свинца.
Основные неисправности батареи
Положительные и отрицательные пластины аккумулятора помещаются в закрытую пластмассовую емкость, внутрь которой заливается электролит, представляющий собой раствор соляной кислоты. Совместно со свинцовыми пластинами он образует так называемую гальваническую пару. К клеммам поступает ток от генератора или зарядного устройства. Когда он накапливается в достаточном количестве, аккумулятор сам превращается в источник электричества.
Потери электроэнергии, затраченной на пуск и другие нужды, восполняются с помощью генератора. Однако через определенное время накопленных запасов становится недостаточно для нормальной работы. В процессе эксплуатации наступает старение пластин. В отдельных случаях батарею можно реанимировать. Но для этого нужно вначале точно установить причину нерабочего состояния аккумулятора, чтобы восстановить АКБ автомобиля в домашних условиях.
В процессе эксплуатации наступает старение пластин. В отдельных случаях батарею можно реанимировать. Но для этого нужно вначале точно установить причину нерабочего состояния аккумулятора, чтобы восстановить АКБ автомобиля в домашних условиях.
Чаще всего батарея выходит из строя из-за сульфатации свинцовых электродов. В случае глубокой разрядки кристаллы не успевают раствориться. Кроме того, сульфатация возникает по причине регулярной недостаточной зарядки и продолжительного хранения АКБ в состоянии полной разрядки. Она легко определяется визуально, достаточно всего лишь открутить пробки и взглянуть на пластины, покрытие светло-коричневым налетом.
В других случаях при наличии сульфатации батарея начинает быстро закипать при зарядке, при полной зарядке она не вращает двигатель стартера и садится в течение нескольких минут даже под самой незначительной нагрузкой. Корпус покрывается белым налетом и вернуть первоначальное состояние уже проблематично.
Другая широко известная причина неисправности АКБ заключается в разрушении пластин и их дальнейшем осыпании. Основным внешним признаком является черный цвет электролита. В случае разрушения многих решеток ремонт такого аккумулятора становится невозможным и восстановлению он уже не подлежит.
Основным внешним признаком является черный цвет электролита. В случае разрушения многих решеток ремонт такого аккумулятора становится невозможным и восстановлению он уже не подлежит.
Неисправность батарей нередко связана с замыканием пластин, расположенных рядом. Они деформируются или осыпаются, а на дне корпуса образуется осадок, вызывая замыкание одной из секций. В этом случае электролит в данной банке при зарядке не закипает, или кипение наступает очень медленно. Напряжение вообще не растет или поднимается крайне слабо. В этом случае неизвестно, можно ли вернуть устройство в начальное состояние.
Иногда аккумулятор выходит из строя по причине замерзания электролита. Это случается, когда батарея находится на морозе в состоянии сильной разрядки. Если корпус разорван льдом, то и пластины скорее всего тоже деформировались и замкнулись. При целом корпусе батарею следует разморозить в теплом месте и затем попытаться решить задачу, как восстановить аккумулятор.
Перед началом ремонта корпус нужно очистить. С его поверхности удаляется грязь, после чего он промывается содовым раствором с целью нейтрализации электролита. Клеммы очищаются от налета средней наждачной бумагой. Иногда после очистки клемм батарея сразу же частично восстанавливает свою работоспособность.
С его поверхности удаляется грязь, после чего он промывается содовым раствором с целью нейтрализации электролита. Клеммы очищаются от налета средней наждачной бумагой. Иногда после очистки клемм батарея сразу же частично восстанавливает свою работоспособность.
Десульфатация методом КТЦ
В результате сульфатации на поверхностях пластин оседает сернокислый свинец, препятствующий проникновению электролита в глубину активной массы. По этой причине какая-то часть массы уже не принимает участия в химической реакции. Поэтому в АКБ наблюдается рост внутреннего сопротивления, из-за чего емкость падает. Аккумулятор не может полностью зарядиться и очень быстро теряет набранный заряд.
Одним из основных методов решения проблемы, как восстановить автомобильный аккумулятор, считается контрольно-тренировочный цикл, с помощью которого сульфатация может быть ликвидирована на ранней стадии, а емкость АКБ восстановлена. Суть метода состоит в зарядке и разрядке, которые выполняются единым циклом. Необходимо заранее подготовить зарядное устройство, вольтметр, ареометр, потребитель в качестве нагрузки и можно восстанавливать работоспособность.
Необходимо заранее подготовить зарядное устройство, вольтметр, ареометр, потребитель в качестве нагрузки и можно восстанавливать работоспособность.
Вначале батарея полностью заряжается. Для этого используется сила тока, составляющая 10% от номинальной ёмкости АКБ. То есть, батарее на 60 ампер-часов потребуется ток, силой 6 ампер. По окончании зарядки выполняется проверка плотности электролита во всех банках, который в норме должен быть 1,27. Если показатель меньше номинала, необходимо поднять плотность до нужного уровня и еще полчаса заряжать батарею для перемешивания электролита.
Далее выполняется контрольная разрядка при помощи нагрузки, подключенной к клеммам. При этом потребляемая электроэнергия составляет не более 10% от емкости аккумулятора. В процессе разрядки выполняются периодические замеры напряжения, которое должно снизиться на клеммах до 10,2В. Данный показатель соответствует полному разряду устройства. Одновременно нужно следить за временем разрядки. Новой батарее для этого требуется примерно 10 часов. Меньшее время разрядки соответствует большей потере емкости АКБ. Таким образом, решается задача, как восстановить аккумулятор автомобиля.
Меньшее время разрядки соответствует большей потере емкости АКБ. Таким образом, решается задача, как восстановить аккумулятор автомобиля.
Аккумулятор не должен оставаться разряженным слишком долго. После полного разряда он должен быть сразу же поставлен на зарядку до тех пор, пока заряд полностью не восстановится. В результате этой операции ёмкость восстанавливается, а внутреннее сопротивление батареи снижается после понижения сульфатации.
Замена электролита
Иногда электролит, содержащийся в банках, становится мутным и приобретает черный цвет. В этом случае требуется его замена. Подобное состояние характерно для коротких замыканий или старых аккумуляторов, которые не использовались в течение длительного времени. Одним из способов восстановления аккумулятора автомобиля, считается замена электролита.
Испорченную жидкость нужно слить путем вытягивания ее резиновой грушей. Откачивать электролит рекомендуется не только с испорченной, но и со всех остальных банок.
В пустые банки заливается дистиллированная вода, после этого корпус АКБ нужно немного покачать и выполнить слив. Переворачивать батарею нельзя, иначе частички осадка могут застрять между пластинами. Процедура повторяется неоднократно, пока сливаемая вода не будет чистой.
Переворачивать батарею нельзя, иначе частички осадка могут застрять между пластинами. Процедура повторяется неоднократно, пока сливаемая вода не будет чистой.
Далее выполняются следующие действия:
- Заливается электролит с плотностью 1,28 и отстаивается в течение суток, пока изнутри не выйдет весь воздух.
- Зарядка током силой 0,1 А пока плотность полностью не восстанавливается. Электролит не должен сильно кипеть, а корпус – сильно нагреваться. Если нужно, зарядка прерывается, чтобы жидкость остыла. Батарея должна зарядиться до 14-15 вольт.
- После проверки показаний ареометра, ток уменьшается и остается еще на 2 часа. Если плотность за это время осталась на прежнем уровне, зарядку можно прекратить.
С помощью тока 0,5 ампер старый аккумулятор разряжается до 10 вольт. При достижении напряжением этой отметки менее чем за 8 часов следует повторить весь предыдущий цикл. Если же все в норме, батарея заряжается до своего номинального значения.
Как восстановить аккумулятор своими руками
youtube.com/embed/qTk4iHJYHcQ?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Обзор самодельных батареек
дополнительное оборудование: лимон, медная монета, цинковая шайба, пластиковая трубка для монет, поводки из кожи крокодила
предметы: химия, инженерия, физика
ключевые слова: батарейка, химия, лимон, кокс
Читатели, не знакомые с тем, как работают батареи, могут захотеть просмотреть наш краткий урок по основам работы с батареями, прежде чем начать этот урок.
Работа от батареи
Для работы простой батареи требуются три детали: два электрода из разных материалов (обычно металлов) и электролит (обычно жидкость с ионами в растворе), который вступает в реакцию с электродами.
Батарея работает, когда один из электродов (анод) растворяет положительно заряженные ионы в электролите, оставляя после себя избыточные электроны. Этот процесс оставляет анод с отрицательным зарядом. Если затем подключить провод от анода к другому электроду (катоду), избыточные электроны будут течь по проводу, пока они не будут равномерно распределены по двум электродам. Этот поток электронов через провод обеспечивает электрический ток. Со стороны катода прибывающие туда электроны отрываются от катода и реагируют с ионами в электролите, расчищая путь для растворения большего количества анода и поступления большего количества электронов к катоду.
Этот процесс оставляет анод с отрицательным зарядом. Если затем подключить провод от анода к другому электроду (катоду), избыточные электроны будут течь по проводу, пока они не будут равномерно распределены по двум электродам. Этот поток электронов через провод обеспечивает электрический ток. Со стороны катода прибывающие туда электроны отрываются от катода и реагируют с ионами в электролите, расчищая путь для растворения большего количества анода и поступления большего количества электронов к катоду.
Этот процесс продолжается до тех пор, пока анод продолжает растворяться, и пока электролит продолжает реагировать с побочными продуктами и нейтрализовать их. В конце концов, либо анод, либо электролит заканчиваются (или электроды покрываются грязью в результате вторичных реакций), и батарея перестает работать.
Материалы и характеристики батареи
Напряжение батареи зависит исключительно от химических реакций и, следовательно, от выбора материалов. При высоком напряжении анод должен сильно реагировать с электролитом, а катод должен быть как можно слабо инертным. Обычные материалы для самодельных электродов включают цинк, алюминий, медь и сталь. Электролит часто представляет собой слабую кислоту (например, лимонную, уксусную или фосфорную) или раствор соленой воды. Цинк обычно легче всего растворяется в этих электролитах и лучше всего подходит для материала анода, хотя алюминий также работает при несколько более низком напряжении. Медь и нержавеющая сталь являются хорошими катодами и обычно ведут себя одинаково, при этом нержавеющая сталь лишь немного менее реактивна в некоторых кислотах. Среди этих материалов самое высокое напряжение достигается с цинком, нержавеющей сталью и фосфорной кислотой, которые могут дать около 1,2 вольта.
Обычные материалы для самодельных электродов включают цинк, алюминий, медь и сталь. Электролит часто представляет собой слабую кислоту (например, лимонную, уксусную или фосфорную) или раствор соленой воды. Цинк обычно легче всего растворяется в этих электролитах и лучше всего подходит для материала анода, хотя алюминий также работает при несколько более низком напряжении. Медь и нержавеющая сталь являются хорошими катодами и обычно ведут себя одинаково, при этом нержавеющая сталь лишь немного менее реактивна в некоторых кислотах. Среди этих материалов самое высокое напряжение достигается с цинком, нержавеющей сталью и фосфорной кислотой, которые могут дать около 1,2 вольта.
Труднее предсказать максимально доступный ток батареи. Это зависит не только от используемого химического состава, но также от размера и близости электродов, а также от концентрации электролита. Более крупные и близкие электроды с более концентрированным электролитом дают более высокие токи.
Емкость аккумулятора определяется размером. Большие электроды с большими объемами и концентрациями электролита служат дольше, при условии, что электроды не загрязняются до того, как закончатся основные химические вещества.
Большие электроды с большими объемами и концентрациями электролита служат дольше, при условии, что электроды не загрязняются до того, как закончатся основные химические вещества.
В таблицах 1 и 2 перечислены распространенные источники электродных металлов и электролитов.
| Electrode | source |
|---|---|
| zinc | zinc-coated or galvanized machine bolts or washers |
| aluminum | drink cans, foil |
| copper | wires, plumbing pipe, pennies , кровельные гвозди |
| нержавеющая сталь | крепежные болты или шайбы, |
| ЭЛЕКТРОЛИТ | Источник | |
|---|---|---|
| Ликовая кислота (C 6 H 8 O 7 ) | Lemon, LIME, Orange, GRAPERITH, GRAPERITH, GRAPERUIT, GRAPIRIT, LIME, GRANEFIRIT, TOMATRIT. 3 COOH) 3 COOH) | уксус (от 4% до 8% уксусной кислоты), соленья |
| phosphoric acid (H 3 PO 4 ) | some soft drinks (e.g. Coke), potatoes | |
| salt water | tap water and table salt (NaCl) |
кредит
Рис. 1: Аккумулятор, изготовленный из алюминиевой полосы от банки из-под безалкогольных напитков, куска медного провода заземления и стакана кока-колы. Выдает 0,75 вольта и максимум около 3 мА.
кредит
Рис. 2: Три лимонных батарейки, соединенные последовательно со светодиодом. В каждой батарее используется цинковая шайба для анода и пенни для катода. Вместе три батареи производят чуть более 2,5 вольт и максимум около 0,1 мА.
кредит
Рис. 3: Вольтова стопка из стопки монет, цинковых шайб и бумажных наклеек, пропитанных уксусом. Стопка размещена в пластиковой трубке для монет, которая используется нумизматами. Двадцать элементов уложены друг на друга для получения 15 вольт и максимального тока около 0,2 мА.
Стопка размещена в пластиковой трубке для монет, которая используется нумизматами. Двадцать элементов уложены друг на друга для получения 15 вольт и максимального тока около 0,2 мА.
кредит
Рис. 4: В концах трубки просверлены отверстия для доступа к концам батареи. Скрепки вставляются, как показано, для выполнения соединения.
примеры самодельных батарей
батарея из банок из-под кока-колы
На рис. 1 показана батарея, состоящая из куска толстого медного заземляющего провода, полоски алюминия от банки из-под газировки и стакана кока-колы. Алюминий разрезали ножницами по металлу, а затем отшлифовали, чтобы удалить краску. Как показывает вольтметр, эта батарея обеспечивает около 3/4 вольта. При минимальном сопротивлении в цепи он может выдавать примерно до ?? мА тока. 9+ ⇒ H_2 (газ)}$$
После того, как батарея поработает некоторое время, на медном катоде могут образовываться пузырьки водорода.
лимонная батарейка (и другие продукты)
Электролит не обязательно должен быть в стакане. Сок внутри лимона содержит лимонную кислоту, которая сама по себе является хорошим электролитом. Разрежьте лимон на две параллельные дольки, вставьте в один из них монетку, а в другой — цинковую шайбу, и у вас получится батарея с питанием от лимона, обеспечивающая напряжение около 1,0 вольта. На рис. 2 показаны три такие батареи, соединенные последовательно для питания светодиода.
Другие цитрусовые (лаймы, апельсины, грейпфруты, мандарины, помидоры) действуют так же хорошо. Картофель (который содержит фосфорную кислоту) и соленые огурцы (которые содержат уксусную кислоту в уксусе) можно заменить.
простая гальваническая свая
Кусок бумаги или картона, пропитанный уксусом и зажатый между монетой и цинковой шайбой, образует батарею, которая может обеспечить около 0,5 вольт. Укладка многих из этих аккумуляторных элементов последовательно, один поверх другого, создает «гальваническую кучу». На рис. 3 показаны 20 таких аккумуляторных элементов, уложенных друг на друга внутри пластиковой трубки типа той, что используется нумизматами. В торцах корпуса просверлены небольшие отверстия, чтобы обеспечить доступ к концам батареи. Как показывает вольтметр, куча генерирует около 15 вольт.
На рис. 3 показаны 20 таких аккумуляторных элементов, уложенных друг на друга внутри пластиковой трубки типа той, что используется нумизматами. В торцах корпуса просверлены небольшие отверстия, чтобы обеспечить доступ к концам батареи. Как показывает вольтметр, куча генерирует около 15 вольт.
Еще более компактную батарею можно сделать из одних копеек, без цинковых шайб. В 1982 году состав пенни США изменился с 95% меди с 5% цинка на 97,5% цинка с 2,5% медным покрытием. Взяв пенни, отчеканенный после 1982 года, и отшлифовав медь с одной стороны (для этой операции вам может понадобиться механическая шлифовальная машина), вы можете создать сэндвич из меди и цинка, который идеально подходит для гальванической сваи. Просто сложите отшлифованные пенни с картоном, пропитанным уксусом.
водяные батареи 9-$, которые были удалены на аноде, тем самым сохраняя баланс заряда в этой области. С добавлением соли водяная батарея может работать так же хорошо, как упомянутые выше кислотные батареи.

дополнительные ресурсы
Вас беспокоит мнение дяди Сэма об использовании американской валюты для научных экспериментов? Прочтите официальное сообщение по этому вопросу на https://www.federalregister.gov/articles/2007/04/16/E7-7088/prohibition-…, в котором говорится:
«Регламент включает исключение для лечения 5-центовых и одноцентовых монет для образовательных, развлекательных, новаторских, ювелирных и подобных целей, при условии, что рассматриваемые объемы и характер обработки ясно дают понять, что такое обращение не предназначено как средство для получения прибыли исключительно от стоимости металлического содержания монет».
- 1. В стандартной терминологии батарея с одной парой электродов называется «ячейкой». Более чем одна ячейка, соединенная последовательно, становится «кучей» или просто «батареей». Большинство стандартных аккумуляторов малой грузоподъемности представляют собой отдельные элементы в диапазоне от 1 до 3 вольт, в то время как большинство автомобильных аккумуляторов состоят из шести свинцово-кислотных элементов (около 2 вольт каждый), соединенных последовательно для получения 12 вольт.

Разряжен аккумулятор автомобиля? Дай ему 12 таблеток аспирина и будь дома к утру. . .
Включает партнерские ссылки, которые помогают компенсировать наши расходы бесплатно для вас.
«Мёртв, он мёртв», — говорит ваш злой друг-выживальщик.
«Что умерло?» — спрашиваете вы, все еще в хорошем настроении после спуска со скалы.
«Батарея разряжена», — добавляет он с явным разочарованием. «Мы в чертовых 14 милях от ниоткуда, а джип не заводится».
«Не возите с собой запасной аккумулятор в BOB*». (Prepper TLA* для «Bug Out Bag» *TLA — «Three Letter Acronym»)
«Вы не можете — это слишком тяжело!! Разве вы не троллите форумы по выживанию, чтобы узнать об этом?», — говорит он с очевидным авторитетом во всем, что связано с «интернетом».
Вы обдумываете его вопрос, затем с видом любопытства спрашиваете: «Я думал, вы, ребята, готовы ко всему и даже проверили свое снаряжение, прежде чем выйти из дома? Как насчет переносного пускового устройства?
«Не принес! Черт возьми, я должен быть дома до полуночи, а это 6 часов езды!», — умоляет он.
«Хорошо, хорошо — как насчет банки кока-колы и бутылки аспирина, Преп, это у тебя есть?», — наконец спрашиваете вы.
«Давай! Для чего это?»
«У меня будет головная боль, если ты не заткнешься, но я думал, что починю батарею», — возразите вы.
Он смотрит на вас с идеальным балансом разочарованного инь и благоговейного яна, затем поворачивается и уходит вразвалку, визжа высокочастотными ругательствами.
«Хорошо, — тихо говорите вы, — я сам найду». Вы подходите к задней части джипа, высвобождаетесь из страховочной привязи и бросаете ее на огромную кучу снаряжения. Затем вы поддеваете верхнюю часть холодильника и вытаскиваете оттуда банку кокса. Вы погружаете руку в груду снаряжения и извлекаете маленькую аптечку. Вы расстегиваете комплект, находите полную бутылку просроченного аспирина и шепчете: «Отлично».
Подойдя к передней части Машины, вы замечаете, что Преп вернулся. Он говорит: «Ты самый неподготовленный придурок, которого я когда-либо встречал». Ты улыбаешься и открываешь капот. Вы просите Препа достать отвертку и пару острогубцев.
Ты улыбаешься и открываешь капот. Вы просите Препа достать отвертку и пару острогубцев.
Во-первых, вы проверяете соединение зажимов батареи со стойкой, чтобы убедиться в хорошем соединении и отсутствии коррозии. Они тугие, но довольно ржавые. Вы открываете банку с кока-колой, делаете глоток, а затем выливаете его на зажимы и столбы аккумулятора.
Так выглядит процесс. . .
Преп возвращается с инструментами, вы смотрите на него с понимающей улыбкой. Он гримасничает и смотрит на шипящую массу, пока тает ржавчина со стоек и хомутов. Вы проверяете зажимы на наличие трещин или повреждений. Они выглядят нормально.
Теперь вам нужно заставить аккумулятор вырабатывать достаточное количество вольт и ампер для запуска автомобиля. К счастью, у вас есть подходящий инструмент для этого. Этот инструмент ничего не весит, он обеспечивает свое техническое обслуживание и улучшения, часто добавляется сам и является более ценным, чем любое другое снаряжение, которое вы носите с собой. . . знания.
К счастью, у вас есть подходящий инструмент для этого. Этот инструмент ничего не весит, он обеспечивает свое техническое обслуживание и улучшения, часто добавляется сам и является более ценным, чем любое другое снаряжение, которое вы носите с собой. . . знания.
Давайте вспомним, что мы знаем о батареях.
Батарея создается, когда два разных металлических или углеродных стержня (называемых электродами) помещаются в электропроводящую среду (называемую электролитом). Воткните монетку (цинк с медным покрытием) и никель (сплав никеля и меди) в лимон, и у вас есть батарейка. Поместите медный провод и алюминиевый провод в банку с мочой, и вы получите батарейку. Это вы знаете из изучения концепции батареи в 8-м классе естественных наук.
Преп теперь смотрит на вас с нетерпением и любопытством. Вы обдумываете свою ситуацию, попивая кокаин.
Различные металлы реагируют с разной скоростью (т. е. создают заряженные частицы) с электролитом. Это означает, что один электрод будет отдавать электроны быстрее, чем другой, создавая дисбаланс распределения заряда в электролите. Кусочки заряженного электролита перемещаются от одного электрода к другому (в направлении от положительного к отрицательному), чтобы устранить этот дисбаланс. Когда эти заряженные частицы вступают в контакт с отрицательным электродом, они отдают свои электроны, и создается электричество. Когда это происходит, свинцовые электроды становятся более химически похожими, электролит становится менее активным, и напряжение падает до тех пор, пока батарея больше не может обеспечивать необходимое напряжение. Стимулирование электролита с помощью какой-либо добавки добавляет химическую энергию в систему и может обеспечить кратковременный прирост энергии в батарее. Подача электрического тока обратно в аккумулятор восстанавливает химическую разницу между электродами и перезаряжает аккумулятор (это работает не для всех аккумуляторов, но работает для автомобильных аккумуляторов).
Кусочки заряженного электролита перемещаются от одного электрода к другому (в направлении от положительного к отрицательному), чтобы устранить этот дисбаланс. Когда эти заряженные частицы вступают в контакт с отрицательным электродом, они отдают свои электроны, и создается электричество. Когда это происходит, свинцовые электроды становятся более химически похожими, электролит становится менее активным, и напряжение падает до тех пор, пока батарея больше не может обеспечивать необходимое напряжение. Стимулирование электролита с помощью какой-либо добавки добавляет химическую энергию в систему и может обеспечить кратковременный прирост энергии в батарее. Подача электрического тока обратно в аккумулятор восстанавливает химическую разницу между электродами и перезаряжает аккумулятор (это работает не для всех аккумуляторов, но работает для автомобильных аккумуляторов).
Большинство автомобильных аккумуляторов являются «свинцово-кислотными». Свинцово-кислотные аккумуляторы состоят из пластин из свинца и отдельных пластин из диоксида свинца, которые погружены в раствор электролита, состоящий примерно из 38% серной кислоты и 62% воды. Это вызывает химическую реакцию, которая высвобождает электроны, позволяя им течь по проводникам для производства электричества.
Это вызывает химическую реакцию, которая высвобождает электроны, позволяя им течь по проводникам для производства электричества.
Вы смотрите на Препа решительным взглядом: «Все, что нам нужно сделать, это заменить кислоту в батарее, чтобы она вступала в реакцию со свинцом и создавала электричество, верно?»
Подготовительный говорит: «Конечно».
Вы продолжаете думать вслух: «Итак, для перезарядки батареи нужно либо найти способ стимулировать электролит, либо найти способ вернуть электричество в батарею».
Преп говорит: «Наверное, да?»
«Мы могли бы налить в аккумулятор немного колы. Запустите автомобиль через несколько минут. Конечно, вам придется заменить батарею, потому что мы ее уничтожили, но по крайней мере к полуночи вы будете дома».
Преп говорит: «Это старая батарея, это не имеет большого значения. Но разве нам не понадобится аккумулятор для работы джипа, пока мы не купим новый?»
«Ах да, Старая Приготовительная, это может быть проблемой»
Вы продолжаете: «Можем. . . Удалите жидкость из аккумулятора. Выжми дюжину лаймов в батарею».
. . Удалите жидкость из аккумулятора. Выжми дюжину лаймов в батарею».
«У нас нет лаймов», добавляет Преп. «Правильно», — отвечаете вы.
«Мы также могли пить газировку и мочиться в батарею. Заполните оставшуюся часть батареи водой. Подождите 9 часов и вставьте аккумулятор обратно».
«Должен быть дома через 12 часов — 6 часов в пути», — отвечает Преп. «Правильно», — подтверждаете вы.
«Слюна, рассол картофельных чипсов, перекись водорода — теоретически все работает», — упоминаете вы.
Хотя в теории все это работает, у этого базового подхода есть три недостатка.
- Хотя «теория верна», на практике она обычно не работает по разным причинам. Основная причина – соблюдение пропорций.
- Вы можете попробовать их, но если они не работают, вы, вероятно, испортили аккумулятор и устранили любую другую возможность завести автомобиль.
- Некоторые предложенные добавки могут привести к взрыву батареи.
Однако есть одна добавка, которую вы взяли из аптечки, которая позволяет избежать этих недостатков.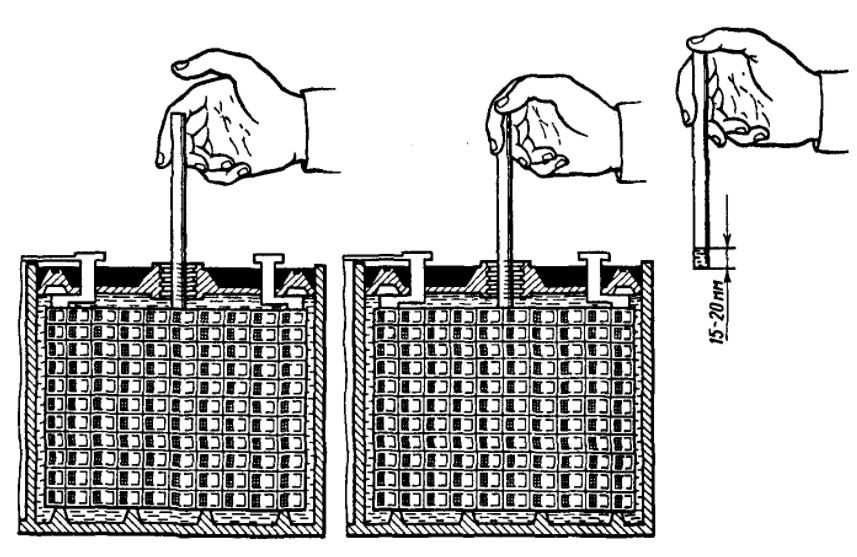
Аспирин.
Можем поддеть колпачок, вытащить любые резиновые заглушки вентиляционные отверстия, блокирующие ячейки в аккумуляторе (там 6 ячеек по 2 вольта каждая). Положите по две таблетки аспирина в каждую ячейку аккумулятора и подождите не более 1 часа (ацетилсалициловая кислота соединяется с серной кислотой, чтобы снять еще один заряд). Крышки ячеек можно поддеть отверткой даже на большинстве необслуживаемых аккумуляторов. .
Как бы странно это ни звучало, аспирин часто действует в зависимости от степени разрядки батареи. Это достаточно безопасный подход и обычно подходит для еще одного оборота двигателя. Имейте в виду, что добавление аспирина сократит срок службы батареи, так как аспирин вступает в реакцию с серной кислотой с образованием уксусной кислоты. Хорошо для повышения, но плохо для внутренностей батареи. Предполагая, что вы добавите не более пары аспиринов на клетку, это не должно причинить значительного вреда или исключить дополнительные усилия, если оно не сработает. Таким образом, есть по крайней мере один безопасный и жизнеспособный способ перезапустить автомобиль, стимулируя электролит.
Таким образом, есть по крайней мере один безопасный и жизнеспособный способ перезапустить автомобиль, стимулируя электролит.
Вы объясните это Преп. Он не выглядит убедительным, но ваши возможности ограничены, поэтому он говорит: «Ну, давай посмотрим, сработает ли это».
Вы открываете аккумулятор, раздавливаете несколько таблеток аспирина из аптечки, стараясь держать их отдельно друг от друга, чтобы на каждую ячейку приходилось по два раздавленных аспирина. Затем вы кладете порошок в аккумулятор и добавляете воду в бутылках, чтобы заполнить его до нужного уровня. Ацетилсалициловая кислота из аспирина соединится с кислотой аккумулятора и увеличит заряд в аккумуляторе, а вода поможет восстановить электролит в аккумуляторе.
Вы заменяете крышки, собираете инструменты, допиваете кокаин и прыгаете в джип. Поверните ключ, и двигатель сразу запустится. Хотя скоро нам может понадобиться новая батарея.
Преп прыгает, указывает путь и говорит: «Отпусти». Ты смотришь на него с ожиданием и понимаешь, что ему все равно, он просто хочет домой.

