как измерить ее в батарее, почему она бывает высокой
Практически каждый автомобилист знает, насколько важно держать аккумуляторную батарею своего автомобиля в порядке. От ее состояния зависит не только возможность пуска двигателя, но и нормальная работа всего электрооборудования машины. К сожалению, далеко не всем известно, что исправность и «боеготовность» батареи зависит не только от своевременной и качественной ее зарядки, но и от нормальной плотности электролита в аккумуляторе.
Содержание
- Устройство и принцип работы АКБ
- Конструкция батареи
- Как это работает
- Понятие плотности электролита
- Оптимальная концентрация кислоты
- Проверка плотности рабочей жидкости
- Когда и чем доливают аккумулятор
- Низкий уровень в секциях
- Ненормальная кислотность
Устройство и принцип работы АКБ
Для того чтобы качественно провести обслуживание аккумулятора и обеспечить правильную его работу, необходимо хотя бы приблизительно представлять, что у него внутри и как все это работает. Поэтому, прежде чем перейти к вопросам об электролите, необходимо понять, как устроен автомобильный аккумулятор и по какому принципу он работает.
Поэтому, прежде чем перейти к вопросам об электролите, необходимо понять, как устроен автомобильный аккумулятор и по какому принципу он работает.
Конструкция батареи
Практически все свинцово–кислотные батареи имеют одинаковую конструкцию. Состоят они из отдельных секций (банок), каждая из которых имеет набор положительных и отрицательных пластин. Первые называются катодными и выполнены из металлического свинца. Вторые, анодные, сделаны из диоксида свинца. Пластины собраны в пакет и помещены в кислотостойкую емкость, в которую впоследствии заливается рабочая жидкость – водный раствор серной кислоты или так называемый электролит.
Устройство секции свинцово-кислотного аккумулятора:
- 1 – крышка банки;
- 2 – корпус банки;
- 3 – ребристый отстойник;
- 4 – пластины, собранные в пакет;
- 5 – отрицательный (анодный) вывод;
- 6 – отрицательный (анодные) пластины;
- 7 – диэлектрическая прокладка – сепаратор;
- 8 – положительный (катодный) вывод;
- 9 – положительные (катодные) пластины.

Готовые секции, соединенные последовательно, и являются аккумуляторной батареей. В шестивольтовых АКБ таких секций три, в 12-ти вольтовых – шесть.
Как это работает
Итак, конструкция АКБ достаточно проста, но каким образом на ее выводах появляется напряжение? Действительно, если взять батарею прямо из магазина и подключить к ней вольтметр, то прибор покажет «0». Отсутствие тока обусловлено тем, что электролит не заливается в батарею сразу после изготовления, и в стоящем на магазинной полке аккумуляторе пластины сухие. Рабочая жидкость заливается в АКБ уже после покупки.
Самое время выяснить, для чего нужен электролит. Поскольку положительные и отрицательные пластины имеют различный химический состав, между ними, погруженными в кислотный раствор, возникает разность потенциалов (примерно 2 В на секцию, чем и обусловлено количество секций в батарее). При подключении к клеммам АКБ нагрузки между пластинами, благодаря высокой электропроводности электролита, начинает течь ток. Одновременно начинается химический процесс преобразования диоксида свинца в сульфат свинца с участием серной кислоты. Как только количество диоксида и серной кислоты упадет до определенного уровня, процесс прекратится, и батарея перестанет вырабатывать ток – разрядится.
При подключении к клеммам АКБ нагрузки между пластинами, благодаря высокой электропроводности электролита, начинает течь ток. Одновременно начинается химический процесс преобразования диоксида свинца в сульфат свинца с участием серной кислоты. Как только количество диоксида и серной кислоты упадет до определенного уровня, процесс прекратится, и батарея перестанет вырабатывать ток – разрядится.
В процессе разрядки серная кислота и диоксид свинца расходуются на образование сульфата свинца
Но аккумуляторы, в отличие от гальванических элементов (батареек), могут восстанавливать свои химические свойства. Если подключить АКБ к источнику постоянного тока, то под его действием сульфат начнет разлагаться на диоксид свинца и серную кислоту. Батарея начнет заряжаться, преобразуя электрическую энергию в химическую. Как только количество диоксида и кислоты достигнет исходных величин, батарею можно считать заряженной.
Химические процессы, возникающие в батарее при ее разрядке и зарядке
Серная кислота, входящая в состав электролита, играет одну из основных ролей в работе АКБ.
Именно от ее свойств будет зависеть качественная и долговременная работа батареи в целом.
Понятие плотности электролита
Вполне понятно, что количество серной кислоты и диоксида свинца в батарее должно быть сбалансированным – ведь они расходуются вместе. Поскольку количество диоксида свинца определяется производителем, автомобилисту после покупки аккумулятора остается лишь заправить АКБ необходимым количеством кислоты. Емкость секций батареи тоже фиксирована, поэтому в нее больше нормы не зальешь.
Остается единственный вариант – разбавить кислоту нейтральной к свинцу жидкостью, что и делается. Разбавляется кислота обычной водой, но дистиллированной, чтобы соли, содержащиеся в обычной воде, не нарушили чистоту раствора и не вывели АКБ из строя. Обычно автолюбитель покупает уже готовый электролит нужной плотности в автомагазине, хотя приготовить его можно и самостоятельно.
Процентное отношение воды к кислоте в полностью заряженном аккумуляторе составляет 70/30. Но при составлении электролита и его измерениях намного удобнее пользоваться единицами плотности – г/см. куб. или кг/м. куб. Удельный вес воды и кислоты различен, а значит, по общей плотности раствора можно судить о процентном соотношении его составляющих – концентрации.
Но при составлении электролита и его измерениях намного удобнее пользоваться единицами плотности – г/см. куб. или кг/м. куб. Удельный вес воды и кислоты различен, а значит, по общей плотности раствора можно судить о процентном соотношении его составляющих – концентрации.
Оптимальная концентрация кислоты
Пониженная концентрация, как правило, приводит к ускоренной сульфатации пластин – образованию на них нерастворимого сульфата свинца, который уже не может разложиться на кислоту и диоксид. В результате емкость батареи катастрофически падает, КПД уменьшается, а внутреннее сопротивление увеличивается (сульфат – диэлектрик).
Даже полностью заряженная, но сульфатированная батарея, выдающая, казалось бы, нормальное напряжение, садится после первого пуска, а то и вообще не в состоянии провернуть стартер. Кроме того, электролит с низкой плотностью замерзает при более высоких температурах, а значит, на стоянке даже при легком морозе батарею попросту разорвет льдом.
Чрезмерно высокая плотность электролита в аккумуляторной батарее не менее опасна, поскольку излишняя кислотность сокращает ресурс батареи в разы, буквально съедая пластины. Конечно, аккумулятор, залитый одной кислотой, будет крутить «как зверь», но сколько проживет такая АКБ? Сутки, может неделю. Если повезет – месяц.
А теперь пора вернуться к оптимальной плотности. В сети можно увидеть множество таблиц «рекомендованной» плотности, в зависимости от климатических условий. Если тепло – пониже, если мороз – повыше. Чем грозят эти «повыше» и «пониже», было описано в предыдущих абзацах. Поэтому не стоит изобретать велосипед, поскольку все эксперименты уже провели производители АКБ, а рекомендованная плотность приводится в сопроводительной документации.
С новым, сухим (сухозаряженным) аккумулятором все просто – в него заливается электролит комнатной температуры с плотностью 1.28 г/см. куб. Через час концентрация упадет до 1.26 – 1.27 г/см. куб., и батарея готова к работе.
- 1.265 кг/м. куб. — 12.6 … 12.7 В — полностью заряжена;
- 1.225 кг/м. куб. — 12.3 … 12.4 В — 75%;
- 1.190 кг/м. куб. — 12.0 … 12.1 В — 50%;
- 1.115 кг/м. куб. — 11.8 … 11.9 В — 25%;
- 1.120 кг/м. куб. — 11.6 … 11.7 В — разряжена;
- ниже 1.120 кг/м. куб. — ниже 11.6 В — глубокий разряд.
Стоит обратить внимание на то, что все параметры батареи, включая плотность и напряжение, сильно зависят от температуры. Поэтому значения справедливы только при 26.7 градусах Цельсия. Если нужно провести измерения при другой температуре окружающей среды, то дополнительно придется воспользоваться таблицей плотности электролита от температуры, которую несложно найти в сети.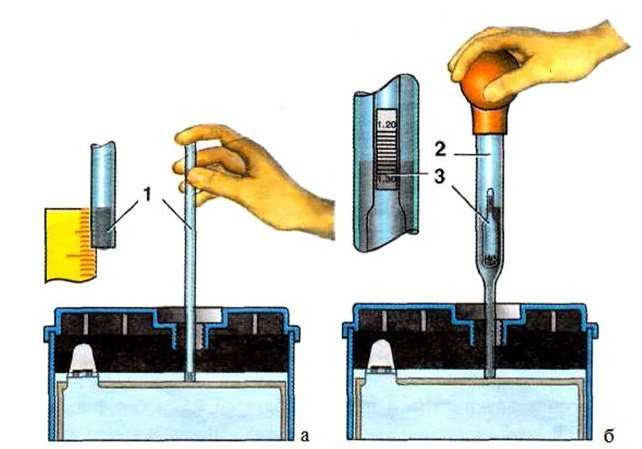
Выяснив зависимость плотности от выходного напряжения батареи, а значит, и от степени ее заряда, контролировать концентрацию электролита несложно. Достаточно замерить напряжение на клеммах отключенного аккумулятора любым вольтметром, затем измерить плотность и проверить их соответствие.
Проверка плотности рабочей жидкости
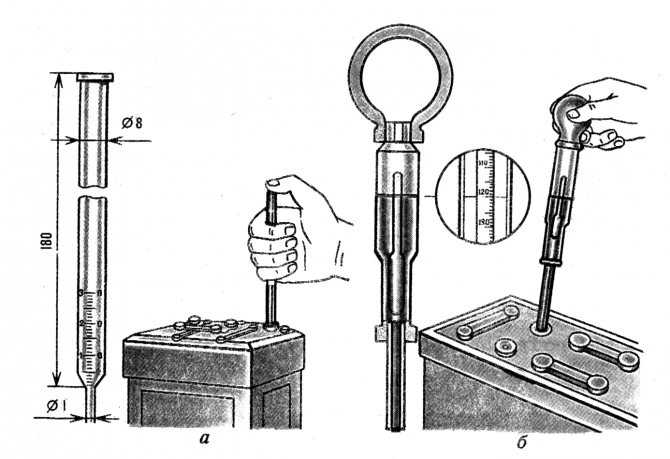
Для измерения плотности жидкостей существуют специальные приборы – ареометры или плотномеры. Есть такой и для автомобильных аккумуляторов. Выполнен он в виде большого шприца, внутри которого расположен поплавок со специально отградуированной шкалой.
Поплавок автоареометра комплектуется специальным «шприцем» для работы в узкогорлых секциях аккумуляторов.
Для того чтобы измерить плотность в аккумуляторе, со всех его секций сворачиваются пробки. Далее грушу ареометра сжимают, а его иглу погружают в секцию. Отпустив грушу, набирают в шприц электролит. При этом поплавок прибора всплывает. Плотность жидкости считывают со шкалы по тому уровню, до которого всплыл поплавок.
При этом поплавок прибора всплывает. Плотность жидкости считывают со шкалы по тому уровню, до которого всплыл поплавок.
Поплавок всплыл до уровня 1.200. Плотность электролита – 1.2 г/см. куб.
После измерения грушу вновь сжимают, а после слива электролита обратно в батарею ареометр промывают проточной водой и сушат. Не следует забывать, что каждая секция – отдельная, независимая часть АКБ, поэтому плотность нужно измерить в каждой.
Когда и чем доливают аккумулятор
Необходимость доливки рабочей жидкости в батарею возникает нечасто, но она бывает необходимв. Что, сколько и в каких случаях нужно доливать? Всего таких случаев два: низкий уровень электролита и ненормальная кислотность рабочей жидкости.
Низкий уровень в секциях
Эта ситуация возникает часто, поскольку в процессе работы батареи вода испаряется или, как принято говорить, выкипает.
- медицинский шприц без иглы или автомобильный ареометр;
- дистиллированная вода;
- средства защиты (очки и резиновые перчатки).
Дистиллированная вода набирается в шприц и заливается в соответствующие секции, до нужного уровня. После доливки жидкости в аккумулятор его ставят на зарядку. В этом плане автоареометр намного предпочтительней, поскольку, долив воду, тут же можно проконтролировать плотность раствора.
Следует соблюдать осторожность: нельзя работать с кислотой, если глаза не защищены.
Ненормальная кислотность
Если изначально батарея была заправлена как положено, то чрезмерно большая плотность электролита в аккумуляторе может появиться только в случае, если выкипела вода или измерения проводились при сильном морозе (с понижением температуры плотность повышается, и это нормально). В первом случае достаточно просто долить воду, во втором – произвести перерасчет или, что проще и правильнее, заняться измерениями в отапливаемом помещении.
А вот падение концентрации кислоты – ситуация реальная. Обычно это происходит из-за неправильной эксплуатации АКБ или ввиду ее «преклонного возраста». Причина – появление нерастворимого сульфата, который при своем образовании использовал кислоту, но уже не разлагается при зарядке, а значит, вернуть ее обратно в раствор не может. Ситуация не особо радостная, но восстановить плотность необходимо хотя бы для того, чтобы дотянуть до покупки новой батареи.
Прежде чем принять решение о доливке кислоты, необходимо еще раз убедиться в том, что плотность действительно ниже положенной при текущем состоянии АКБ. Если решение принято, то понадобятся ареометр, перчатки, очки и корректирующий электролит плотностью 1.35 — 1.40 г/см. куб. (в продаже есть и такой).
Если решение принято, то понадобятся ареометр, перчатки, очки и корректирующий электролит плотностью 1.35 — 1.40 г/см. куб. (в продаже есть и такой).
Корректирующий электролит для доливки в автомобильный аккумулятор
В крайнем случае подойдет и стандартный 1.28 г/см. куб., но, возможно, придется отобрать лишнюю жидкость из секции в отдельную емкость, чтобы освободить место для более «крепкого».
Методика доливки та же, что и воды, но при этом плотность в банке постоянно контролируется тем же ареометром.
Категорически запрещается поднимать концентрацию раствора доливкой чистой серной кислоты. Во-первых, это очень опасно, во-вторых, даже нескольких грамм концентрированной кислоты достаточно, чтобы кардинально изменить плотность раствора в секции, а значит, выставить нужную плотность пол-литровым ареометром исключительно сложно.
что это такое и ее значения
Большинство автомобилей комплектуются свинцово-кислотными аккумуляторными батареями. Принцип действия свинцовых аккумуляторов заключается в обратимой химической реакции свинца и его окиси, расположенный в пластинах и раствора электролита. В качестве электролита используется водный раствор серной кислоты Плотность электролита показывает концентрацию (степень разбавленности) кислоты.
Принцип действия свинцовых аккумуляторов заключается в обратимой химической реакции свинца и его окиси, расположенный в пластинах и раствора электролита. В качестве электролита используется водный раствор серной кислоты Плотность электролита показывает концентрацию (степень разбавленности) кислоты.
Содержание
- Что такое плотность электролита
- Какую плотность имеет электролит в аккумуляторах
- Зависимость плотности от степени заряженности
- Рекомендуемые значения плотности
- Коррекция плотности при смене сезона
- Выравнивание плотности
Что такое плотность электролита
Серная кислота и вода могут смешиваться в любых пропорциях. Понятие плотность электролита введено для того, чтобы показать, какое количество чистой кислоты содержится в единице объем электролита.
Смешивая кислоту с водой, получают промежуточные значения. Чем больше воды содержит раствор, тем меньшее значение плотности он имеет, поскольку концентрированная кислота гораздо тяжелее:
- дистиллированная вода – 1.
 00 г/см3;
00 г/см3; - концентрированная серная кислота – 1.84 г/см3.
Какую плотность имеет электролит в аккумуляторах
Плотность электролита в аккумуляторе имеет определенные значения, которые существенны для нормального протекания химических реакций в процессе работы. В зимний период и летом концентрация кислоты должна иметь разные значения. Особенно это касается регионов с большими колебаниями температуры. Несоответствие плотности оптимальным значениям может привести к отрицательным последствиям:
- Низкая плотность:
- снижение КПД батареи из-за повышения внутреннего сопротивления;
- снижение емкости, так как свинец пластин не полностью вступает в реакцию из-за недостатка кислоты;
- вероятность замерзания при низких отрицательных температурах;
- Высокая плотность:
- Сульфатация пластин из-за образования крупных труднорастворимых кристаллов сульфида свинца;
- Осыпание пластин.
Важно! Плотность электролита в АКБ не является постоянной величиной.
Это связано с тем, что во время разряда кислота из раствора реагирует с материалом пластин и ее концентрация падает. Во время зарядки происходит обратная реакция. Разность плотностей заряженного и разряженного аккумулятора составляет примерно 0.15 – 0.16 г/см3.
Таким образом, зная параметры электролита в полностью заряженном аккумуляторе, можно определить степень разрядки, не пользуясь измерительными приборами, а определив состояние электролита при помощи ареометра.
Измерения производят с учетом температуры, так как наблюдается сильная зависимость. Рекомендуемые значения относятся к измерениям при температуре от +20 до +30°С В других случаях поправки к измерениям должны иметь такие значения:
- от +31 до +45°С + 0.01 гр/см3;
- от +20 до +30°С + 0.00 гр/см3;
- от +5 до +19°С — 0.01 гр/см3;
- от +4 до -10°С — 0.02 гр/см3;
- от -11 до -25° -03 гр/см3;
- от -26 до -40° -04 гр/см3.
Зависимость плотности от степени заряженности
Для электролита автомобильного аккумулятора с нормальной плотностью 1. 27 гр/см3 можно привести следующую зависимости от степени разряда батареи:
27 гр/см3 можно привести следующую зависимости от степени разряда батареи:
| Плотность гр/см3 | Уровень заряда | Температура замерзания |
| 1.27 | 100%, | – 60°С; |
| 1.26 | 95%, | – 55°С; |
| 1.25 | 87%, | – 50°С; |
| 1.24 | 80%, | – 46°С; |
| 1.23 | 75%, | – 42°С; |
| 1.22 | 70%, | – 37°С; |
| 1.21 | 63%, | – 32°С; |
| 1.20 | 56%, | – 27°С; |
| 1.19 | 50%, | – 24°С; |
| 1.18 | 44%, | – 18°С; |
| 1.17 | 37%, | – 16°С; |
| 1.16 | 31%, | – 14°С; |
| 1.15 | 25%, | – 13°С; |
| 1.14 | 19%, | – 11°С; |
| 1.13 | 13%, | – 9°С; |
| 1.12 | 6%, | – 8°С; |
В таблице плотности электролита приведена зависимость плотности и температуры замерзания. Приведенные данные показывают, что глубокий разряд батареи чреват ее замерзанием уже при температуре 8 — 16°С
Приведенные данные показывают, что глубокий разряд батареи чреват ее замерзанием уже при температуре 8 — 16°С
Рекомендуемые значения плотности
Часто задаваемый вопрос – какая должна быть плотность электролита для лета и для зимы? Большинство производителей аккумуляторов рекомендуют придерживаться следующих значений плотности, в зависимости от минимальной зимней температуры. Важность контроля плотности электролита зимой связана не только с недопущением перемерзания электролита, но и повышением КПД батареи для успешного запуска непрогретого двигателя:
- от +6 до +4° 22 гр/см3;
- от +4 до -15° 24 гр/см3;
- от -4 до -15° 26 гр/см3;
- от -15 до -30° 28 гр/см3;
- от -30 до -50° 29 гр/см3;
Перечисленные значения справедливы для полностью заряженных батарей. Заливка электролита в новую батарею производится раствором меньшей концентрации – на 0.02 гр/см3. В процессе зарядки значение поднимется до необходимой величины.
Нормой плотности электролита в средней полосе принято считать 1. 26 – 1.27 гр/см3.
26 – 1.27 гр/см3.
Коррекция плотности при смене сезона
При большой разнице среднесуточных температур в летний и зимний период рекомендуется корректировать значение плотности. Процесс не представляет сложности, но опасен из-за агрессивности электролита.
Если машина храниться в гараже и эксплуатируется регулярно, то необходимость в коррекции не возникает, поскольку в результате длительных поездок батарея успевает зарядиться до нормального состояния и содержание кислоты не палает до критических значений.
Кратковременные поездки не способствуют нормальному заряду. Старые аккумуляторы имеют повышенные значения саморазряда, поэтому после длительного простоя плотность может упасть до недопустимых значений.
Электролит корректируется на полностью заряженном аккумуляторе. Важно знать, что в большинстве автомобилей с правильно отрегулированной системой регулировки напряжения, уровень заряда аккумулятора не превышает 80 – 90%. В зимнее время при наличии большого числа мощных потребителей (вентилятор печки, обогрев стекол и сидений, свет фар), это значение еще меньше. Для правильной подготовки батареи к зимнему сезону необходима полная зарядка специализированным зарядным устройством.
Для правильной подготовки батареи к зимнему сезону необходима полная зарядка специализированным зарядным устройством.
Заряд производят при слабом кипении электролита до тех пор, пока в течении текущих двух часов плотность расти уже не будет. Рост плотности говорит о том, что заряд еще не окончен.
Плотность электролита в заряженном аккумуляторе измеряют через два часа после зарядки, чтобы пластины полностью освободились от пузырьков газа и снизилась температура. Не забывайте про учет температуры электролита!
Содержание кислоты повышают при помощи корректирующего электролита, который добавляют в банки взамен части основного электролита.
Важно! Отбор раствора из каждой банки батареи должен быть одинаковым! Количество добавляемого корректора также одинаково. Сколько убрано жидкости, столько корректирующего раствора нужно добавлять
Плотность электролита в аккумуляторе и зимой и летом проверяется после получаса дополнительного заряда с последующей двухчасовой выдержкой. Это делается с целью равномерного перемешивания электролита. Обязателен учет температуры.
Это делается с целью равномерного перемешивания электролита. Обязателен учет температуры.
Переход на летнюю эксплуатацию делается аналогично, только вместо более крепкой кислоты добавляется дистиллированная вода. Дополнительный заряд должен продолжаться более длительное время, поскольку добавляемая вода из-за низкого удельного веса будет находится в верхнем слое.
Важно! Нельзя ускорять перемешивание покачиванием и переворачиванием батареи, поскольку осадок с дна емкости попадет между пластинами и батарея выйдет из строя.
Выравнивание плотности
В процессе эксплуатации аккумулятора можно увидеть, что разные банки имеют расхождения при измерении плотности. Если эта величина не превосходит 0.01 – 0.02 гр/см3, то ничего страшного нет. Большая разница свидетельствует, что банка с меньшим значением начинает выходить из строя.
Встречаются рекомендации исправлять состояние неисправной банки путем долива корректирующего раствора. Этого делать нельзя ни в коем случае. Простое увеличение концентрации кислоты даст только отрицательный эффект и ускорит выход банки из строя.
Этого делать нельзя ни в коем случае. Простое увеличение концентрации кислоты даст только отрицательный эффект и ускорит выход банки из строя.
В данной ситуации необходимо произвести тренировочный цикл заряда. Полностью заряженный аккумулятор разряжают до 50% номинальной емкости, а затем заряжают малым током до полного заряда. Повторяя процесс несколько раз, можно полностью восстановить неисправные банки батареи.
Такие же требования предъявляются к выравниванию уровня электролита. В процессе зарядки током бортовой сети происходит частичное испарение воды из банок. Особенно активно этот процесс происходит летом. Кислота при этом не испаряется, вопреки некоторым источникам из интернета. Поэтому уровень электролита выравнивается исключительно дистиллированной водой.
https://www.youtube.com/watch?v=dZDnSmBlPmwVideo can’t be loaded because JavaScript is disabled: Плотность электролита в аккумуляторе (https://www.youtube.com/watch?v=dZDnSmBlPmw)
Плотность электролита — нормы, какие изменения происходят летом/зимой?
Если вы пользуетесь обслуживаемыми сернокислотными батареями, плотность электролита — тот самый показатель, который нужно уметь определять правильно.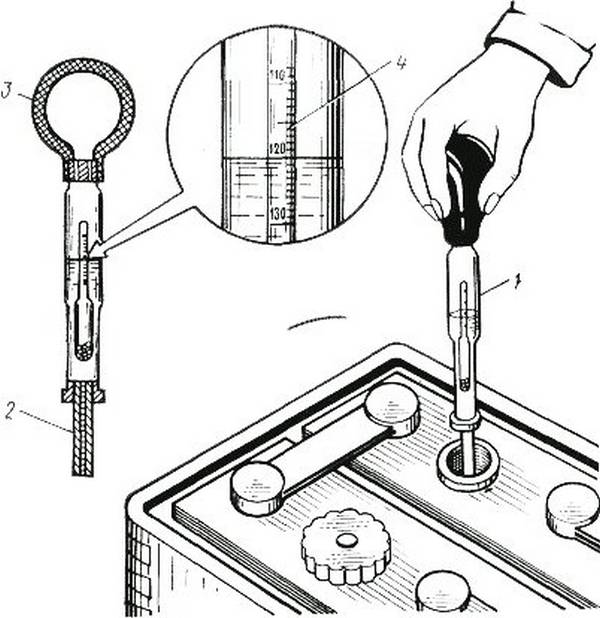 От этого зависит не только уровень заряда, но и исправность АКБ. Поэтому мы решили разобраться, какой должна быть плотность электролита в аккумуляторе зимой или летом, как измерить этот показатель и при необходимости повысить его.
От этого зависит не только уровень заряда, но и исправность АКБ. Поэтому мы решили разобраться, какой должна быть плотность электролита в аккумуляторе зимой или летом, как измерить этот показатель и при необходимости повысить его.
Под плотностью понимается процент серной кислоты в рабочей жидкости. Выражается в граммах на кубический сантиметр, поэтому измерить визуально ее не получится. Для этих целей применяется специальный прибор — ареометр. Практика показывает, что работа идет хорошо, пока показатель держится в рамках от 1,25 до 1,28 г/см3.
Нормы плотности электролита в аккумуляторе зимой и летомКак видим, разбежка есть. Это происходит, поскольку для каждого сезона есть свои приемлемые нормы, которые зависят от концентрации действующего вещества, температуры воздуха, заряженности батареи.
1. Плотность электролита в АКБ летомГлавная проблема летом — испарение воды. Солнце жарит, капот разогревается, а вместе с ним — двигатель и АКБ.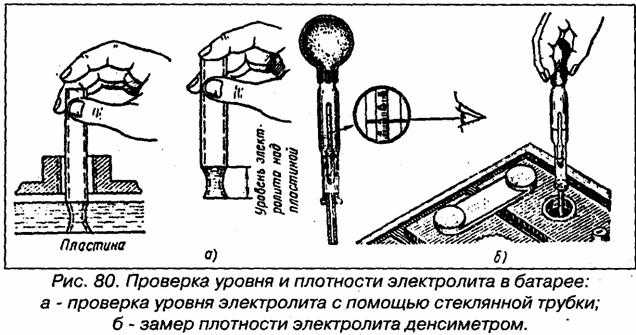 Концентрация серной кислоты растет, а верхняя часть пластин оголяется, что неизбежно приводит к активной сульфатации, разрушению.
Концентрация серной кислоты растет, а верхняя часть пластин оголяется, что неизбежно приводит к активной сульфатации, разрушению.
Наша задача — снизить концентрацию серной кислоты. Достаточно уменьшить значение на 0,02 г/см3. Это никак не сказывается на запуске, зато продлевает срок службы оборудования. Например, во влажном теплом климате показатель может составлять 1,23 г/см3, и все будет в порядке. Высокие температуры облегчают токоотдачу, поэтому стартер проворачивается даже на минимальных показателях.
Испарение идет постоянно, поэтому проводить проверку рекомендуется не реже двух раз в месяц. Но все зависит от температуры воздуха. Как только вы обнаружили уменьшение показателя – доливается дистиллированная вода.
Для справки! Испаряется не только вода, но также серная кислота. Доливая дистиллят постоянно, мы снижаем концентрацию действующего вещества. В итоге аккумуляторное устройство перестает держать заряд.
2. Плотность электролита в АКБ зимойЗимой плотность электролита может снижаться под влиянием окружающей температуры.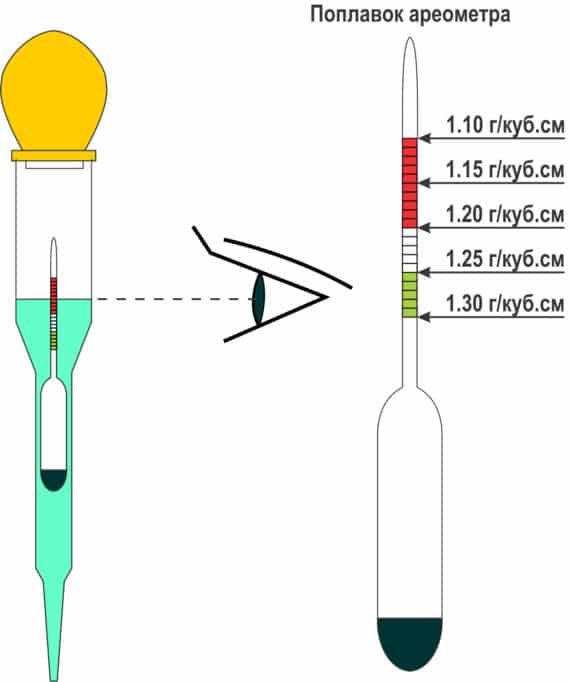 При температуре минус 35 градусов и показателе плотности лишь в 1,21-1,22 г/см3 можно и не завестись.. Емкость снижается, а вместе с нею — пусковые токи. Стартер просто перестанет прокручиваться.
При температуре минус 35 градусов и показателе плотности лишь в 1,21-1,22 г/см3 можно и не завестись.. Емкость снижается, а вместе с нею — пусковые токи. Стартер просто перестанет прокручиваться.
Если параметр снижается зимой, не нужно доливать воду в банки. Правильное решение — зарядить батарею. Недостаток городского транспорта в том, что автомобили перемещаются на короткие расстояния, а потом долго простаивают на стоянках. В итоге источник питания находится в охлажденном состоянии долгое время, а за поездку не успевает подзарядиться.
Вывод: нужно регулярно проводить подзарядку. Иначе уровень заряда снизится. Но не забываем, что заряжать АКБ нужно в теплом помещении с хорошей вентиляцией. Желательно, чтобы оно было нежилым, так как в процессе зарядки выделяются ядовитые газы.
Для справки! Чем ниже показатель, тем быстрее батарея замерзает. Например, если плотность падает до 1,1 г/см3, то жидкость будет замерзать даже при -7 градусах. Корпус разрывает, а пакеты пластин разрушаются.
Раствор на 65% состоит из дистиллированной воды, на 35% — из серной кислоты. Чтобы реакция протекала быстро, концентрация действующего вещества должна быть определенной. Однако показатель часто становится низким. Это происходит по нескольким причинам.
1. Батарея разрядиласьКогда аккумулятор находится в разряженном состоянии, плотность снижается. Достаточно зарядить АКБ, чтобы все встало на свои места.
Если же речь идет о глубоких разрядах – происходит сульфатация, когда серная кислота оседает на пластинах в виде налета. При заряде запускается процесс десульфатации, однако полностью вещество не возвращается в первоначальное состояние. Поэтому свинцово-кислотные АКБ с жидким электролитом не терпят глубоких разрядов, о чем вам обязательно расскажут консультанты 1AK.BY.
2. Часть раствора выкипелаБатарея находится возле мотора. При длительном использовании в жаркую погоду раствор закипает, что сопровождается обильным газообразованием. Летом рекомендуется хотя бы раз в неделю проверять показатели раствора.
Летом рекомендуется хотя бы раз в неделю проверять показатели раствора.
Владелец может доливать дистиллированную воду, но плотность будет снижаться. Обычно это происходит, если вы не следите за концентрацией серной кислоты.
Проводим проверку – подробная инструкцияОпределить плотность можно самостоятельно, если под рукой имеется:
- профессиональный денсиметр — стеклянная трубка, в которую погружается ареометр;
- защитные перчатки, костюм, очки — серная кислота, соприкасаясь с кожей, вызывает химические ожоги;
- теплое нежилое помещение с хорошей вентиляцией.
Измерение провести несложно:
- аккумулятор вынимается из посадочного гнезда, а пробки вывинчиваются;
- визуально оценивается уровень электролита — на 1,5 см должен быть выше, чем верхний край пластин;
- крышки выкручиваются, а батарея заряжается на 100%;
- через 8 часов после зарядки денсиметр погружают поочередно в каждую банку;
- из каждой банки выкачивается немного наполнителя — ареометр должен свободно плавать в растворе, а показатели оцениваются с учетом погоды.

Все хорошо, если показания не опускаются ниже 1,24 г/ см3. Показатели для разных банок не должны отличаться больше, чем на 0,02–0,03 единицы. Если они не отступают от нормы — возвращаем заглушки на место, устанавливаем батарею.
Как восстановить плотность самостоятельно?Если мы видим, что плотность снизилась, можно попробовать исправить это самостоятельно. Есть два способа, каждый из которых — довольно опасный, потому что работать придется с серной кислотой.
1. Долить корректирующий растворПридется подсчитать, сколько нужно использовать корректирующей жидкости и дистиллированной воды, чтобы провести замену эффективно.
Схема такая:
- вытягиваем грушей немного вещества из банки;
- заменяем его аналогичным объемом раствора;
- ставим АКБ на зарядку, ждем полчаса, чтобы жидкости перемешались;
- оставляем источник питания на 1–2 часа, чтобы жидкость остыла, пузырьки перестали образовываться;
- проводим замер — если нужно, повторяем процедуру.

Если параметр становится ниже 1,18 г/см3, используем кислоту. Схема действий та же, только шаг разбавления берется маленький, чтобы не пропустить нужную отметку.
Теперь вы знаете, как определить нормальную плотность электролита в аккумуляторе с учетом сезона. Остается решить, что делать, когда показатель сильно отстает от нормы. Вы можете попробовать самостоятельно восстановить плотность, используя корректирующий раствор или серную кислоту. Но не стоит дырявить конструкцию, переворачивать АКБ или следовать другим странным советам из интернета. Намного эффективнее и безопаснее обратиться к специалистам или купить новый аккумулятор.
На правах рекламы
Плотности электролитов
Плотности электролитовПлотности электролитов: входы
Сначала на странице ввода выбирается нужная модель. Затем вводимые данные вводятся в ряд полей, и параметры устанавливаются с помощью переключателей.
- Температура: введите абсолютную температуру (в градусах Кельвина), которая находится между указанными пределы. Единственная модель, которая рассчитывает объемные свойства в диапазоне температур. это Н + — НХ 4 + — Нет + — SO 4 2− — НЕТ 3 − — Cl − — H 2 Модель O, выбранная по умолчанию. Другие модели, которые можно выбрать, рассчитаны только на 298,15 К, а температура не влияет. необходимо ввести.
- Выбор метода оценки для смесей: этот вариант предлагается только для многоионной модели. Есть
четыре метода, каждый из которых предсказывает объемные свойства смеси на основе
плотность, удельный объем или кажущийся молярный объем отдельных электролитов
из которых он состоит. Методы кратко описаны ниже:
- Плотность (ρ): плотность смеси равна сумме плотностей
растворы отдельных компонентов электролита, каждый при общей массовой доле (или массовых процентах) растворенных веществ
в смеси.
 Вклад плотности каждого электролита взвешивается в соответствии с
к его массовой доле в общем растворе. Этот подход принадлежит Van Dingenen и Raes (1),
как обобщено Semmler et al. (2) в их уравнении 10.
Вклад плотности каждого электролита взвешивается в соответствии с
к его массовой доле в общем растворе. Этот подход принадлежит Van Dingenen и Raes (1),
как обобщено Semmler et al. (2) в их уравнении 10. - Удельный объем (1/ρ): удельный объем смеси равен сумме конкретные объемы растворы отдельных компонентов электролита, каждый при общей массовой доле (или массовых процентах) растворенных веществ в смеси. Вклад каждого электролита взвешивается согласно к его массовой доле в общем растворе. Этот подход был предложен Тангом (3), и обобщены Semmler et al. (2) в их уравнении 12.
- Кажущийся молярный объем (V φ ): кажущийся молярный объем всего растворенного вещества в
смесь равна сумме кажущихся молярных объемов
отдельных компонентов электролита, каждый при общей молярной ионной силе
смеси. Вклад каждого электролита взвешивается согласно
эквивалентной доле в растворе. Этот подход «Правила Юнга» является одним из нескольких, исследованных
Миллера (4), и соответствует его уравнению 57.

- Кажущийся молярный объем (V φ ): то же, что и (3) выше, но для кажущихся молярных объемы при общей мольной доле ионной силы смеси. Обратите внимание, что этот метод не всегда можно применять для концентраций, приближающихся к чистому расплаву (100 мас. растворенное). Это связано с тем, что молярная доля ионной силы чистой жидкости электролита 2:1 или 1:2 составляет 1,0, но только 0,5 для жидкого электролита 1:1. Таким образом, молярная доля ионной силы некоторых чрезвычайно концентрированные смеси могут быть недоступны в чистых растворах некоторых электролитов. из которых он состоит. Однако для подавляющего большинства расчетов это маловероятно. ограничение.
Какой из (1-4) выше следует использовать? Правила смешивания Юнга довольно широко применялись и тестировались для разбавленных растворов и для концентраций вплоть до насыщения. Таким образом, методы (3) и (4) хороший выбор для этой части диапазона концентраций. Результаты Танга (3) для плотности очень концентрированных смесей, полученные с помощью электродинамических весов, показывают, что метод (2) дает удовлетворительные оценки для пересыщенных растворов.

- Плотность (ρ): плотность смеси равна сумме плотностей
растворы отдельных компонентов электролита, каждый при общей массовой доле (или массовых процентах) растворенных веществ
в смеси.
- Блок концентрирования: концентрации ионов или солей могут быть введены в виде их массовых процентов в растворе, как моляльности, или как молярности. Обратите внимание, что моляльность — это моли на кг воды, а , а не . молей на кг раствора. Моляльность стремится к бесконечности по мере приближения к составу расплава, поэтому массовые проценты или молярность являются лучшим выбором для систем с экстремальной концентрацией.
- Концентрация: введите концентрацию электролита или ионов в выбранных единицах измерения. В последнем случае
(т. е. концентрации ионов) баланс заряда будет проверяться системой.
Для модели кислого сульфата аммония (H + — NH 4 + — HSO 4 − — SO 4 2− — H 2 O) необходимо ввести общую концентрацию. Это равно сумме значений (моляльностей, молярностей или массовых процентов) два растворенных компонента H 2 SO 4 и (NH 4 ) 2 SO 4 .
 Запись для мольной доли
кислоты в растворенном веществе – используется для указания относительных концентраций H 2 СО 4 и
(NH 4 ) 2 SO 4 –
описан в примечаниях к этой модели под полями ввода данных на странице ввода.
Количество равна N H 2 SO 4 /( N H 2 SO 4 + N (NH 4 ) 2 SO 4 ), ), 2 SO 4 ), 2 SO 4 )
где префикс n обозначает количество молей.
Запись для мольной доли
кислоты в растворенном веществе – используется для указания относительных концентраций H 2 СО 4 и
(NH 4 ) 2 SO 4 –
описан в примечаниях к этой модели под полями ввода данных на странице ввода.
Количество равна N H 2 SO 4 /( N H 2 SO 4 + N (NH 4 ) 2 SO 4 ), ), 2 SO 4 ), 2 SO 4 )
где префикс n обозначает количество молей.
Каталожные номера
(1) Р. Ван Дингенен и Ф. Раес (1993) J. Aerosol Sci. 24 , 1-17.
(2) М. Земмлер, Б. П. Луо и Т. Куп (2006) Atmos. Окружающая среда. 40 , 467-483.
(3) И. Н. Тан (1997) J. Geophys. Рез. 102 , 1883-1893 гг.
(4) Д. Г. Миллер (1995) J. Solut. хим. 24 , 967-987.
Существенное влияние плотности на динамику неводных электролитов
Существенное влияние плотности на динамику неводных электролитов
Скачать PDF
Скачать PDF
- Открытый доступ
- Опубликовано:
- Сунхо Хан 1
Научные отчеты том 7 , Номер статьи: 46718 (2017) Процитировать эту статью
1839 доступов
11 цитирований
Детали показателей
Предметы
- Атомистические модели
- Химическая физика
Abstract
Подвижность и сольватация ионов лития в электролитах имеют решающее значение для работы и безопасности ионно-литиевых аккумуляторов. Известно, что один и тот же растворитель не может одновременно удовлетворять требованиям подвижности и сольватации электролитов. Поэтому для оптимизации обоих свойств использовались сложные смеси растворителей. Здесь мы представляем влияние плотности на динамику и сольватацию органических жидких электролитов с помощью обширного моделирования молекулярной динамики. Наше исследование показывает, что небольшое изменение плотности может оказывать значительное влияние на подвижность электролитов, но не влияет на структуру сольватации иона лития. Оказывается, регулирование плотности электролитов может обеспечить более эффективный способ повышения подвижности, чем регулирование соотношения электролитов в смеси растворителей. Наше исследование показывает, что изменение плотности электролитов в большей степени влияет на время пребывания растворителей в первой сольватной оболочке иона лития, чем на изменение структуры сольватной оболочки. Наконец, наши результаты предлагают интригующий момент для понимания и разработки электролитов литий-ионных аккумуляторов для повышения производительности и безопасности.
Известно, что один и тот же растворитель не может одновременно удовлетворять требованиям подвижности и сольватации электролитов. Поэтому для оптимизации обоих свойств использовались сложные смеси растворителей. Здесь мы представляем влияние плотности на динамику и сольватацию органических жидких электролитов с помощью обширного моделирования молекулярной динамики. Наше исследование показывает, что небольшое изменение плотности может оказывать значительное влияние на подвижность электролитов, но не влияет на структуру сольватации иона лития. Оказывается, регулирование плотности электролитов может обеспечить более эффективный способ повышения подвижности, чем регулирование соотношения электролитов в смеси растворителей. Наше исследование показывает, что изменение плотности электролитов в большей степени влияет на время пребывания растворителей в первой сольватной оболочке иона лития, чем на изменение структуры сольватной оболочки. Наконец, наши результаты предлагают интригующий момент для понимания и разработки электролитов литий-ионных аккумуляторов для повышения производительности и безопасности.
Введение
Поскольку в последние годы технологии и рынки портативных электронных устройств и электромобилей быстро растут, перезаряжаемые батареи, такие как ионно-литиевые батареи, стали одной из самых активных областей исследований и промышленных рынков 1,2,3,4, 5 . Среди компонентов батареи электролиты играют центральную роль в работе и безопасности ионно-литиевых батарей 1,2,4,5,6,7,8,9,10 . Они позволяют ионам лития проводить между катодом и анодом батарей и способствуют образованию межфазной границы твердого электролита (SEI), которая является ключевым элементом для защиты электродов от деградации 6,7,8,9,10,11,12 .
Ионная проводимость λ является одним из основных свойств, характеризующих электролиты, которое количественно определяет подвижность ионов для электрохимических реакций 13 . Факторами, определяющими ионную проводимость, являются число ионов n ион , величина заряда Q ион , который несут ионы, и подвижность ионов μ ион , то есть 11 .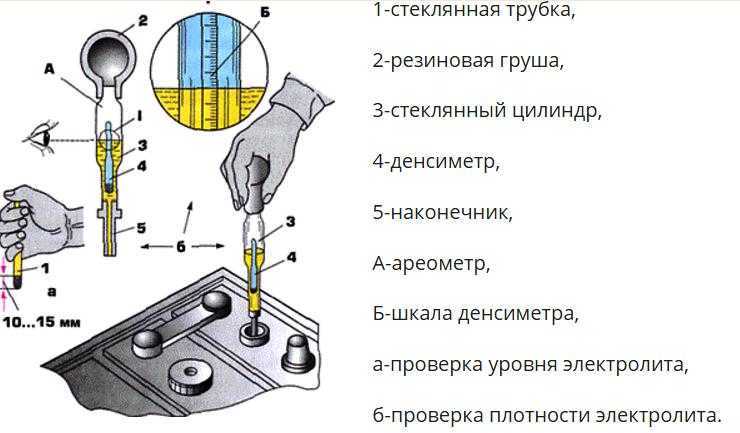 Таким образом, для данных ионов стратегия увеличения ионной проводимости по существу включает улучшение как коэффициента диффузии, так и числа ионов, участвующих в переносе заряда 14 . В то время как большая диффузия ионов, очевидно, увеличивает ионную проводимость, образование пары катиона и аниона не способствует ионной проводимости из-за ее нейтральности по заряду. Фактически образование пар катионов и анионов тесно связано с уменьшением коэффициента диффузии из-за увеличения размера ионных кластеров в дополнение к уменьшению числа ионов, вносящих вклад в ионную проводимость. Поэтому образование пар в конечном итоге связано с уменьшением ионной проводимости. Чтобы катионы и анионы не образовывали пары и даже кластеры, необходим процесс сольватации катионов растворителями. Обычно ожидается, что растворители в электролитах должны одновременно повышать подвижность ионов и образовывать правильную сольватную оболочку катионов.
Таким образом, для данных ионов стратегия увеличения ионной проводимости по существу включает улучшение как коэффициента диффузии, так и числа ионов, участвующих в переносе заряда 14 . В то время как большая диффузия ионов, очевидно, увеличивает ионную проводимость, образование пары катиона и аниона не способствует ионной проводимости из-за ее нейтральности по заряду. Фактически образование пар катионов и анионов тесно связано с уменьшением коэффициента диффузии из-за увеличения размера ионных кластеров в дополнение к уменьшению числа ионов, вносящих вклад в ионную проводимость. Поэтому образование пар в конечном итоге связано с уменьшением ионной проводимости. Чтобы катионы и анионы не образовывали пары и даже кластеры, необходим процесс сольватации катионов растворителями. Обычно ожидается, что растворители в электролитах должны одновременно повышать подвижность ионов и образовывать правильную сольватную оболочку катионов.
Молекула с большой диэлектрической проницаемостью может служить хорошим растворителем с точки зрения ионного спаривания, но легко не повысить подвижность ионов из-за ее большой вязкости. Напротив, молекула с малой диэлектрической проницаемостью имеет меньшую вязкость для повышения подвижности, но ее выполнение в процессе сольватации не выполняется. Таким образом, вместо одного типа растворителя современные электролиты, применяемые в современных литий-ионных батареях, состоят из нескольких типов растворителей, что ставит под угрозу оба свойства: подвижность и ионное сопряжение 1,5,15 . Например, этиленкарбонат (ЭК) имеет большую диэлектрическую проницаемость ( ε ~ 90 при 40 °C), которая даже выше, чем у воды ( ε ~ 79 при 25 °C) 1,16 . Однако его высокая вязкость ( η ~ 1,9 сП при 40 °С), а также высокая температура плавления ( T m ~ 36,4 °С) не позволяют выбрать его в качестве единственного растворителя. Диметилкарбонат (ДМК) имеет низкую вязкость ( η ~ 0,59 сП при 20 °C), но небольшую диэлектрическую проницаемость ( ε ~ 3,1 при 25 °C). Таким образом, комбинация циклических и линейных карбонатов, таких как EC и DMC, была предложена в качестве кандидата на роль эффективных электролитов, удовлетворяющих двум важным свойствам 1,17,18 .
Напротив, молекула с малой диэлектрической проницаемостью имеет меньшую вязкость для повышения подвижности, но ее выполнение в процессе сольватации не выполняется. Таким образом, вместо одного типа растворителя современные электролиты, применяемые в современных литий-ионных батареях, состоят из нескольких типов растворителей, что ставит под угрозу оба свойства: подвижность и ионное сопряжение 1,5,15 . Например, этиленкарбонат (ЭК) имеет большую диэлектрическую проницаемость ( ε ~ 90 при 40 °C), которая даже выше, чем у воды ( ε ~ 79 при 25 °C) 1,16 . Однако его высокая вязкость ( η ~ 1,9 сП при 40 °С), а также высокая температура плавления ( T m ~ 36,4 °С) не позволяют выбрать его в качестве единственного растворителя. Диметилкарбонат (ДМК) имеет низкую вязкость ( η ~ 0,59 сП при 20 °C), но небольшую диэлектрическую проницаемость ( ε ~ 3,1 при 25 °C). Таким образом, комбинация циклических и линейных карбонатов, таких как EC и DMC, была предложена в качестве кандидата на роль эффективных электролитов, удовлетворяющих двум важным свойствам 1,17,18 .
В этой работе мы исследуем влияние плотности на динамику электролита, состоящего из соли гексафторфосфата лития (LiPF 6 ) в бинарной смеси растворителей ЭК и ДМК с соотношением смеси ЭК:ДМК = 50% :50% (в объемных %). Обратите внимание, что для простоты мы будем обозначать соотношение растворителей и электролитов в смеси только как соотношение EC на протяжении всей этой работы. Для сравнения мы также исследуем динамику для случая EC 20%.
Результаты
Наша отправная точка — две системы электролитов с плотностью ρ = 1,3446 г/см 3 для EC 50% и ρ = 1,2677 г/см 3 для EC 20%, и затем. мы исследуем динамику для EC 50% в зависимости от ρ . Эти начальные плотности соответствуют суммарным плотностям бинарных смесей ЭК и ДМК с 1 M LiPF 6 , когда две системы имеют одинаковый объем без учета эффекта смешивания ЭК и ДМК. Как правило, общая плотность смешанной системы не следует простой сумме: ρ total ≠ ρ simple = ( ρ EC V EC + ρ DMC V DMC )/( V EC + V DMC ), но следует учитывать эффект смешивания: ρ всего = ρ простой + ρ 7 5 5 5 5 Терм ρ смешанный порождается взаимодействием между ЭК и ДМК, и его трудно ρ смешанный подлежит количественному определению.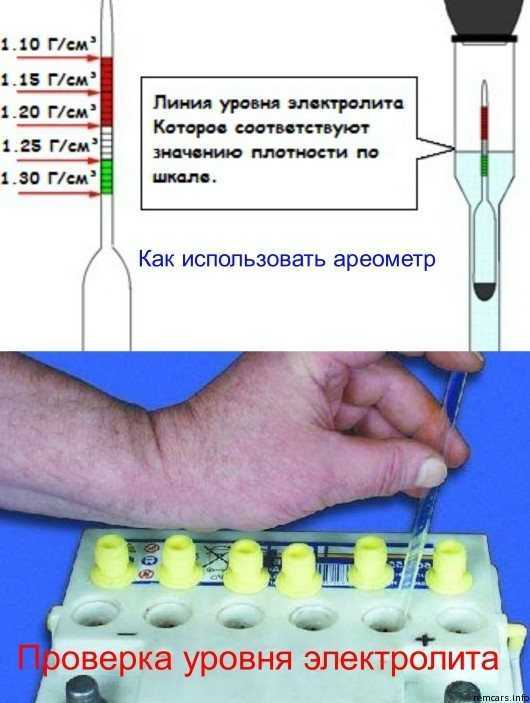 Если учесть смешение ЭК и ДМК, общая плотность будет отличаться от плотности без него 19 . Например, известно, что экспериментальная плотность объемного электролита для 50% EC с 1 M LiPF 6 в условиях окружающей среды составляет около ρ = 1,30 г/см 3 20,21 . Далее рассмотрим еще пять плотностей ρ = 1,3219, 1,3028, 1,2852, 1,2709, 1,2568 г/см 3 для системы ЭК 50%, чтобы исследовать, как плотность может влиять на динамические свойства электролитов. Заметим, что это отличается от многих исследований влияния солей на динамику электролитов, поскольку в нашем исследовании исходная концентрация соли фиксирована, а объем системы изменен.
Если учесть смешение ЭК и ДМК, общая плотность будет отличаться от плотности без него 19 . Например, известно, что экспериментальная плотность объемного электролита для 50% EC с 1 M LiPF 6 в условиях окружающей среды составляет около ρ = 1,30 г/см 3 20,21 . Далее рассмотрим еще пять плотностей ρ = 1,3219, 1,3028, 1,2852, 1,2709, 1,2568 г/см 3 для системы ЭК 50%, чтобы исследовать, как плотность может влиять на динамические свойства электролитов. Заметим, что это отличается от многих исследований влияния солей на динамику электролитов, поскольку в нашем исследовании исходная концентрация соли фиксирована, а объем системы изменен.
Динамика
Чтобы изучить влияние плотности ρ на подвижность электролитов, сначала рассмотрим константу диффузии D с использованием соотношения Эйнштейна, которое характеризуется среднеквадратичным смещением (СКО), определяемым как 22, 23
, где d — размерность системы, представляющая среднее значение по ансамблю. На рис. 1 рассчитаны D каждого компонента электролита в зависимости от ρ для ЕС 50%. Для всех компонентов D очень чувствителен к ρ по сравнению с другими жидкими системами 22 . When ρ decreases by Δ ρ = 0.0878 g/cm 3 from ρ = 1.3446 g/cm 3 to 1.2568 g/cm 3 , D of a Li + ion shows увеличивается в 5,140 и 2,672 раза при Тл = 300 К и 400 К соответственно. Мы также наблюдаем аналогичные увеличения в D для других компонентов: 4,554 и 2,715 для PF 9.0127 6 − ион, 4,007 и 2,661 для ЭК и 3,959 и 2,853 для ДМК при Тл = 300 К и 400 К соответственно. Это означает, что небольшое изменение плотности может оказать большое влияние на диффузионную способность электролитов. По мере увеличения T влияние ρ на D становится слабее.
На рис. 1 рассчитаны D каждого компонента электролита в зависимости от ρ для ЕС 50%. Для всех компонентов D очень чувствителен к ρ по сравнению с другими жидкими системами 22 . When ρ decreases by Δ ρ = 0.0878 g/cm 3 from ρ = 1.3446 g/cm 3 to 1.2568 g/cm 3 , D of a Li + ion shows увеличивается в 5,140 и 2,672 раза при Тл = 300 К и 400 К соответственно. Мы также наблюдаем аналогичные увеличения в D для других компонентов: 4,554 и 2,715 для PF 9.0127 6 − ион, 4,007 и 2,661 для ЭК и 3,959 и 2,853 для ДМК при Тл = 300 К и 400 К соответственно. Это означает, что небольшое изменение плотности может оказать большое влияние на диффузионную способность электролитов. По мере увеличения T влияние ρ на D становится слабее.

Показаны константы диффузии D каждого компонента электролита, ( a ) a Li + ион, ( b ) a PF 6 − ион, ( c ) EC и ( d ) DMC, как функция плотности 90 T = 300 К и 400 К для соотношения смеси растворителей EC 50%. Для сравнения также приводим константу диффузии D каждого компонента электролита при соотношении смеси растворителей EC 20% при плотности ρ = 1,2677 г/см 3 . Результаты показывают, что D показывает существенную зависимость ρ при фиксированном соотношении компонентов смеси растворителей. Как для катиона, так и для аниона D для EC 20% показывает сравнимую величину с D при ρ = 1,3219 г/см 3 для EC 50% при обеих температурах T 0= 0
Изображение в натуральную величину
Интересно, что ρ имеет сильную чувствительность D . Например, для жидкого ацетонитрила экспериментальное исследование показало, что уменьшение ρ примерно на Δ ρ = 0,1 г/см 3 желательно увеличить D в два раза при T = 298 K 124 Для воды показано, что уменьшение ρ примерно на Δ ρ = 0,2 г/см 3 желательно для увеличения D в два раза при Для органических жидких электролитов наши результаты показывают пятикратное увеличение D при ρ уменьшается менее чем на 0,1 г/см 3 при T = 300 K. Удивительно, что D быстро изменяется при относительно небольшой модификации ρ . Кроме того, D для EC 20% при ρ = 1,2677 г/см 3 показывает сравнимую звездную величину D для EC 50% при ρ = 1,9019 1,3219 1,3219 Таким образом, наши результаты показывают, что для улучшения D корректировка ρ может быть лучшей стратегией, чем уменьшение доли ЕС. Последний, как известно, является традиционным методом, принятым для увеличения диффузионной способности (или уменьшения вязкости) электролитов. В наших результатах небольшое изменение в ρ , такие как Δ ρ от ρ = 1,3446 г/см 3 до 1,3219 г/см 3 показывает большее увеличение в D из Li + . фракция от 50% до 20%. Эта ситуация аналогична для других компонентов и более высокой температуры. Обратите внимание, что небольшое изменение плотности на самом деле требует большого изменения давления. В нашем случае давление колеблется от менее 1 МПа до нескольких сотен МПа в соответствии с р .
Удивительно, что D быстро изменяется при относительно небольшой модификации ρ . Кроме того, D для EC 20% при ρ = 1,2677 г/см 3 показывает сравнимую звездную величину D для EC 50% при ρ = 1,9019 1,3219 1,3219 Таким образом, наши результаты показывают, что для улучшения D корректировка ρ может быть лучшей стратегией, чем уменьшение доли ЕС. Последний, как известно, является традиционным методом, принятым для увеличения диффузионной способности (или уменьшения вязкости) электролитов. В наших результатах небольшое изменение в ρ , такие как Δ ρ от ρ = 1,3446 г/см 3 до 1,3219 г/см 3 показывает большее увеличение в D из Li + . фракция от 50% до 20%. Эта ситуация аналогична для других компонентов и более высокой температуры. Обратите внимание, что небольшое изменение плотности на самом деле требует большого изменения давления. В нашем случае давление колеблется от менее 1 МПа до нескольких сотен МПа в соответствии с р .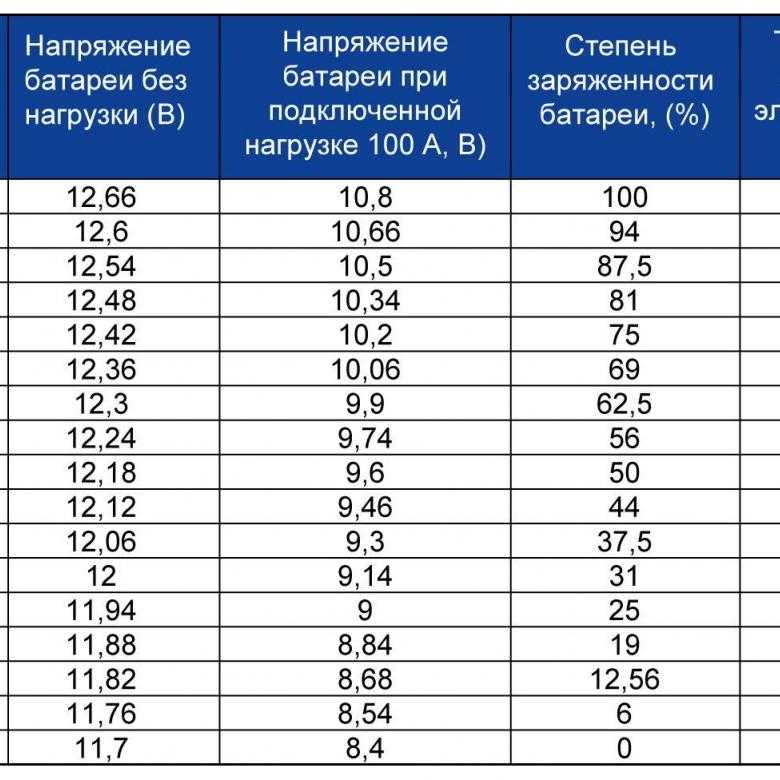 Для жидкого ацетонитрила был экспериментально исследован тот же диапазон давлений, и скорость изменения в D в нашем случае значительно больше, чем в жидком ацетонитриле 24 .
Для жидкого ацетонитрила был экспериментально исследован тот же диапазон давлений, и скорость изменения в D в нашем случае значительно больше, чем в жидком ацетонитриле 24 .
Чтобы увидеть, как ρ влияет на активационный барьер для диффузии, мы теперь исследуем температурную зависимость D для всех компонентов электролита для трех различных плотностей 19 , как показано на рис. 2. На графике Аррениуса , D хорошо вписывается в форму Аррениуса, D = D 0 exp(− E a / k B T ), where D 0 is a pre-factor and k B — постоянная Больцмана. Мы находим, что абсолютная величина наклона подобранной линии уменьшается при уменьшении ρ . На рис. 2(д) мы вычисляем энергию активации E a для диффузии по аррениусовской температурной зависимости Д 21,25 .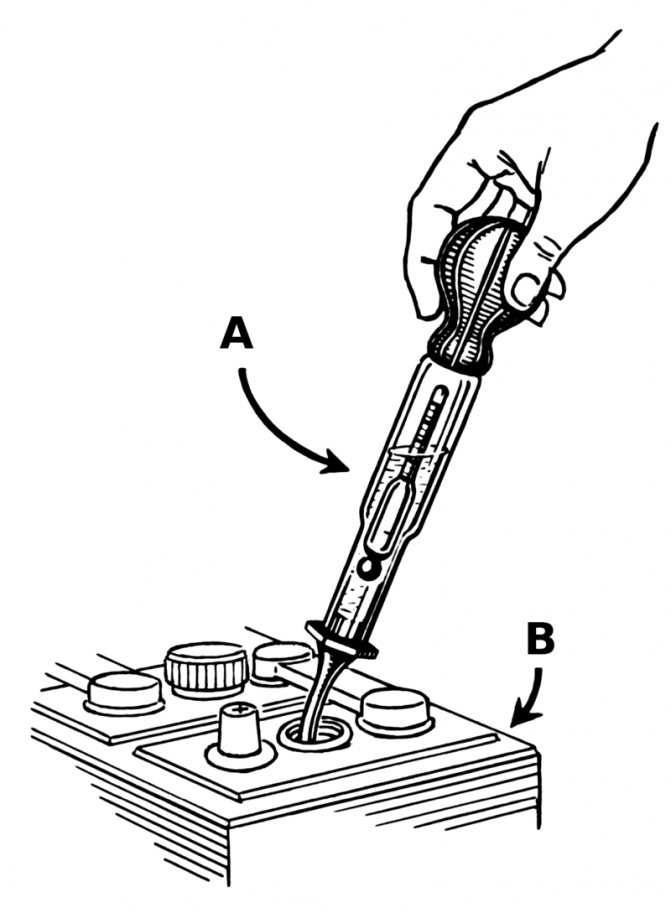 Наши результаты показывают, что E A при ρ = 1,3446 г/см 3 значительно больше, чем E A AT A AT A AT . Соотношение γ из E A AT ρ = 1,3446 г/см 3 до E A до E A 5 E A E .0236 γ = 1,34 для иона Li + , 1,33 для иона PF 6 − , 1,34 для ЭК и 1,37 для ДМК соответственно. По-видимому, E a увеличивается с одинаковой скоростью для всех компонентов электролита по мере увеличения ρ . Наши результаты показывают, что уменьшение ρ приводит к значительному уменьшению E a для диффузии. Обратите внимание, что величины E a для всех компонентов показано Li + > PF 6 − > EC > DMC, и это объясняет, почему DMC является самым быстрым компонентом, а ион Li + 1 самым медленным1 90,90,90.
Наши результаты показывают, что E A при ρ = 1,3446 г/см 3 значительно больше, чем E A AT A AT A AT . Соотношение γ из E A AT ρ = 1,3446 г/см 3 до E A до E A 5 E A E .0236 γ = 1,34 для иона Li + , 1,33 для иона PF 6 − , 1,34 для ЭК и 1,37 для ДМК соответственно. По-видимому, E a увеличивается с одинаковой скоростью для всех компонентов электролита по мере увеличения ρ . Наши результаты показывают, что уменьшение ρ приводит к значительному уменьшению E a для диффузии. Обратите внимание, что величины E a для всех компонентов показано Li + > PF 6 − > EC > DMC, и это объясняет, почему DMC является самым быстрым компонентом, а ион Li + 1 самым медленным1 90,90,90.
На графике Аррениуса показаны константы диффузии D каждого компонента электролита, ( a ) a Li + ион, ( b ) a PF 6 − 9ион 0012, ( c ) ЭЦ и ( d ) ДМК, для ЭЦ 50% при трех плотностях ρ = 1,2568, 1,3028 и 1,3446 г/см 3 . Все данные хорошо укладываются в форму Аррениуса, . Результаты показывают, что наклон аппроксимации увеличивается по мере увеличения ρ . Сплошные линии — ориентиры для глаз. ( e ) Энергии активации E a для диффузии иона Li + , иона PF 6 − , EC и DMC в зависимости от плотности ρ для EC 50%, рассчитанного по наклону графика Аррениуса. Ясно видно, что E a для всех компонентов электролита уменьшается по мере уменьшения ρ .
Изображение с полным размером
В описании самодиффузии Цванциг интерпретировал диффузию как пересечение энергетического барьера от одного локального минимума энергии к одному из других локальных минимумов энергии в энергетическом ландшафте по всему фазовому пространству 26 .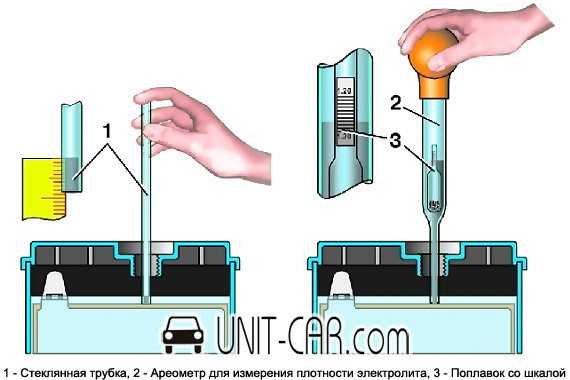 Энергетический ландшафт системы создается заново в каждый момент обновленными координатами и импульсами систем. С точки зрения энергетического ландшафта снижение на ρ может уменьшить энергетический барьер между локальными минимумами энергии, так что диффузия может быть усилена. По мере увеличения T влияние ρ будет уменьшаться, поскольку тепловая энергия становится достаточно большой для преодоления барьера. Наши результаты хорошо согласуются с интерпретацией Цванцига о диффузии.
Энергетический ландшафт системы создается заново в каждый момент обновленными координатами и импульсами систем. С точки зрения энергетического ландшафта снижение на ρ может уменьшить энергетический барьер между локальными минимумами энергии, так что диффузия может быть усилена. По мере увеличения T влияние ρ будет уменьшаться, поскольку тепловая энергия становится достаточно большой для преодоления барьера. Наши результаты хорошо согласуются с интерпретацией Цванцига о диффузии.
В дополнение к D вычисляем ионную проводимость λ определяем как 13,17,27,28
где z представляет собой заряд иона в единице элементарного заряда e и представляет собой среднее значение по ансамблю. Суммирование ведется по всем ионам системы. Как показано на рис. 3, λ для EC 50% существенно возрастает при уменьшении ρ . При уменьшении ρ до ρ = 1,2568 г/см 3 с 1,3446 г/см 3 , λ увеличивается почти в пять раз,95 D 9016 D 9016 В сочетании с результатами D , интересно, что λ также проявляет сильную чувствительность к ρ .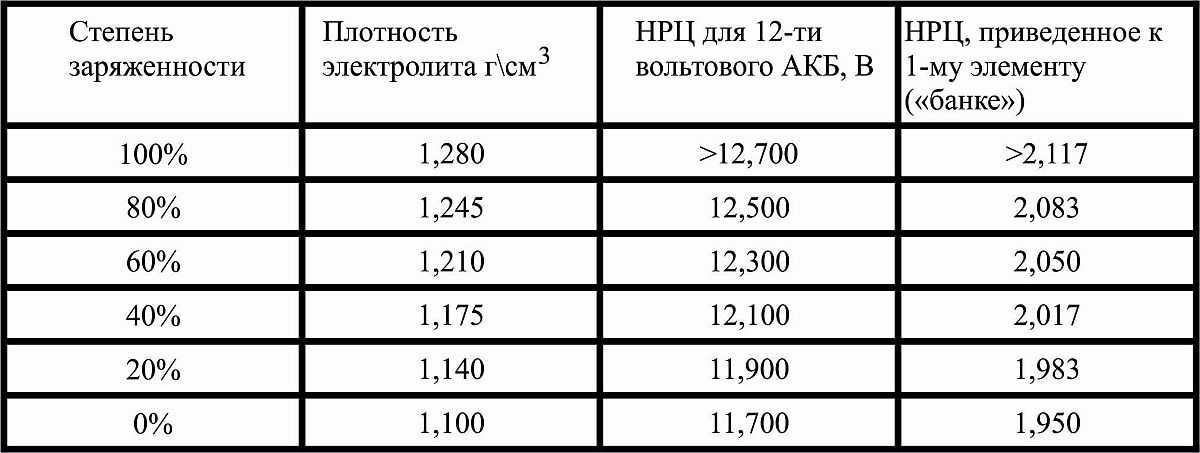 Мы также обнаружили, что когда ρ становится 1,3028 г/см 3 , λ для EC 50% показывает ту же величину, что и для EC 20%. Из-за конкуренции между подвижностью и спариванием ионов известно, что оптимальная доля растворителя ЭЦ для получения максимума в λ находится между 20% и 30% 1 . Наши результаты показывают, что существует альтернативный способ улучшить λ без изменения соотношения электролитов в смеси растворителей. А именно, корректировка ρ оказывает более существенное влияние на D и λ , чем изменение соотношения электролитов в смеси растворителей. Предположительно, быстрый рост D при уменьшении ρ приводит к неожиданной чувствительности λ на ρ .
Мы также обнаружили, что когда ρ становится 1,3028 г/см 3 , λ для EC 50% показывает ту же величину, что и для EC 20%. Из-за конкуренции между подвижностью и спариванием ионов известно, что оптимальная доля растворителя ЭЦ для получения максимума в λ находится между 20% и 30% 1 . Наши результаты показывают, что существует альтернативный способ улучшить λ без изменения соотношения электролитов в смеси растворителей. А именно, корректировка ρ оказывает более существенное влияние на D и λ , чем изменение соотношения электролитов в смеси растворителей. Предположительно, быстрый рост D при уменьшении ρ приводит к неожиданной чувствительности λ на ρ .
Показано на графике в зависимости от плотности ρ – ионная проводимость λ при температуре Тл = 300 К для соотношения растворителей в смеси EC 50%. Для сравнения также приводим λ для EC 20%. Подобно константе диффузии D, λ показывает существенную зависимость ρ. λ для EC 20% аналогично λ при ρ = 1,3219 г/см 3 для EC 50%.
Для сравнения также приводим λ для EC 20%. Подобно константе диффузии D, λ показывает существенную зависимость ρ. λ для EC 20% аналогично λ при ρ = 1,3219 г/см 3 для EC 50%.
Полноразмерное изображение
Теперь остается вопрос, какие свойства могут быть связаны с чувствительностью D и λ на ρ .
Структура сольватации
Далее мы исследуем влияние плотности на структуру сольватации иона Li + . Мы вычисляем (кумулятивное) координационное число n ( r ), определяемое как 11,27,29,30,31,32,33
где g ( r ) функция радиального распределения ( РДФ). На рис. 4(а) мы демонстрируем n ( r ) как функцию расстояния r из иона Li + для EC 50% и EC 20%. Как показано на рис. 4(a) и (b), структура сольватации иона Li + сильно различается в зависимости от соотношения растворителей EC и DMC 8,29,30,34 . Здесь следует отметить, что графики n ( r ) для всех исследованных нами плотностей EC 50% почти перекрываются друг с другом, что свидетельствует о том, что на сольватную структуру иона Li + изменение не влияет. из р . На рис. 4(б) число сольватации N c в первой сольватной оболочке, определенное как значение n ( r ) на первом плато на рис. 4(а), остается постоянным при изменении ρ . Количество каждого компонента в первой сольватной оболочке также одинаково для всех исследованных нами плотностей. Небольшое изменение ρ не вызывает реорганизации сольватной структуры иона Li + для данного соотношения растворителей электролитов.
Здесь следует отметить, что графики n ( r ) для всех исследованных нами плотностей EC 50% почти перекрываются друг с другом, что свидетельствует о том, что на сольватную структуру иона Li + изменение не влияет. из р . На рис. 4(б) число сольватации N c в первой сольватной оболочке, определенное как значение n ( r ) на первом плато на рис. 4(а), остается постоянным при изменении ρ . Количество каждого компонента в первой сольватной оболочке также одинаково для всех исследованных нами плотностей. Небольшое изменение ρ не вызывает реорганизации сольватной структуры иона Li + для данного соотношения растворителей электролитов.
( a ) Совокупные координационные числа n ( r ) ПФ 6 − иона, EC и DMC в зависимости от расстояния r r при температуре 01 + при 01 от Li 9ion T = 300 К для соотношений смеси растворителя EC 50% при плотности ρ = 1,3446 г/см 3 и EC 20% при плотности ρ = 1,2677 г/см 3 .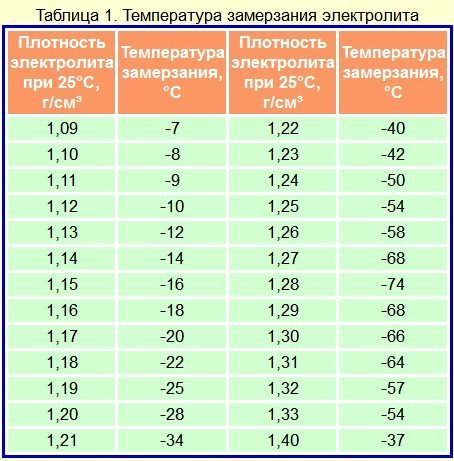 Сплошные и пунктирные линии обозначают случаи ЕС 50% и ЕС 20% соответственно. Обратите внимание, что мы вычисляем n ( r ) из позиций атома P для иона PF 6 − и атома O карбонильного кислорода как для EC, так и для DMC. ( b ) Число сольватации N c в первой сольватной оболочке иона Li + в зависимости от плотности ρ при температуре T 0= 0= символы обозначают случаи ЕС 50% и ЕС 20% соответственно. Далее приведем функции плотности вероятности P ( n ) иона Li + , которое представляет собой плотность вероятности того, что ион Li + будет иметь n соседей в первой сольватной оболочке для каждого соседа ( c ) всего номер, ( d ) a PF 6 − ион, ( e ) EC и ( f ) DMC.
Сплошные и пунктирные линии обозначают случаи ЕС 50% и ЕС 20% соответственно. Обратите внимание, что мы вычисляем n ( r ) из позиций атома P для иона PF 6 − и атома O карбонильного кислорода как для EC, так и для DMC. ( b ) Число сольватации N c в первой сольватной оболочке иона Li + в зависимости от плотности ρ при температуре T 0= 0= символы обозначают случаи ЕС 50% и ЕС 20% соответственно. Далее приведем функции плотности вероятности P ( n ) иона Li + , которое представляет собой плотность вероятности того, что ион Li + будет иметь n соседей в первой сольватной оболочке для каждого соседа ( c ) всего номер, ( d ) a PF 6 − ион, ( e ) EC и ( f ) DMC.
Изображение в полный размер
Далее мы изучаем функцию плотности вероятности P ( n ) для иона Li + , чтобы иметь n соседей в первой сольватной оболочке. Он описывает, сколько ионов Li + имеют n соседей в сольватной оболочке. Поскольку n ( r ) и N c являются значениями, усредненными по общему числу ионов Li + , подробное описание распределения состава в сольватной оболочке полезно для лучшего понимания структура сольватации. На рис. 4(c–f) мы демонстрируем P ( n ) для соседей общего числа, a PF 6 − ион, EC и DMC соответственно. Следует отметить, что P ( n ) показывает одинаковое распределение для всех плотностей ЕС 50%, тогда как оно показывает большую разницу в отношении изменения доли ЕС. Как для EC 50%, так и для EC 20% большинство ионов Li + имеют всего 6 соседей в сольватной оболочке. В то время как один или два аниона находятся в первой сольватной оболочке при EC 20%, Li 9Ионы 0011 + без анионов в оболочке становятся большинством при ЕС 50%. Процент ионов Li + является наибольшим при наличии одного или двух ЭК для ЭК 20% и четырех или пяти ЭК для ЭК 50%.
Он описывает, сколько ионов Li + имеют n соседей в сольватной оболочке. Поскольку n ( r ) и N c являются значениями, усредненными по общему числу ионов Li + , подробное описание распределения состава в сольватной оболочке полезно для лучшего понимания структура сольватации. На рис. 4(c–f) мы демонстрируем P ( n ) для соседей общего числа, a PF 6 − ион, EC и DMC соответственно. Следует отметить, что P ( n ) показывает одинаковое распределение для всех плотностей ЕС 50%, тогда как оно показывает большую разницу в отношении изменения доли ЕС. Как для EC 50%, так и для EC 20% большинство ионов Li + имеют всего 6 соседей в сольватной оболочке. В то время как один или два аниона находятся в первой сольватной оболочке при EC 20%, Li 9Ионы 0011 + без анионов в оболочке становятся большинством при ЕС 50%. Процент ионов Li + является наибольшим при наличии одного или двух ЭК для ЭК 20% и четырех или пяти ЭК для ЭК 50%.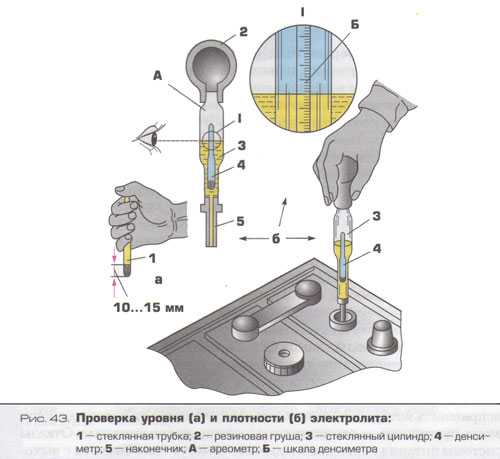 Для DMC P ( n ) показывает максимум при двух DMC для EC 20%, тогда как заселенность ионов Li + с одним DMC составляет большинство для EC 50%. Наши результаты показывают, что сольватная структура иона Li + сильно зависит от соотношения растворителей, но не зависит от изменения р . Таким образом, существенное увеличение D и λ при уменьшении ρ не сопровождается изменением структуры сольватации. Это означает, что можно увеличить подвижность электролитов, регулируя ρ , не нарушая сольватной структуры иона Li + .
Для DMC P ( n ) показывает максимум при двух DMC для EC 20%, тогда как заселенность ионов Li + с одним DMC составляет большинство для EC 50%. Наши результаты показывают, что сольватная структура иона Li + сильно зависит от соотношения растворителей, но не зависит от изменения р . Таким образом, существенное увеличение D и λ при уменьшении ρ не сопровождается изменением структуры сольватации. Это означает, что можно увеличить подвижность электролитов, регулируя ρ , не нарушая сольватной структуры иона Li + .
Динамика сольватации
Изучим теперь динамические свойства в первой сольватной оболочке иона Li + . Распределение времени пребывания (RTD) R ( t ) описывает долговечность первой сольватной оболочки иона Li + . Мы определяем время пребывания как время выхода объекта из первой сольватной оболочки иона Li + в первый раз. Обратите внимание, что по результатам n ( r ) на рис. 4(а) мы используем определение первой сольватной оболочки иона Li + в виде окружности с центром в ионе Li + с радиус 3,0 нм для карбонильного кислорода EC и DMC. На рис. 5 (а) и (б) мы представляем РДТ ЭК и ДМК на T = 300 K для различных плотностей EC 50%. На нем отчетливо видно, что RTD затухает быстрее при уменьшении ρ для обоих растворителей. Это означает, что растворители в первой сольватной оболочке легче замещаются другими для более низких ρ . Поскольку структура сольватации не зависит от небольшого изменения ρ , мы предполагаем, что тот же тип растворителя заменит ранее существовавший. RTD для EC 50% плотности ниже ρ = 1,3446 г/см 3 распадается быстрее, чем один для EC 20% как для EC, так и для DMC, предполагая, что долговечность сольватной оболочки становится слабее для низкого ρ в EC 50%, чем для EC 20%.
Обратите внимание, что по результатам n ( r ) на рис. 4(а) мы используем определение первой сольватной оболочки иона Li + в виде окружности с центром в ионе Li + с радиус 3,0 нм для карбонильного кислорода EC и DMC. На рис. 5 (а) и (б) мы представляем РДТ ЭК и ДМК на T = 300 K для различных плотностей EC 50%. На нем отчетливо видно, что RTD затухает быстрее при уменьшении ρ для обоих растворителей. Это означает, что растворители в первой сольватной оболочке легче замещаются другими для более низких ρ . Поскольку структура сольватации не зависит от небольшого изменения ρ , мы предполагаем, что тот же тип растворителя заменит ранее существовавший. RTD для EC 50% плотности ниже ρ = 1,3446 г/см 3 распадается быстрее, чем один для EC 20% как для EC, так и для DMC, предполагая, что долговечность сольватной оболочки становится слабее для низкого ρ в EC 50%, чем для EC 20%.

Распределения времени пребывания R ( t ) ( a ) ЭК и ( b ) ДМК в первой сольватной оболочке иона Li + при температуре T 3019 , Сплошные линии обозначают случаи EC 50% для различных плотностей, а пунктирная линия представляет случай EC 20% при плотности ρ = 1,2677 г/см 3 . Далее приведены характерные времена пребывания τ R ( c ) ЭК и ( d ) ДМК в зависимости от плотности ρ при температурах T = 300 К и 40. Для сравнения. , мы также представляем τ R для EC 20%.
Полноразмерное изображение
Поведение RTD можно понять по характерному времени пребывания τ R определено 35 as
At T = 300 K, the characteristic residence times at ρ = 1.3446 g/cm 3 for EC 50% are about 44.7 ps and 38.4 ps for EC and DMC, respectively, and it уменьшается до 21,5 пс и 17,5 пс при уменьшении плотности до ρ = 1,2568 г/см 3 , как показано на рис.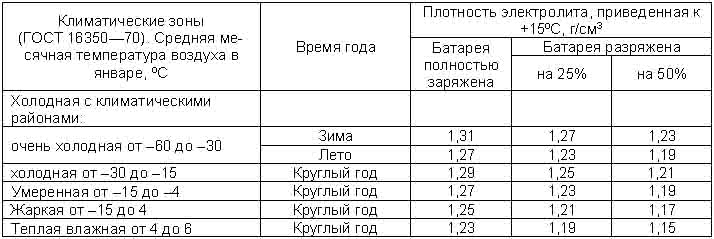 5(c) и (d). При T = 400 K τ R уменьшается с 15,0 пс и 13,2 пс до 9,7 пс и 8,2 пс для EC и DMC соответственно. Для обеих температур τ R показывает существенную зависимость от ρ , что указывает на то, что чувствительность D по ρ тесно связана с длительностью сольватной оболочки в дополнение к энергии активации E a для диффузии.
5(c) и (d). При T = 400 K τ R уменьшается с 15,0 пс и 13,2 пс до 9,7 пс и 8,2 пс для EC и DMC соответственно. Для обеих температур τ R показывает существенную зависимость от ρ , что указывает на то, что чувствительность D по ρ тесно связана с длительностью сольватной оболочки в дополнение к энергии активации E a для диффузии.
Поскольку РТД описывает быструю кинетику динамики сольватации 35 , мы теперь исследуем медленную кинетику длительности сольватной оболочки иона Li + . Чтобы охарактеризовать динамику сольватации в длительном временном масштабе, мы определяем функцию корреляции местонахождения (RCF) C ( t ) 17,35 as
где h ( t ) равно единице, когда объект находится в первой сольватной оболочке иона Li + 2 5 ) в противном случае равен нулю. В то время как RTD представляет собой время непрерывного пребывания, в течение которого растворитель в сольватной оболочке постоянно остается неповрежденным, RCF описывает время прерывистого пребывания с учетом того, что растворитель в сольватной оболочке остается неповрежденным только в момент времени 9. 0236 t , учитывая, что он был цел в момент времени t = 0. На рис. . RCF показывает аналогичное поведение RTD в отношении ρ . Это просто показывает, что RCF затухает быстрее для более низких значений ρ .
0236 t , учитывая, что он был цел в момент времени t = 0. На рис. . RCF показывает аналогичное поведение RTD в отношении ρ . Это просто показывает, что RCF затухает быстрее для более низких значений ρ .
Корреляционные функции места жительства C ( t ) of ( а ) ЭК и ( б ) ДМК в первой сольватной оболочке иона Li + при температуре Тл = 300 К. кружки представляют случай ЕС 20% при плотности ρ = 1,2677 г/см 3 . Далее показаны характерные времена корреляции пребывания τ C ( c ) EC и ( d ) DMC в зависимости от плотности ρ при температурах T = 300 K и T = 400 K для EC 50%. Для сравнения также приводим τ C для EC 20%.
Изображение полного размера
Теперь определим время корреляции резидентства τ C как время, необходимое для того, чтобы C ( t ) затухло в 9,530 3 2 230 3 2 e раз. При T = 300 K время корреляции пребывания EC колеблется от 3 нс до 10 нс, а для DMC оно колеблется в половине значения τ C ЕС. At T = 300 K, the residence correlation time of EC decreases from τ C = 9.3 ns to 3.0 ns as density decreases from ρ = 1.3446 g/cm 3 to 1.2568 g/cm 3 . При повышении температуры до T = 400 K τ C становится меньше 1 ns во всем исследованном нами диапазоне плотностей. Для DMC поведение τ C по отношению к ρ такие же, как для EC, хотя τ C DMC меньше, чем τ EC для обеих температур. Уменьшение ? Поскольку медленная кинетика динамики сольватации тесно связана с диффузионной динамикой 35 , это свидетельствует о том, что чувствительность D на ρ связана с прочностью сольватной оболочки.
При T = 300 K время корреляции пребывания EC колеблется от 3 нс до 10 нс, а для DMC оно колеблется в половине значения τ C ЕС. At T = 300 K, the residence correlation time of EC decreases from τ C = 9.3 ns to 3.0 ns as density decreases from ρ = 1.3446 g/cm 3 to 1.2568 g/cm 3 . При повышении температуры до T = 400 K τ C становится меньше 1 ns во всем исследованном нами диапазоне плотностей. Для DMC поведение τ C по отношению к ρ такие же, как для EC, хотя τ C DMC меньше, чем τ EC для обеих температур. Уменьшение ? Поскольку медленная кинетика динамики сольватации тесно связана с диффузионной динамикой 35 , это свидетельствует о том, что чувствительность D на ρ связана с прочностью сольватной оболочки.
Обсуждение
Повышение подвижности электролитов имеет решающее значение для производительности батареи. Традиционным способом увеличения подвижности при данной температуре является увеличение доли линейных карбонатов в бинарных растворителях электролитов 17 . Однако увеличение количества линейных растворителей ограничивается ионным связыванием солей, вызывающим снижение ионной проводимости. Поэтому представляет большой интерес найти оптимальное соотношение смесей растворителей, обеспечивающее максимальную ионную проводимость. В этом аспекте наши результаты показывают, что плотность электролитов может оказывать существенное влияние на динамику электролитов. Даже влияние плотности может иногда давать более впечатляющие результаты, чем соотношение смеси растворителей.
Наше исследование фундаментальных свойств объемных электролитов показывает, что органические жидкие электролиты, состоящие из ЭЦ и ДМК, обладают большей чувствительностью диффузионной динамики к плотности, чем другие жидкости 22,24,36 . Хотя небольшое изменение плотности существенно изменяет энергию активации диффузии, оно не вызывает реорганизации сольватной структуры иона Li + . Скорее, уменьшение плотности вызывает более быструю динамику сольватации как в краткосрочном, так и в долгосрочном масштабе. Это указывает на то, что разрушение и восстановление сольватной оболочки Li 9Ионы 0011 + быстро возникают при уменьшении плотности. Уменьшение плотности, то есть увеличение молярного объема, дает больше возможностей для диффузии и больше шансов прервать сольватную оболочку растворителями, находящимися вне оболочки. Связывание растворителей с катионом обычно является одной из основных причин вязкости системы 37,38,39 . Таким образом, частая реформация сольватной оболочки будет способствовать повышению диффузионной способности. Это объясняет чувствительность коэффициента диффузии к плотности.
Хотя небольшое изменение плотности существенно изменяет энергию активации диффузии, оно не вызывает реорганизации сольватной структуры иона Li + . Скорее, уменьшение плотности вызывает более быструю динамику сольватации как в краткосрочном, так и в долгосрочном масштабе. Это указывает на то, что разрушение и восстановление сольватной оболочки Li 9Ионы 0011 + быстро возникают при уменьшении плотности. Уменьшение плотности, то есть увеличение молярного объема, дает больше возможностей для диффузии и больше шансов прервать сольватную оболочку растворителями, находящимися вне оболочки. Связывание растворителей с катионом обычно является одной из основных причин вязкости системы 37,38,39 . Таким образом, частая реформация сольватной оболочки будет способствовать повышению диффузионной способности. Это объясняет чувствительность коэффициента диффузии к плотности.
Несмотря на то, что плотность может значительно повлиять на мобильность системы, мы хотели бы отметить, что это не приводит к непосредственному улучшению производительности батареи.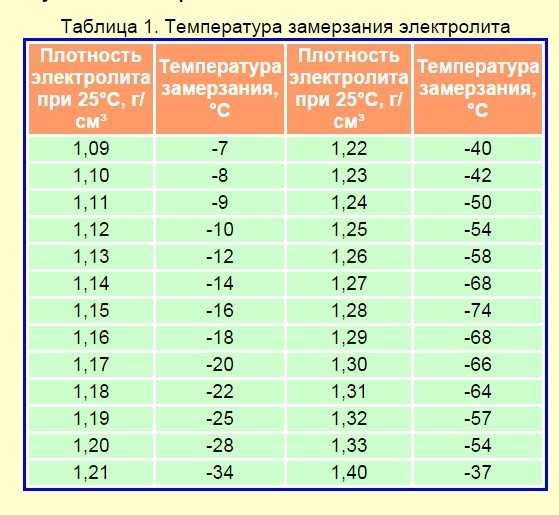 Например, число переноса, доля общего тока, переносимого данным видом ионов, является одним из основных свойств, характеризующих эффективность электролитов 40,41 . В этом случае число переноса не увеличивается быстро при уменьшении плотности, так как константы диффузии как катионов, так и анионов увеличиваются с одинаковой скоростью. Наши результаты, однако, будут свидетельствовать о том, что плотность может играть роль в повышении мобильности. Наконец, наше фундаментальное исследование объемных электролитов предложит интригующую точку для понимания и разработки электролитов литий-ионных аккумуляторов.
Например, число переноса, доля общего тока, переносимого данным видом ионов, является одним из основных свойств, характеризующих эффективность электролитов 40,41 . В этом случае число переноса не увеличивается быстро при уменьшении плотности, так как константы диффузии как катионов, так и анионов увеличиваются с одинаковой скоростью. Наши результаты, однако, будут свидетельствовать о том, что плотность может играть роль в повышении мобильности. Наконец, наше фундаментальное исследование объемных электролитов предложит интригующую точку для понимания и разработки электролитов литий-ионных аккумуляторов.
Методы
Мы провели обширное моделирование методом молекулярной динамики (МД) неводных электролитов литий-ионных аккумуляторов, состоящих из раствора 1M соли LiPF 6 в бинарной смеси растворителей EC и DMC. Мы провели все симуляции, используя пакет моделирования MD, LAMMPS 42 . Мы внедрили силовое поле OPLS/AA для описания молекулярного взаимодействия растворителей. Мы рассчитали дальнодействующие взаимодействия, используя алгоритм частица-частица-частица-сетка (PPPM). Моделирование выполняется в NVT ансамбль, где N, V и T — количество молекул, объем и температура соответственно. Линейный размер окна моделирования колеблется от L = 5,2672 нм до 5,3872 нм в зависимости от плотности. Во время моделирования мы поддерживали постоянную температуру с помощью термостата Ноуза-Гувера. Мы применили периодические граничные условия во всех трех направлениях окна моделирования. Мы использовали 1 фс в качестве временного шага моделирования.
Мы рассчитали дальнодействующие взаимодействия, используя алгоритм частица-частица-частица-сетка (PPPM). Моделирование выполняется в NVT ансамбль, где N, V и T — количество молекул, объем и температура соответственно. Линейный размер окна моделирования колеблется от L = 5,2672 нм до 5,3872 нм в зависимости от плотности. Во время моделирования мы поддерживали постоянную температуру с помощью термостата Ноуза-Гувера. Мы применили периодические граничные условия во всех трех направлениях окна моделирования. Мы использовали 1 фс в качестве временного шага моделирования.
Мы исследовали соотношение смеси растворителей EC:DMC = 50%:50% и 20%:80% (в об.%). Если две системы имеют одинаковый объем и не учитывается эффект смешивания двух систем, конечные плотности двух смесей растворителей основаны на индивидуальных плотностях EC и DMC 1,5 is ρ = 1,3446 г/см 3 и 1,2677 г/см 3 (включая соль LiPF 6 ) для EC 50% и EC 20% соответственно.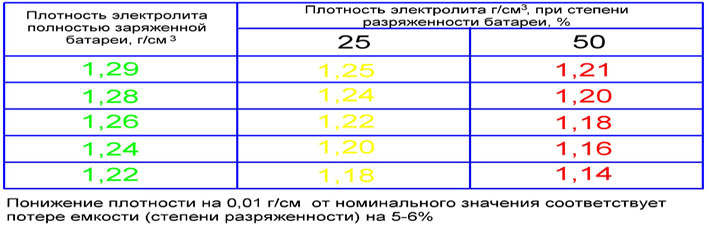 Поскольку смешанная плотность бинарных растворителей, используемых в экспериментах, оказывается ниже приведенной выше плотности 21 , мы выбрали еще пять случаев более низких плотностей ρ = 1,2568, 1,2709, 1,2852, 1,3028 и 1,3219 г/см 3 для EC 50%, чтобы исследовать, как плотность влияет на динамику системы, и сравнить с результатами смеси растворителей EC 20%.
Поскольку смешанная плотность бинарных растворителей, используемых в экспериментах, оказывается ниже приведенной выше плотности 21 , мы выбрали еще пять случаев более низких плотностей ρ = 1,2568, 1,2709, 1,2852, 1,3028 и 1,3219 г/см 3 для EC 50%, чтобы исследовать, как плотность влияет на динамику системы, и сравнить с результатами смеси растворителей EC 20%.
Дополнительная информация
Как цитировать эту статью : Han, S. Заметное влияние плотности на динамику неводных электролитов. Науч. 7 , 46718; doi: 10.1038/srep46718 (2017).
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Ссылки
Xu, K. Неводные жидкие электролиты для аккумуляторных батарей на основе лития. Хим. Ред. 104 , 4303–4417 (2004 г.
 ).
).КАС Статья Google ученый
Аурбах, Д. и др. Дизайн растворов электролитов для Li и Li-ion аккумуляторов: обзор. Электрохим. Acta 50 , 247–254 (2004).
КАС Статья Google ученый
Гуденаф Дж. Б. и Ким Ю. Проблемы с перезаряжаемыми литиевыми батареями. Хим. Матер. 22 , 587–603 (2010).
КАС Google ученый
Этачери, В. и др. Проблемы разработки перспективных литий-ионных аккумуляторов: обзор. Энергетика Окружающая среда. науч. 4 , 3243–3262 (2011).
КАС Статья Google ученый
Сюй, К. Электролиты и промежуточные фазы в литий-ионных батареях и не только. Хим. Ред. 114 , 11503–11618 (2014 г.
 ).
).КАС Статья Google ученый
Сюй, К. и др. Сольватационная оболочка Li + в неводных электролитах и ее влияние на химию интерфейса графит/электролит. J. Phys. хим. C 111 , 7411–7421 (2007 г.).
КАС Статья Google ученый
Сюй, К. Процесс переноса заряда на границе раздела графит/электролит и структура сольватной оболочки Li + в неводных электролитах. Дж. Электрохим. соц. 154 , А162–А167 (2007 г.).
КАС Статья Google ученый
фон Вальд Креше, А., Бородин, О. и Сюй, К. Корреляция структуры сольватной оболочки Li + с межфазной химией на графите. J. Phys. хим. С 116 , 26111–26117 (2012).
КАС Статья Google ученый
Bogle, X.
 et al. Понимание взаимодействия Li + с растворителем в неводном карбонатном электролите с помощью 17 O ЯМР. J. Phys. хим. лат. 4 , 1664–1668 (2013).
et al. Понимание взаимодействия Li + с растворителем в неводном карбонатном электролите с помощью 17 O ЯМР. J. Phys. хим. лат. 4 , 1664–1668 (2013).КАС Статья Google ученый
Ни, М. и др. Роль структуры раствора в формировании межфазной границы твердого электролита на графите с LiPF6 в пропиленкарбонате. J. Phys. хим. C 117 , 25381–25389 (2013).
КАС Статья Google ученый
Йорн Р., Кумар Р., Абрахам Д. П. и Вот Г. А. Атомистическое моделирование интерфейса электрод-электролит в литий-ионных системах накопления энергии: структурирование электролита. J. Phys. хим. C 117 , 3747–3761 (2013).
КАС Статья Google ученый
Бородин О., Бедров Д. Межфазная структура и динамика компонентов ТЭИ алкилдикарбоната лития в контакте с электролитом литиевой батареи.
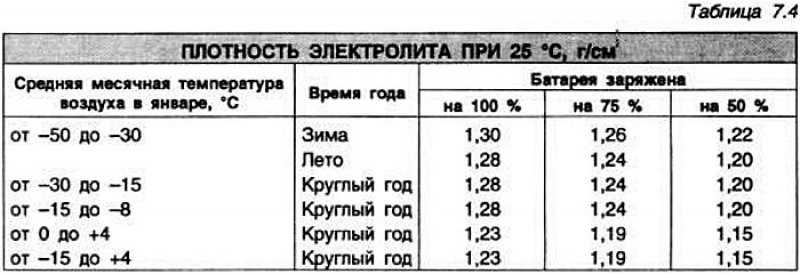 J. Phys. хим. C 118 , 18362–18371 (2014).
J. Phys. хим. C 118 , 18362–18371 (2014).КАС Статья Google ученый
Tenney, C.M. & Cygan, R.T. Анализ молекулярных кластеров в моделировании электролитов литий-ионных аккумуляторов. J. Phys. хим. С 117 , 24673–24684 (2013).
КАС Статья Google ученый
Сео, Д. М. и др. Роль смешанной сольватации и ионного спаривания в структуре растворов электролитов литий-ионных аккумуляторов. J. Phys. хим. C 119 , 14038–14046 (2015).
КАС Статья Google ученый
Мацуда Ю., Накашима Х., Морита М. и Такасу Ю. Поведение некоторых ионов в смешанных органических электролитах аккумуляторов с высокой плотностью энергии. Дж. Электрохим. Soc 128 , 2552–2556 (1981).
КАС Статья Google ученый
Soetens, J.
 -C., Millot, C., Maigret, B. & Bakó, I. Моделирование молекулярной динамики и рентгеноструктурные исследования этиленкарбоната, пропиленкарбоната и диметилкарбоната в жидкой фазе. Дж. Мол. жидкость 92 , 201–216 (2001).
-C., Millot, C., Maigret, B. & Bakó, I. Моделирование молекулярной динамики и рентгеноструктурные исследования этиленкарбоната, пропиленкарбоната и диметилкарбоната в жидкой фазе. Дж. Мол. жидкость 92 , 201–216 (2001).КАС Статья Google ученый
Бородин, О. и Смит, Г.Д. Квантово-химическое и молекулярно-динамическое моделирование диметилкарбоната: электролит карбоната этилена, легированный LiPF6. J. Phys. хим. B 113 , 1763–1776 (2009).
КАС Статья Google ученый
Масиа, М., Пробст, М. и Рей, Р. Этиленкарбонат–Li + : теоретическое исследование структурных и колебательных свойств в газовой и жидкой фазах. J. Phys. хим. B 108 , 2016–2027 (2004).
КАС Статья Google ученый
Hayamizu, K.
 Температурная зависимость коэффициентов самодиффузии ионов и растворителей в одиночных растворах этиленкарбоната, пропиленкарбоната и диэтилкарбоната и бинарных растворах LiPF6 этиленкарбонат + диэтилкарбонат, изученная методом ЯМР. J. Chem. англ. Данные 57 , 2012–2017 (2012).
Температурная зависимость коэффициентов самодиффузии ионов и растворителей в одиночных растворах этиленкарбоната, пропиленкарбоната и диэтилкарбоната и бинарных растворах LiPF6 этиленкарбонат + диэтилкарбонат, изученная методом ЯМР. J. Chem. англ. Данные 57 , 2012–2017 (2012).КАС Статья Google ученый
Сигма-Олдрич. www.sigmaaldrich.com/catalog/product/aldrich/746711.
Порион, П. и др. Сравнительное исследование транспортных свойств LiFAP и LiPF6 в алкилкарбонатах в качестве электролитов с помощью измерений проводимости, вязкости и самодиффузии ЯМР. Электрохим. Acta 114 , 95–104 (2013).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Хан, С., Кумар, П. и Стэнли, Х. Э. Отсутствие аномалии диффузии воды в направлении, перпендикулярном гидрофобным наноограждающим стенкам.
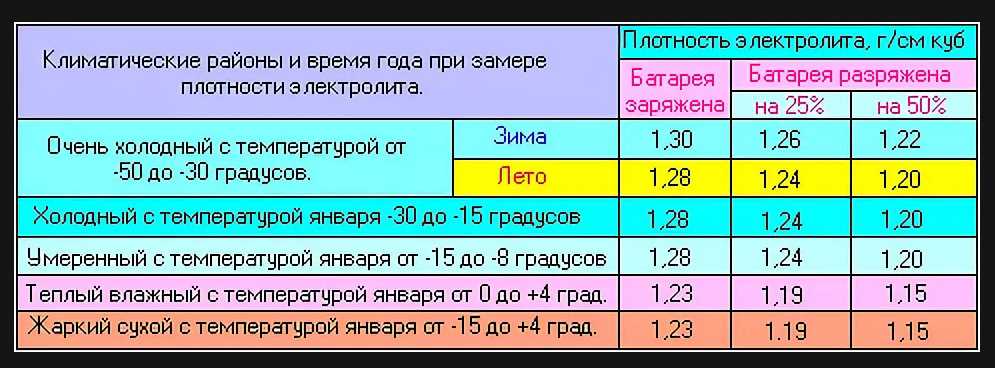 Физ. Ред. E 77 , 030201 (2008 г.).
Физ. Ред. E 77 , 030201 (2008 г.).ОБЪЯВЛЕНИЕ Статья Google ученый
Хан С., Чой М. Ю., Кумар П. и Стэнли Х. Э. Фазовые переходы в нанопленках замкнутой воды. Нац. физ. 6 , 685–689 (2010).
КАС Статья Google ученый
Hurle, R.L. & Woolf, L.A. Самодиффузия в жидком ацетонитриле под давлением. J. Chem. Soc., Faraday Trans. 1. 78 , 2233–2238 (1982).
КАС Статья Google ученый
Окубо М. и др. Определение энергии активации диффузии ионов Li в электродах. J. Phys. хим. Б 113 , 2840–2847 (2009).
КАС Статья Google ученый
Цванциг, Р. О связи между самодиффузией и вязкостью жидкостей.
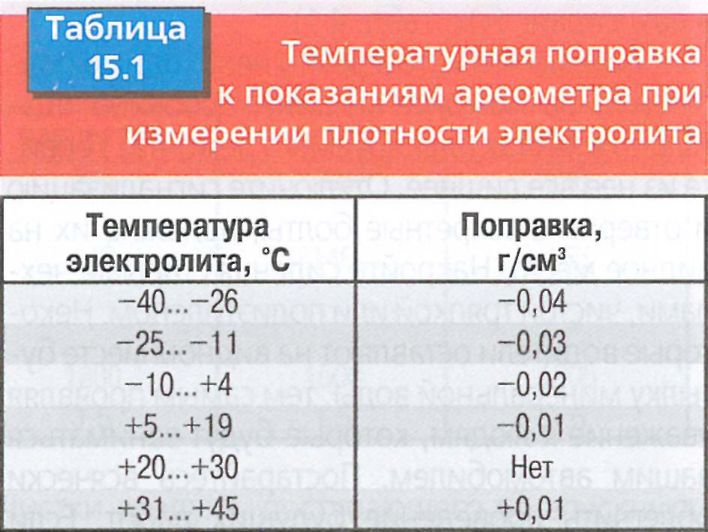 J. Chem. физ. 79 , 4507–4508 (1983).
J. Chem. физ. 79 , 4507–4508 (1983).КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Кондо, К. и др. Электропроводность и сольватация ионов Li + LiPF6 в растворах пропиленкарбоната. J. Phys. хим. B 104 , 5040–5044 (2000).
КАС Статья Google ученый
Hayamizu, K., Aihara, Y., Arai, S. & Martinez, C.G. Импульсно-градиентное спиновое эхо 14 органических электролитов, содержащих LiN(SO2CF3)2. J. Phys. хим. B 103 , 519–524 (1999).
КАС Статья Google ученый
Бородин О. и др. Конкурентная сольватация литием линейных и циклических карбонатов из квантовой химии. Физ. хим. хим. физ. 18 , 164–175 (2016).
КАС Статья Google ученый
Скармутсос И.
 , Поннучами В., Ветере В. и Мосса С. Ли Сольватация + в чистых, бинарных, тройных смесях органических карбонатных электролитов. J. Phys. хим. С 119 , 4502–4515 (2015).
, Поннучами В., Ветере В. и Мосса С. Ли Сольватация + в чистых, бинарных, тройных смесях органических карбонатных электролитов. J. Phys. хим. С 119 , 4502–4515 (2015).КАС Статья Google ученый
Giorgini, M.G. et al. Структура сольватации вокруг иона Li + в смешанных циклических/линейных карбонатных растворах, раскрытая эффектом несовпадения комбинационного рассеяния. J. Phys. хим. лат. 6 , 3296–3302 (2015).
КАС Статья Google ученый
Камеда Ю. и др. Структура сольватации Li + в концентрированных растворах LiPF6–пропиленкарбонат. J. Phys. хим. B 111 , 6104–6109 (2007 г.).
КАС Статья Google ученый
Ян, Л., Сяо, А. и Лучт, Б.Л. Исследование сольватации в электролитах ионно-литиевых аккумуляторов с помощью ЯМР-спектроскопии.
 Дж. Мол. жидкость 154 , 131–133 (2010).
Дж. Мол. жидкость 154 , 131–133 (2010).КАС Статья Google ученый
Ганеш П., Цзян Д. и Кент П. Р. К. Точные статические и динамические свойства жидких электролитов для литий-ионных аккумуляторов на основе молекулярной динамики ab initio. J. Phys. хим. B 115 , 3085–3090 (2011).
КАС Статья Google ученый
Хан, С., Кумар, П. и Стэнли, Х. Э. Динамика водородных связей воды в квазидвумерной гидрофобной нанопоровой щели. Физ. Ред. Д 79 , 041202 (2009).
ОБЪЯВЛЕНИЕ Статья Google ученый
Хан, С. Аномальное изменение динамики сверхкритической жидкости. Физ. Ред. E 84 , 051204 (2011 г.).
ОБЪЯВЛЕНИЕ Статья Google ученый
Поступна О.
 О., Колесник Ю. В., Калугин О. Н., Преждо О. В. Микроскопическая структура и динамика растворов LiBF4 в циклических и линейных карбонатах. J. Phys. хим. B 115 , 14563–14571 (2011).
О., Колесник Ю. В., Калугин О. Н., Преждо О. В. Микроскопическая структура и динамика растворов LiBF4 в циклических и линейных карбонатах. J. Phys. хим. B 115 , 14563–14571 (2011).КАС Статья Google ученый
Морита М., Асаи Ю., Йошимото Н. и Исикава М. Спектроскопическое исследование растворов органических электролитов на основе бинарных систем растворителей этиленкарбоната с растворителями низкой вязкости, которые растворяют различные соли лития. J. Chem. соц. Фарадей Транс. 94 , 3451–3456 (1998).
КАС Статья Google ученый
Онг, М. Т. и др. Сольватация и диффузия ионов лития в объемных органических электролитах из первопринципной и классической реактивной молекулярной динамики. J. Phys. хим. B 119 , 1535–1545 (2015).
КАС Статья Google ученый
Лу, Ю.
 и др. Стабильное циклирование литий-металлических аккумуляторов с использованием электролитов с высоким числом переноса. Доп. Энергия Матер. 5 , 1402073 (2015).
и др. Стабильное циклирование литий-металлических аккумуляторов с использованием электролитов с высоким числом переноса. Доп. Энергия Матер. 5 , 1402073 (2015).Артикул Google ученый
млн лет, Л. и др. Высокопроводящие, сульфированные, сшитые под УФ-излучением сепараторы для Li-S аккумуляторов. Хим. Мат. 28 , 5147–5154 (2016).
КАС Статья Google ученый
Плимптон, С. Дж. Быстрые параллельные алгоритмы для молекулярной динамики ближнего действия. Дж. Комп. физ. 117 , 1–19 (1995).
КАС ОБЪЯВЛЕНИЯ Статья Google ученый
Download references
Author information
Authors and Affiliations
CAE Group, Platform Technology Lab, Samsung Advanced Institute of Technology, Suwon, Gyeonggi, 16678, Korea
Sungho Han
Authors
- Sungho Han
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
S.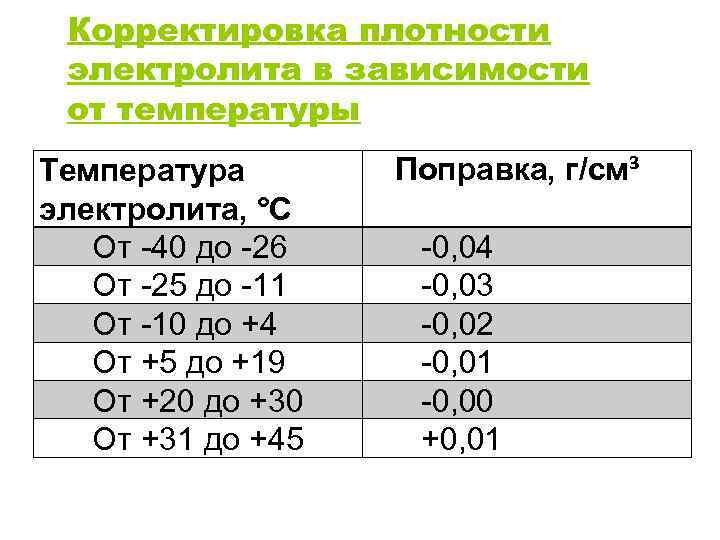 H. разработал исследование; проведено моделирование; проанализировал данные и написал статью.
H. разработал исследование; проведено моделирование; проанализировал данные и написал статью.
Автор, ответственный за переписку
Сунхо Хан.
Декларация этики
Конкурирующие интересы
Автор заявляет об отсутствии конкурирующих финансовых интересов.
Права и разрешения
Эта работа находится под лицензией Creative Commons Attribution 4.0 International License. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке; если материал не включен в лицензию Creative Commons, пользователям необходимо будет получить разрешение от держателя лицензии на воспроизведение материала. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Структура и динамика литиевой сольватной оболочки неводных электролитов
- Сунхо Хан
Научные отчеты (2019)
Динамические особенности молекул воды в сверхконцентрированных водных электролитах
- Сунхо Хан
Научные отчеты (2018)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества.