Таблица степеней окисления химических элементов. Возможные степени окисления химических элементов. Стандартные, высшие, низшие, редкие степени окисления, исключения. Максимальная степень окисления и минимальная степень окисления.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Степени окисления элементов — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Степень окисления — условный заряд атома в соединении, если считать, что связь в нём ионная.
Степень окисления равна числу электронов, смещённых от атома или к атому.
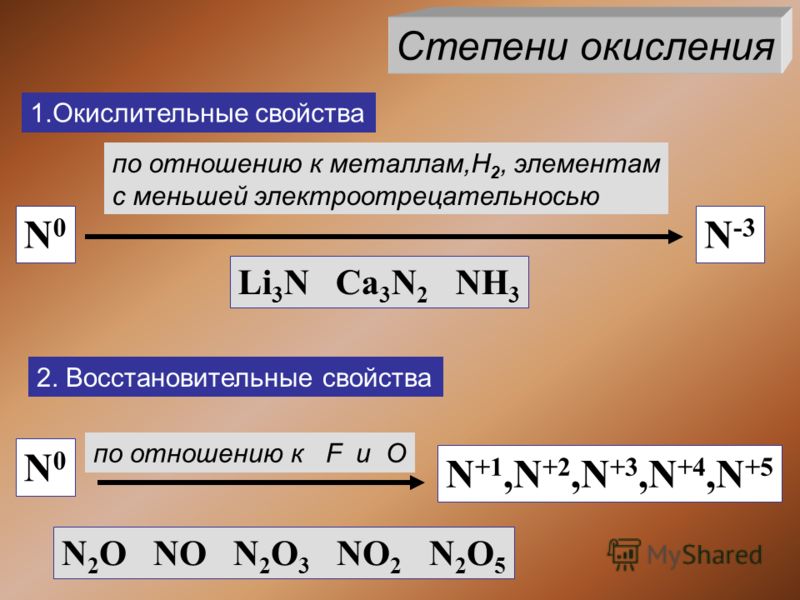
Если электроны смещаются от атома, то его степень окисления положительная. Положительную степень окисления в соединениях имеет атом менее электроотрицательного элемента.
Если смещение электронов происходит к атому, то его степень окисления отрицательная.
Обрати внимание!
В простых веществах сдвига электронов нет, и степень окисления атомов равна \(0\).
Значение степени окисления указывают над знаком химического элемента:
Ca+2O−2, N02.
Обрати внимание!
В сложных веществах степень окисления атомов металла всегда положительная.
Максимальное значение степени окисления металла можно определить по номеру группы, в которой элемент находится в Периодической таблице. Оно равно числу валентных электронов в атоме.
Металлы главных подгрупп в соединениях, как правило, проявляют постоянную степень окисления. У металлов \(IA\) группы она равна \(+1\):
Na+1Cl−1, Li+12O−2.
У металлов \(IIA\) группы степень окисления всегда равна \(+2\):
Mg+2F−12, Ba+2O−2.
Степень окисления алюминия — \(+3\):
Al+32S−23.
Металлы побочных подгрупп проявляют переменные степени окисления:
Fe+2O−2, Fe+32O−23.
Обрати внимание!
Атомы неметаллов имеют как положительные, так и отрицательные степени окисления.
У самого электроотрицательного из неметаллов фтора степень окисления постоянная и равна \(–1\):
H+1F−1, K+1F−1.
Кислород почти всегда имеет степень окисления \(–2\):
Na+12O−2, C+4O2−2.
Исключения — фторид кислорода и пероксиды:
O+2F−12, H+12O−12.
В большинстве соединений степень окисления водорода \(+1\), но в соединениях с металлами она равна \(–1\):
H+1Br−1, N−3H+13, Na+1H−1, Ca+2h3−1.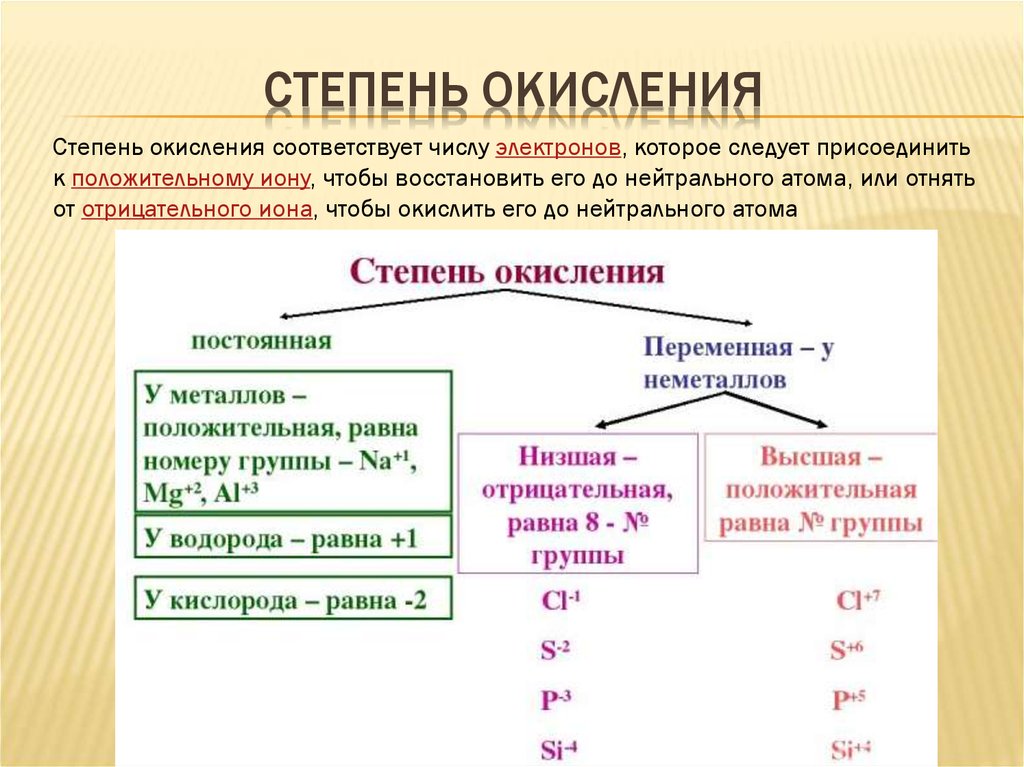
У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы:
C+4, N+5, S+6.
Минимальное значение степени окисления можно определить, если от номера группы отнять \(8\). Оно определяется числом электронов, которые необходимы атому до завершения внешнего электронного слоя:
C−4, N−3, S−2.
Урок №66. Валентность и степень окисления. Правила определения степеней окисления элементов
I. Валентность
Валентность химических элементов (повторение)
II. Степень окисления (новый
материал)
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
F +9 )2)7
Na +11 )2)8)1
— Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
— Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
— Оба атома имеют незавершённый внешний уровень?
— Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион — анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион — катион)
— Процесс отдачи электронов атомом, называется окислением. — Атом,
отдающий электроны и повышающий свою степень окисления, окисляется и
называется восстановителем. — Процесс принятия электронов атомом, называется восстановлением. — Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем. |
Как определить степень окисления атома в ПСХЭ Д.И. Менделеева?
№1. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю — Na0, P40, O20
№2. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0,
а в сложном ионе его заряду.
Например, H+1N+5O3-2 : (+1)*1+(+5)*1+(-2)*3 = 0
[S+6O4 -2]2-: (+6)*1+(-2)*4 = -2
№3. Для элементов главных подгрупп в бинарных соединениях А+nхВ—mу:
Высшая СО (+n) = номеру группы Nгруппы
Низшая СО (-m) = Nгруппы–8
4. Водород обычно проявляет степень окисления (СО) +1
(исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1)
5. Кислород обычно проявляет СО -2
(исключения: О+2F2, H2O2-1 – перекись водорода)
6. Фтор проявляет всегда СО равную -1 (F-1)
7. Металлы главных подгрупп I—III групп проявляют +n=Nгруппы
8. Металлы главных подгрупп групп IV—VII и металлы побочных
подгрупп проявляют +n, согласно правилу №2 (с учётом рядом стоящего аниона
– см. ТР)
Металлы главных подгрупп групп IV—VII и металлы побочных
подгрупп проявляют +n, согласно правилу №2 (с учётом рядом стоящего аниона
– см. ТР)
Задание 1 – определите степени окисления всех атомов в формуле серной кислоты H2SO4?
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
H+1SxO4-2
2. Составим и решим уравнение, согласно правилу (II):
(+1)*1+(х)*1+(-2)*4=0
Х=6 или (+6), следовательно, у серы CО +6, т.е. S+6
Задание 2 – определите степени окисления всех атомов в формуле фосфорной кислоты H3PO4?
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
H3+1PxO4-2
2. Составим и решим уравнение, согласно правилу (II):
(+1)*3+(х)*1+(-2)*4=0
Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P+5
Задание 3– определите степени окисления всех атомов в формуле иона аммония (NH4)+?
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
(NхH4+1)+
2. Составим и решим уравнение, согласно правилу (II):
(х)*1+(+1)*4=+1
Х=-3, следовательно, у азота CО -3, т.е. N-3
Алгоритм составления формулы по степени окисления
Составление названий бинарных соединений
Сравним понятия «валентность» и «степень окисления»:
ЗАКРЕПЛЕНИЕ
Определите степени окисления атомов в формулах веществ:Br2, CaO , SiO2, H2CO3 , CuO , Cu2O , Н2, KNO3 , FeO , Fe , Fe2O3, Fe(OH)2, Fe2(SO4)3, N2, HClO4
Степень окисления в химии — определение и формулы
Условную величину в соединении, где атом элемента приобретает заряд, принимая или наоборот делясь электронами с остальными элементами, именуют степенью окисления.
В случаях, где элемент делится электроном, степень окисления становится положительной, при принятии частицы – отрицательной, так как электрон имеет отрицательный заряд.
Электроотрицательные элементы притягивают к себе электроны. Валентность атома влияет на рассматриваемую условную величину.
Для примера возьмём Н – самый первый элемент в таблице Менделеева, он имеет всего одну отрицательную частицу. В соединениях с неметаллами (например – H2O, H2S, HCl и т. д.), элементы с высокой электроотрицательностью тянут к себе электрон водорода, вследствие чего степень равняется единице. С металлами (KOH, CA(OH)2, NaOH и др.) всё происходит иначе. Так как электроотрицательность водорода выше в сравнении с ними, то ему свойственно притягивать электроны, и степень окисления равняется -1.
Нулю степень окисления атомов может равняться только в простых веществах, а в химических соединениях она постоянная или переменная.
Вследствие того, что металлам не свойственна высокая электроотрицательность, степень их окисления в формулах не может являться отрицательной. В отличие от них, неметаллам свойственна и положительная, и отрицательная величины.
Что необходимо для вычисления степени окисления
Общее количество атомных степеней, находящихся в составе молекулы, постоянно равняется нулю, это связано с тем, что молекула вещества электронейтральна. Эта особенность позволяет узнавать степень окисления атомов, высчитывая значения по известной формуле соединения.
В качестве примера рассмотрим серу: у S степень окисления бывает только -2, +4 и +6. Для того чтобы узнать степень окисления S в H2SO4, требуется составить и решить уравнение.
В формуле электроотрицательность Н будет равна +1 (элементы, чья электроотрицательность выше притягивают электрон водорода к себе, поэтому степень не отрицательна), а у кислорода она зачастую равняется -2. Электроотрицательность элементов можно посмотреть в специальной таблице.
Неизвестную величину обозначим у: H+12SуО-24.
Учитывая стехиометрические индексы, S: 2(+1) +у+4(-2) =0.
В результате получается, что у равен 6, следовательно, неизвестная величина в рассматриваемой формуле равна +6.
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.

- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Таблица. Степени окисления химических элементов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Электроотрицательность.
 Степень окисления и валентность.
Степень окисления и валентность.Электроотрицательность
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
Элементы, проявляющие постоянную СО | Значение постоянной СО этого элемента |
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Химический элемент | Номер группы | Высшая степень окисления |
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | 0 |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т. е. мы получаем два независимых уравнения:
е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д. р).
р).
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d-подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s-орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).
Из-за того что атом кислорода не имеет на внешнем уровне d-подуровня, распаривание электронов s и p-орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Таким образом, кислород практически всегда имеет валентность, равную II, однако в некоторых частицах он трехвалентен, в частности, в молекуле угарного газа C≡O. В случае, когда кислород имеет валентность III, одна из ковалентных связей образована по донорно-акцепторному механизму.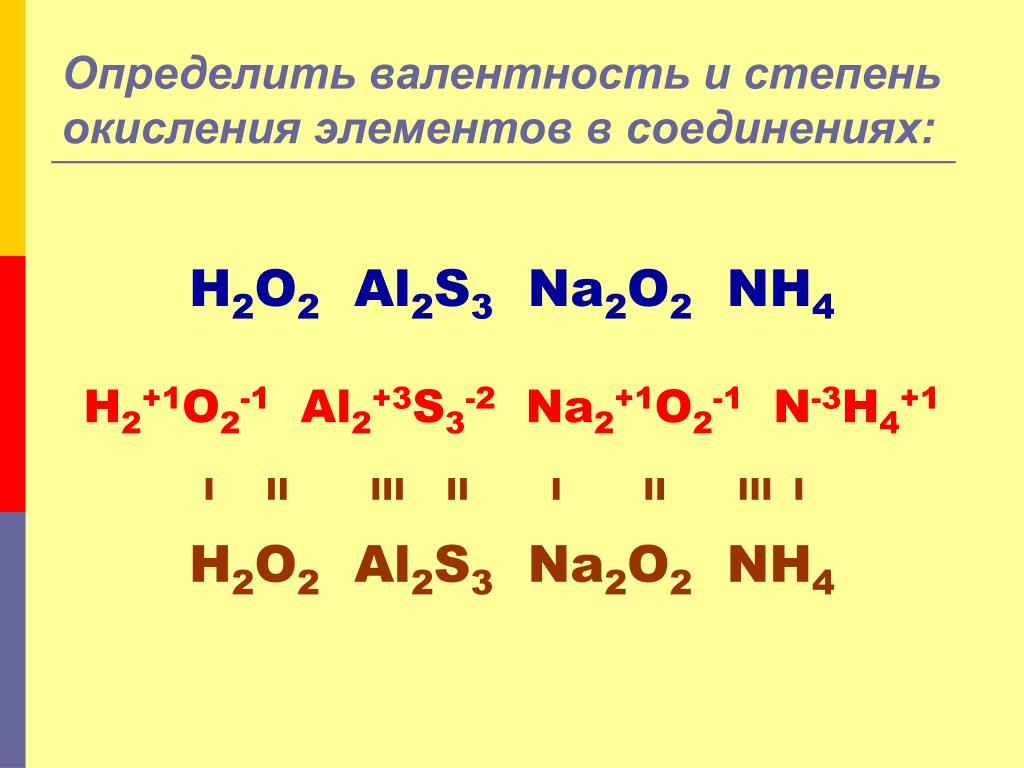
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H2S.
Как мы видим, у атома серы на внешнем уровне появляется d-подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p-подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO2, SF4, SOCl2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s-подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VI. Примером соединений с VI-валентной серой являются SO3, H2SO4, SO2Cl2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
Как рассчитать степень окисления элемента в соединении?
Степень окисления свободного элемента всегда 0.
Степень окисления одноатомного иона равна заряду иона.
Степень окисления # «H» # равна +1, но она равна -1 в сочетании с менее электроотрицательными элементами.
Степень окисления # «O» # в соединениях обычно составляет -2, но в пероксидах она равна -1.
Степень окисления элемента Группы 1 в соединении равна +1.

Степень окисления элемента 2 группы в соединении +2.
Степень окисления элемента 17 группы в бинарном соединении равна -1.
Сумма степеней окисления всех атомов в нейтральном соединении равна 0.
Сумма степеней окисления многоатомного иона равна заряду иона.
ПРИМЕР :
Какова степень окисления # «Cr» # в # «CrCl» _3 #?
Решение :
Мы используем все возможные правила для определения степени окисления.
Правило 7 гласит, что степень окисления Cl равна -1.
Мы пишем степень окисления элемента над его символом и общую степень окисления 3 атомов Cl под символом.
Это дает # «Cr» stackrelcolor (blue) («- 1») («Cl») _ 3 #
#color (white) (mmmmmmll) stackrelcolor (синий) («- 3» цвет (белый) (мм)) #.
Правило 8 гласит, что числа внизу должны быть равны нулю. Таким образом, число под # «Cr» # должно быть +3.
Это дает # «Cr» stackrelcolor (blue) («- 1») («Cl») _ 3 #
#color (white) (mmmmm) stackrelcolor (blue) («+ 3″ color (white) (ll) » -3 «цвет (белый) (мм)) #.
Есть только один атом # «Cr» #, поэтому его степень окисления +3.
Это дает #stackrelcolor (blue) (+ 3) («Cr») stackrelcolor (blue) («- 1») («Cl») _ 3 #
#color (white) (mmmmm) stackrelcolor (blue) («+ 3 «цвет (белый) (ll)» — 3 «цвет (белый) (мм)) #.
Степень окисления # «Cr» # в # «CrCl» _3 # равна +3.
Вот диаграмма, показывающая степень окисления атомов в некоторых обычных элементах и соединениях.
Окислительные состояния | Введение в химию
Цель обучения
- Предскажите степени окисления обычных элементов по номеру их группы.
Ключевые моменты
- Степень окисления чистого элемента всегда равна нулю.

- Степень окисления чистого иона эквивалентна его ионному заряду.
- Обычно водород имеет степень окисления +1, а кислород — степень окисления -2.
- Сумма степеней окисления всех атомов нейтральной молекулы должна равняться нулю.
Условия
- уменьшение усиления электронов, что вызывает уменьшение степени окисления
- окисление: потеря электронов, вызывающая увеличение степени окисления .
Степень окисления указывает степень окисления атома в химическом соединении; это гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были полностью ионными.Состояния окисления обычно представлены целыми числами, которые могут быть положительными, отрицательными или нулевыми. В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Наивысшая известная степень окисления +8 у тетроксидов рутения, ксенона, осмия, иридия, хассия и некоторых комплексов с участием плутония; самая низкая известная степень окисления -4 для некоторых элементов в углеродной группе.
Степени окисления плутония Здесь плутоний различается по цвету в зависимости от степени окисления.Повышение степени окисления атома в результате химической реакции называется окислением, и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением и связано с увеличением количества электронов.
Общие правила, касающиеся состояний окисления
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Для простого (одноатомного) иона степень окисления равна чистому заряду иона. Например, Cl — имеет степень окисления -1.
- Когда он присутствует в большинстве соединений, водород имеет степень окисления +1, а кислород — степень окисления −2. Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1 / 2 в супероксидах (например, KO).

- Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю. В ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду иона.
Прогнозирование состояний окисления
Как правило, степень окисления наиболее распространенных элементов может быть определена по номеру их группы в периодической таблице. Это показано в следующей таблице:
Типичные степени окисления наиболее распространенных элементов по группе Переходные металлы не включены, поскольку они имеют тенденцию проявлять различные степени окисления.Из приведенной выше таблицы можно сделать вывод, что бор (элемент III группы) обычно имеет степень окисления +3, а азот (элемент V группы) — степень окисления -3.Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо установленных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Как указано в правиле номер четыре выше, сумма степеней окисления для всех атомов в молекуле или многоатомном ионе равна заряду молекулы или иона. Это помогает определить степень окисления любого элемента в данной молекуле или ионе, предполагая, что мы знаем общие степени окисления всех других элементов.Например, в сульфит-ионе (SO 3 2- ) общий заряд иона равен 2-, и предполагается, что каждый кислород находится в своей обычной степени окисления -2. Поскольку в сульфите три атома кислорода, кислород вносит [латекс] 3 \ times-2 = -6 [/ latex] в общий заряд. Следовательно, сера должна иметь степень окисления +4, чтобы общий заряд сульфита составлял 2-: [латекс] (+ 4-6 = -2). [/ Latex]
Не путайте формальный заряд атома с его формальной степенью окисления, так как они могут быть разными (а часто и разными в многоатомных ионах).Например, заряд атома азота в ионе аммония NH 4 + равен 1+, но формальная степень окисления -3 — такая же, как у азота в аммиаке. В случае между аммиаком и аммиаком формальный заряд атома N изменяется, а его степень окисления — нет.
В случае между аммиаком и аммиаком формальный заряд атома N изменяется, а его степень окисления — нет.
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление связано с увеличением степени окисления
Восстановление включает снижение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный потенциал, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Изменилась ли степень окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и как несоединенные элементы с другой.Чтобы быть уверенным, проверьте все степени окисления :.
Степень окисления магния увеличилась — он окислился. Степень окисления водорода упала — она уменьшилась. Хлор находится в одинаковой степени окисления по обе стороны уравнения — он не был окислен или восстановлен.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
Проверка всех степеней окисления:
Ничего не изменилось.Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и разбавленным холодным раствором гидроксида натрия:
Очевидно, что хлор изменил степень окисления, потому что он попал в соединения, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Проверка всех степеней окисления показывает:
Хлор только вещь, чтобы изменить степень окисления. Он был окислен или восстановлен? Да! И то и другое! Один атом был восстановлен, потому что его степень окисления упала.Другой был окислен.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования — это реакция, в которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для определения окислителя и восстановителя
Это лишь незначительное дополнение к последнему разделу. Если вы знаете, что было окислено, а что восстановлено, вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
Степень окисления хрома изменилась с +3 до +2, и поэтому он был восстановлен. Цинк перешел от нулевой степени окисления в элементе до +2. Он был окислен.
Так что же происходит с уменьшением? Это цинк — цинк отдает электроны ионам хрома (III). Итак, цинк — это восстановитель.
Точно так же вы можете вычислить, что окислителем должны быть ионы хрома (III), потому что они отбирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата (VII) и ионами железа (II) в кислых условиях. Это прорабатывается далее на странице.
Если взглянуть быстро, становится очевидно, что ионы железа (II) окислены до ионов железа (III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились.Если определить степень окисления марганца, то она упала с +7 до +2 — снижение.
Итак, ионы железа (II) окислены, а ионы манганата (VII) восстановлены.
Что восстановило ионы манганата (VII) — ясно, что это ионы железа (II). Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Точно так же ионы манганата (VII) должны быть окислителем.
Использование степеней окисления для определения реакционных соотношений
Это иногда полезно, когда вам нужно выработать реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, переносится один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться увеличением степени окисления другого вещества на такую же степень окисления.
Этот пример основан на информации из старого вопроса AQA уровня A.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они более сложные, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). При этом церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы реагирующие пропорции?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна снизиться на 4 для компенсации.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3, то есть на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Реакционные пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или, если взять более общий пример, включающий ионы железа (II) и ионы манганата (VII). . .
Раствор манганата калия (VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа (II) до ионов железа (III). При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
Степень окисления марганца в ионе манганата (VII) +7. Название говорит вам об этом, но попробуйте еще раз просто для практики!
При переходе к ионам марганца (II) степень окисления марганца снизилась на 5. Каждый ион железа (II), который вступает в реакцию, увеличивает степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата (VII).
Следовательно, левая часть уравнения будет иметь вид: MnO 4 — + 5Fe 2+ +?
Правая часть будет: Mn 2+ + 5Fe 3+ +?
После этого вам придется гадать, как уравновесить оставшиеся атомы и заряды. В этом случае, например, весьма вероятно, что кислород попадет в воду. Это означает, что вам откуда-то нужен водород.
Это не проблема, потому что реакция протекает в растворе кислоты, поэтому водород вполне может происходить из ионов водорода.
В конечном итоге вы получите это:
Лично я предпочел бы выводить эти уравнения из электронных полууравнений!
Как определить степень окисления элементов в соединении
[Депонировать фотографии]В увлекательной науке химии есть понятие степени окисления, которое представляет собой число для формулировки окислительно-восстановительных реакций.
Чтобы быть кратким, в этой науке степень окисления означает условный заряд в атоме, который теряет или приобретает электроны, и эта цифра представляет собой метод расчета переноса электронов. Это число присваивается одному атому или группе атомов и характеризует количество перераспределенных электронов и показывает принцип переноса электронов в результате определенной химической реакции.
Определить степень окисления одновременно легко и сложно — она зависит от атомов и молекул, из которых они состоят.Часто бывает, что атомы некоторых химических элементов могут иметь совершенно разную степень окисления.
Чтобы упростить процесс определения степени окисления, используются специальные простые правила, и любой, кто знает основы химии и математики, сможет без труда найти определенную степень окисления с их помощью. Мы всегда должны помнить, что часто степень окисления и валентность элемента равны друг другу.
Эта научная тема широко изучается в школе, поэтому, чтобы понять, как определить степень окисления, мы предлагаем вам прочитать эту статью.
Первый этап: определяем, является ли химическое вещество элементарным.
Степень окисления атомов, которые никак не взаимодействуют с другими атомами в результате химических процессов, равна нулю.
Этот принцип применяется к группе веществ, состоящей из отдельных свободных атомов.Это правило также применяется к химическим элементам, которые состоят из двухатомных или многоатомных молекул только одного элемента.
[Депонировать фотографии]Например, железо Fe и кальций Ca имеют степень окисления ноль, потому что они состоят из одного элемента, который не связан химически с другими, как и многоатомные молекулы с одним и тем же типом атома, например, для озона O степень окисления также будет 0.
Расчет степени окисления в ионных соединениях
Степень окисления идентична заряду атомов или группы атомов. Этот принцип применим как к свободным ионам, так и к тем, которые входят в структуру химических соединений.
Например, степень окисления иона хлора равна -1, и если мы исследуем хлор в химическом соединении, например в соляной кислоте HCl, степень окисления этого элемента также будет -1. Поскольку ион водорода имеет степень окисления +1, заряд иона хлора равен -1, что означает, что его степень окисления равна -1.
Поскольку ион водорода имеет степень окисления +1, заряд иона хлора равен -1, что означает, что его степень окисления равна -1.
Ионы металлов могут иметь много степеней окисления
Мы рассмотрим это на примере железа (Fe), потому что его ион может иметь заряд +2 и +3. Заряд ионов металлических элементов можно определить по заряду других ионов в химическом соединении, и в формулах записи этот заряд обозначается римскими цифрами, например, железо (II) имеет степень окисления +2.Здесь вы найдете потрясающие безопасные эксперименты с железом.
Как определить степень окисления соединения?
Как мы уже установили, состав должен быть нейтральным. Рассмотрим AlCl₃.
[Викимедиа]Как мы уже говорили выше, заряд ионов хлора равен -1, а в этом соединении есть три атома хлора.Соответственно для компенсации минусов заряд алюминия должен быть +3.
Как определить степень окисления O₂?
Когда кислород находится в свободном состоянии (не вступая в реакцию с какими-либо элементами), степень окисления равна нулю (фактически, как и другие элементарные элементы).
Если кислород является компонентом любого гидроксида, например гидроксида водорода h3O2, он будет иметь степень окисления -1.
Если кислород взаимодействует с фтором (F), он будет иметь степень окисления +2.
Рассмотрим степень окисления водорода H
Этот химический элемент имеет степень окисления +1 (кроме молекулярного состояния водорода), но в исключительных случаях.
via GIPHY
Например, в воде H2O степень окисления водорода будет +1, потому что степень окисления кислорода равна -2, и поэтому все соединение, согласно правилам, имеет нейтральный заряд.
Но если мы возьмем NaH, степень окисления H будет -1, так как у натрия есть заряд +1.
Как определить степень окисления фтора (F)
Хотя степень окисления химических элементов в большинстве случаев зависит от множества факторов, фтор всегда будет иметь степень окисления -1. Это связано с тем, что фтор имеет низкую электрическую отрицательность, то есть атомы F неохотно вырываются из собственных электронов, но интенсивно притягивают электроны других элементов.
Правило: сумма степеней окисления равна заряду химического элемента.
Сумма степеней окисления всех атомов соединения должна быть нейтральной. С помощью этого правила мы можем проверить, ошиблись ли мы при решении химической задачи.
Как определить степень окисления? Вот несколько полезных советов, которые помогут в решении проблем:
Таблица Менделеева пригодится, чтобы сделать расчет точным. Вы должны научиться правильно им пользоваться и различать, где находятся металлы и неметаллы.
Чтобы найти степень окисления металлов, которая часто имеет несколько соответствующих значений, вы должны определить их по степеням окисления других атомов в соединении.
Если вы сложите все величины окисления атомов в химической связи, вы всегда получите нулевую степень окисления.
Наивысшая степень окисления элемента определяется с помощью таблицы Менделеева по группе, в которой он находится.
Металлы во всех соединениях имеют положительную степень окисления.
В соединениях с неметаллами водород имеет степень окисления +1, а степень окисления металлов — -1.
В соединениях кислород имеет степень окисления -2, за исключением H₂O₂, OF₂, K₂O₂.
[Депонировать фотографии] Степени окисления неметаллов при соединении с атомами металлов всегда будут отрицательными, но при взаимодействии с атомами неметаллов они могут иметь положительную или отрицательную степень окисления.
Чтобы найти наивысшую степень окисления неметаллов, из числа 8 вычтите номер группы, в которой находится элемент, и наивысшая степень окисления со знаком плюс будет равна количеству электронов на внешнем слое. . Чтобы узнать количество электронов во внешнем слое, посмотрите на номер группы в периодической таблице.
чисел окисления
чисел окисленияЧисло окисления
Часто бывает полезно следить за химическими реакциями, наблюдая за изменениями в окислении. количество атомов в каждом соединении во время реакции.Показатели окисления также играют важную роль. важную роль в систематической номенклатуре химических соединений. По определению, окисление число атома — это заряд, который атом имел бы, если бы соединение состояло из ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы. всего одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 , и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление количество натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом как в.LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S). в котором атом металла имеет степень окисления +1.
6. Элементы группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2.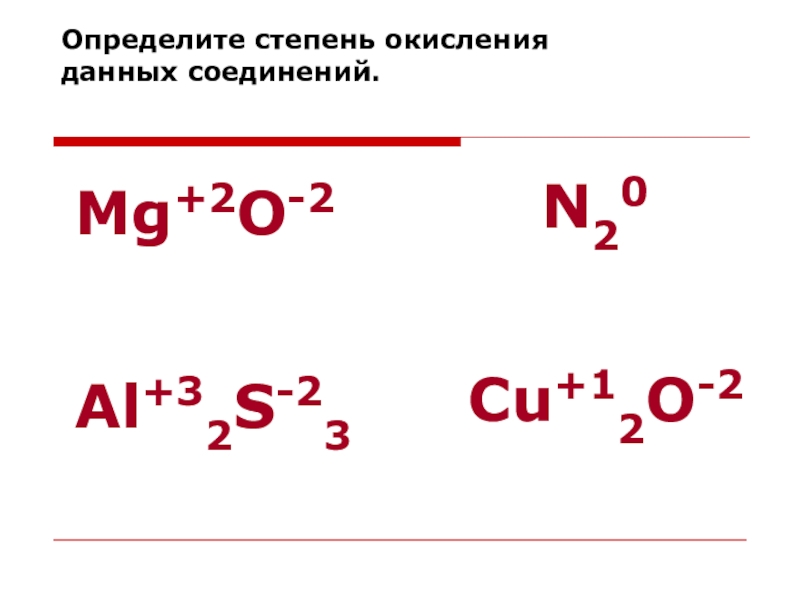 Исключения включают молекулы и
многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 ,
и ион O 2 2-.
Исключения включают молекулы и
многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 ,
и ион O 2 2-.
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10.Сумма степеней окисления многоатомного иона равна заряду на ион. Степень окисления атома серы в ионе SO 4 2- должна быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна равно -2.
СО 4 2- : (+6) + 4 (-2) = -2
11. Элементы в нижнем левом углу таблицы Менделеева. с большей вероятностью будут иметь положительную степень окисления, чем те, которые расположены в правом верхнем углу угол стола.Сера имеет положительную степень окисления в SO 2 , для Например, потому что он ниже кислорода в периодической таблице.
СО 2 : (+4) + 2 (-2) = 0
редокс — Как определить степень окисления атома в соединении, которое содержит как минимум два элемента, не являющихся водородом или кислородом?
окислительно-восстановительный потенциал — Как определить степень окисления атома в соединении, которое содержит как минимум два элемента, не являющихся водородом или кислородом? — Обмен химического стекаСеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.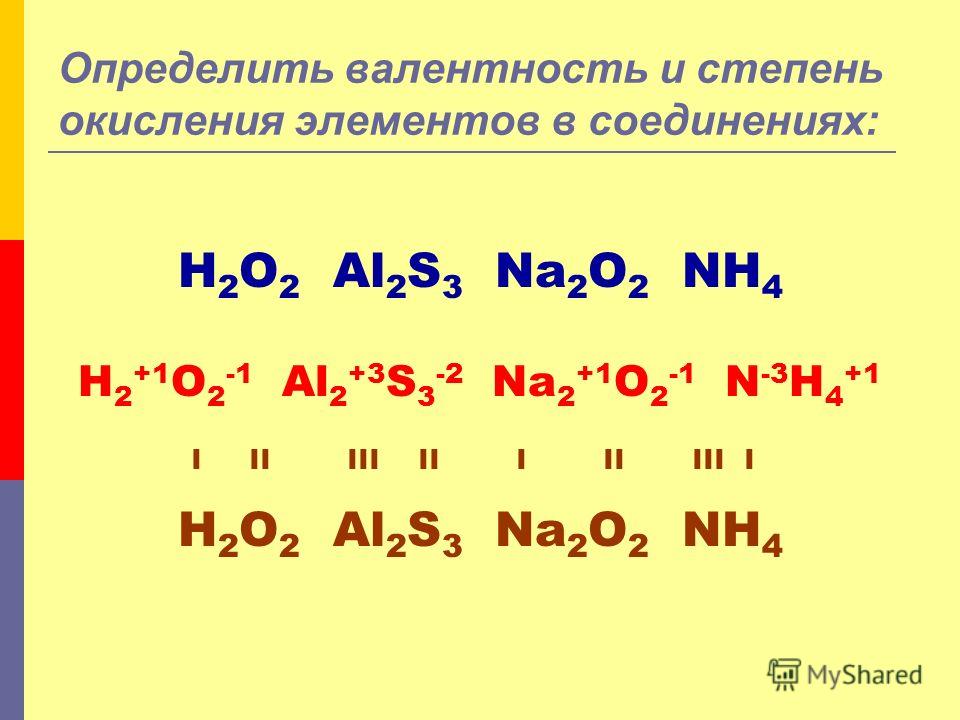
- 0
- +0
- Авторизоваться Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов в области химии.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществуКто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено 3к раз
$ \ begingroup $Вики говорит:
[Состояние окисления] определяется как заряд, который, как можно предположить, имеет атом при подсчете электронов в соответствии с согласованным набором правил:
Степень окисления свободного элемента (несоединенного элемента) равна нулю для простого (одноатомного) иона степень окисления равна суммарному заряду иона.
Водород имеет степень окисления 1, а кислород имеет степень окисления -2, когда они присутствуют в большинстве соединений. (Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов, например LiH, а кислород имеет степень окисления -1 в пероксидах, например h3O2. алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю, в то время как в ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду на ионе.
То же самое написано в моем учебнике. Но как мне найти быка? номер атома, входящего в состав вида $ \ ce {K2UO4} $?
M.A.R.9,7301818 золотых знаков6161 серебряный знак8686 бронзовых знаков
Создан 15 авг.
Анонимный9111 серебряный знак55 бронзовых знаков
$ \ endgroup $ 1 $ \ begingroup $В этом случае ионы калия равны +1 каждый, а атомы кислорода -2, как обычно.Это оставляет уран в сильно окисленном состоянии +6. Я думаю, что отсутствует информация о том, что ионы Группы 1 почти всегда находятся в состоянии +1, потому что они так легко теряют свой внешний валентный электрон. Молекула, которая не является ионом, как в вашем примере, должна иметь нулевой общий заряд.
Создан 15 авг.
$ \ endgroup $ 4 $ \ begingroup $ Технически (что может быть не тем ответом, который вам нужен) вы вычисляете степень окисления в молекуле, сначала рисуя ее диаграмму Льюиса (точечная), показывающая все валентные электроны. Затем вы назначаете электронную пару в каждой связи более электроотрицательному атому. Затем переконфигурируйте «заряды» на каждом атоме. Полученный «заряд» будет степенью окисления.
Затем вы назначаете электронную пару в каждой связи более электроотрицательному атому. Затем переконфигурируйте «заряды» на каждом атоме. Полученный «заряд» будет степенью окисления.
На протяжении многих лет люди находили короткие пути к этому. Например, щелочные металлы легко теряют электрон почти во всех ситуациях. Таким образом, у нас есть, например, что $ \ ce {Na} $ имеет степень окисления +1.
Карстен Тайс22.4k33 золотых знака3535 серебряных знаков101101 бронзовый знак
Создан 15 авг.
Пол Дж. Ганс Пол Дж. Ганс3,3791212 серебряных знаков1111 бронзовых знаков
$ \ endgroup $ 0 Chemistry Stack Exchange лучше всего работает с включенным JavaScriptВаша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie Настроить параметры
Число окисления и состояние окисления Chemistry Tutorial
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Что такое окислительное число?
Прежде чем мы рассмотрим, что такое степень окисления, стоит вспомнить, что такое ион и каково его зарядовое число.
Рассмотрим атом кислорода O, который имеет 6 валентных электронов.
Он имеет сильную тенденцию притягивать к себе 2 электрона, чтобы завершить свой октет электронов (он считается электроотрицательным).
Если атом кислорода получает 2 электрона, он образует оксидный ион O 2- с зарядом 2- (зарядовое число 2-).
Это происходит, когда наш атом кислорода встречает атом, который намного, намного менее электроотрицателен (то есть более электроположительный атом), такой как атом магния, Mg.
Если мы взаимодействуем газообразный кислород и металлический магний вместе в реакции окисления, то атом кислорода оттягивает 2 электрона атома магния, образуя ион магния, Mg 2+ , и ион оксида, O 2-.
Вместе они составляют сложный оксид магния, в котором отношение Mg 2+ к O 2- составляет 1: 1, поэтому соединение может быть представлено как Mg 2+ O 2-, но обычно приводится в виде «молекулярной» формулы MgO.
Обратите внимание, что соединение, Mg 2+ O 2- или MgO, не имеет общего чистого заряда, потому что количество положительных зарядов равно количеству отрицательных зарядов в соединении.
Зарядное число соединения равно 0.
Но что произойдет, если наш атом кислорода столкнется с другим атомом, который не способен оттягивать электроны от атома кислорода?
Например, атом, подобный азоту.
Представьте, что мы могли бы взаимодействовать газообразный азот и газообразный кислород вместе в реакции окисления с образованием новых соединений, которые являются оксидами азота.
Все эти новые соединения ковалентны, ионы отсутствуют.
Все эти новые соединения электрически нейтральны, у них нет общего заряда, зарядовое число каждого соединения равно 0.
Рассмотрим эти возможные соединения:
- NO (монооксид азота)
- NO 2 (диоксид азота)
Монооксид азота (NO) — наименее окисленная форма азота, она содержит наименьшее количество атомов кислорода.Можно сказать, что атом азота в NO находится в более низкой степени окисления, более низкой степени окисления.
Двуокись азота (NO 2 ) — наиболее окисленная форма азота, в ней содержится наибольшее количество атомов кислорода. Можно сказать, что атом азота в NO 2 находится в высшей степени окисления, высшей степени окисления.
Но подождите, а как насчет N 2 O (оксид диазота)? Является ли атом азота в N 2 O менее окисленным, чем NO, или более окисленным?
Чтобы ответить на этот вопрос, мы будем использовать понятие степени окисления, чтобы указать степень окисления (степень окисления) каждого атома азота в каждой указанной выше молекуле.
Степень окисления — это своего рода «учетная запись», помогающая нам понять, как электроны (отрицательные заряды) распределяются в молекуле.
Мы начнем с того, что скажем: «Давайте представим, что каждое из этих ковалентных соединений без суммарного общего заряда на самом деле является ионным, то есть в каждом соединении мы будем делать вид, что присутствует ион оксида, O 2-. Затем мы сможем определить, каким будет заряд каждого из этих воображаемых «ионов азота» ».
В этом сценарии NO представляет собой электрически нейтральную молекулу, у нее нулевой общий заряд, зарядовое число = 0.
Ион оксида, O 2-, имеет зарядовое число 2-
Итак, какой «заряд» должен быть у «иона азота», чтобы сбалансировать заряд оксидного иона?
Назовем неизвестный заряд х .
Чтобы молекула имела чистый заряд, равный 0, сумма зарядов всех «анионов» и «катионов» должна быть равна 0.
0 = заряд на ионе оксида + заряд на «ионе азота»
Заменитель 2- для заряда оксид-иона:
0 = 2- + х
Добавьте 2+ к обеим сторонам уравнения:
0 + 2+ = ( 2+ + 2- ) + x
2+ = x
Если атом азота несет заряд, то заряд будет 2+.
Но это НЕ ионное соединение, поэтому атом азота НЕ несет заряда.
Вместо этого мы ссылаемся на атом азота как на находящийся в окисленном состоянии (НЕ в заряженном состоянии), и мы ссылаемся на «кажущийся заряд» атома как на его степень окисления.
Теперь ясно, что мы не можем использовать 2+ для обозначения степени окисления, потому что это будет указывать число заряда на ионе, поэтому мы используем либо:
- римская цифра (знак положительной степени окисления не требуется, знак минус, — требуется перед римской цифрой для отрицательной степени окисления)
- арабское число (знак + или — перед числом)
Некоторые римские цифры и соответствующие им арабские числа приведены в таблице ниже:
| Арабский номер | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| Римская цифра | I | II | III | IV | В | VI | VII | VIII | IX | Х |
Нам нужно преобразовать «заряд» атома азота, вычисленный выше (2+), в степень окисления:
- Римская цифра II (знак положительной степени окисления не требуется)
- Арабское число: перед числом стоит знак +, то есть +2
Степень окисления азота в NO составляет II (или, альтернативно, +2)
Поскольку соединение NO НЕ является ионным, нам никогда не следовало называть атом кислорода в молекуле «оксидным ионом» с зарядовым числом 2-
Но мы МОЖЕМ называть каждый атом кислорода в соединении имеющим степень окисления -II (или, альтернативно, -2).
Рассчитаем степень окисления азота в наиболее окисленной форме NO 2 .
NO 2 — ковалентная молекула без общего суммарного заряда, зарядовое число = 0
Пусть каждый атом кислорода имеет степень окисления -II (в расчетах мы будем использовать -2)
Пусть x = степень окисления атома азота
Напишите выражение для расчета степени окисления атома азота:
зарядовое число молекулы = общее число степеней окисления кислорода + общее число степеней окисления азота
Поскольку в молекулярной формуле 2 атома кислорода и 1 атом азота:
зарядовое число молекулы = 2 × степень окисления кислорода + степень окисления азота
Подставьте степени окисления в уравнение:
0 = (2 × -2) + x
0 = -4 + х
Добавьте +4 к обеим сторонам уравнения:
+4 + 0 = +4 + -4 + x
+4 = х
Степень окисления азота в NO 2 равна IV (или, альтернативно, +4)
Обратите внимание, что NO представляет собой менее окисленную форму азота, чем NO 2 , потому что:
- содержит меньше кислорода на атом азота
(поэтому валентные электроны азота испытывают меньшее притяжение со стороны атомов кислорода) Азот - имеет более низкую степень окисления, чем в NO 2
А как насчет N 2 O?
Степень окисления азота в N 2 O равна I (или, альтернативно, +1), что меньше степени окисления азота в NO (которая равна II или +2), поэтому N 2 O представляет собой менее окисленную форму азота, чем NO.
Вы увидите два разных метода, используемых для определения степени окисления атома в соединении, как указано ниже:
- Рекомендуемые ИЮПАК числа окисления используют римские цифры.
(a) Если степень окисления положительная, она обозначается степенью окисления ТОЛЬКО римской цифрой (без знака +), например I, II.
(b) Если степень окисления отрицательная, она обозначается степенью окисления с использованием знака минус (-) непосредственно перед римской цифрой, например, -I, -II.
(c) Если степень окисления равна нулю, на это указывает степень окисления с использованием арабского числа 0.
- В альтернативном методе указания степени окисления атома для обозначения степени окисления используются знаки и арабские числа (эти арабские числа проще использовать в расчетах):
(a) Если степень окисления положительная, она обозначается степенью окисления с использованием знака плюс (+) непосредственно перед арабским числом, например, +1, +2.
(b) Если степень окисления отрицательная, она обозначается степенью окисления с использованием знака минус (-) непосредственно перед арабским числом, например, -1, -2.
(c) Если степень окисления равна нулю, это указывается степенью окисления с использованием арабского числа 0.
Мы можем использовать понятие степени окисления, даже если в молекуле нет кислорода!
Мы можем применить понятие степени окисления к атомам гидридов, фторидов, хлоридов, бромидов, йодидов, нитридов, сульфидов, фосфидов и т. Д.
Но прежде чем мы сможем это сделать, нам нужно будет изучить правила присвоения степеней окисления…


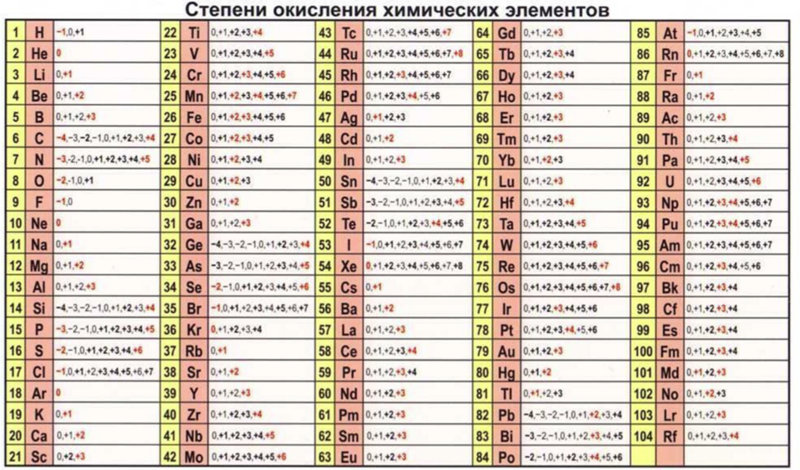
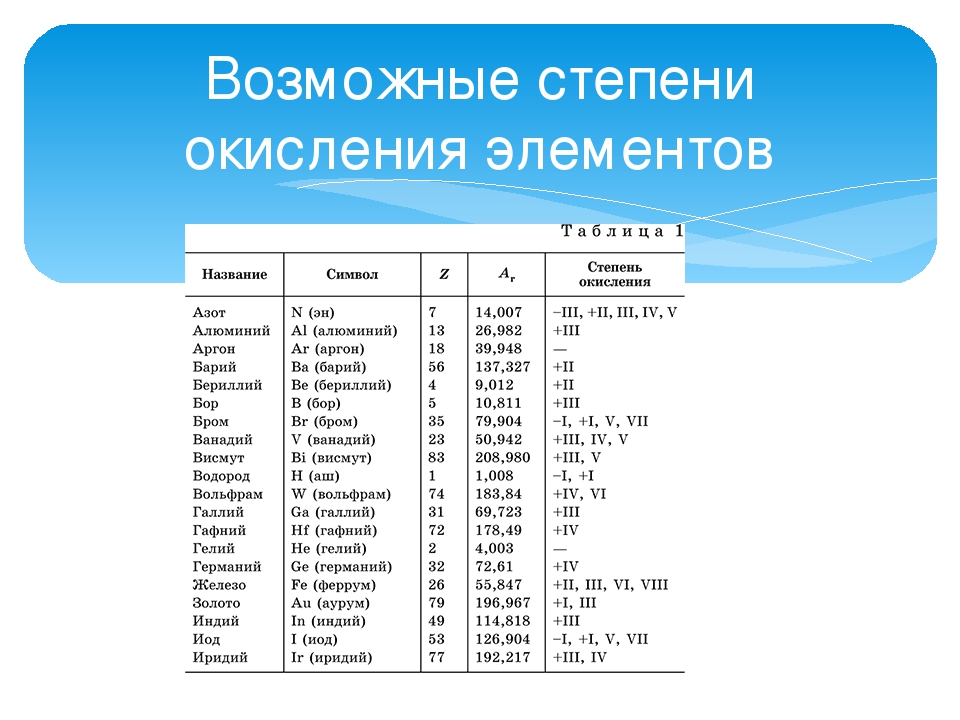
 Степени окисления химических элементов по номеру.
Степени окисления химических элементов по номеру.
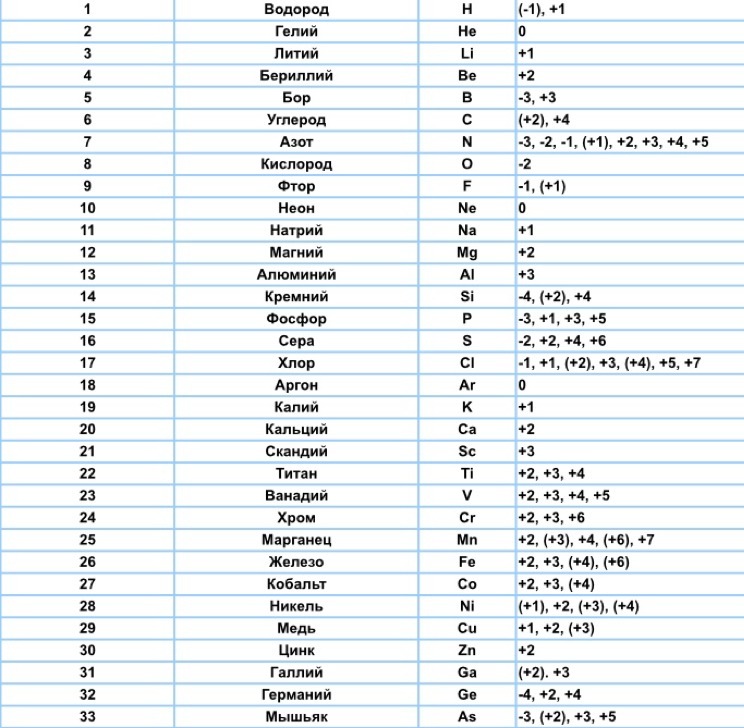

 Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе – заряду иона.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе – заряду иона.
 Степени окисления химических элементов по алфавиту.
Степени окисления химических элементов по алфавиту.
 Степени окисления химических элементов по номеру.
Степени окисления химических элементов по номеру.
